枣酒酿造用酵母的筛选及发酵性能研究
2015-09-29王庆科孙中贯海南大学食品学院海南海口5708枣庄学院生命科学学院山东枣庄77160天津科技大学生物工程学院天津300457
王庆科,孙中贯*,陈 青(1.海南大学食品学院,海南海口5708;.枣庄学院生命科学学院,山东枣庄77160;3.天津科技大学生物工程学院,天津300457)
枣酒酿造用酵母的筛选及发酵性能研究
王庆科1,2,孙中贯2,3*,陈青2
(1.海南大学食品学院,海南海口570228;2.枣庄学院生命科学学院,山东枣庄277160;3.天津科技大学生物工程学院,天津300457)
以枣庄长红枣发酵液和枣园土壤为酵母菌株的分离源,经过富集培养和多次划线分离纯化,来获得优良的枣酒酿造酵母菌株。经过酵母菌株的产气性能和产酒精性能比较,以及耐酒精、耐酸、耐糖、耐SO2等耐性试验,得到了发酵性能较强的酵母菌株Z03、Z13、Z34。经过染色,镜检观察其细胞形态和芽殖方式,确定为酵母菌,经WL培养基培养后观察,初步鉴定其属于酵母属的酿酒酵母(Saccharomyces cerevisiae)。将这三株酵母与活性干酵母按照枣酒发酵工艺程序进行发酵,发酵出来的枣酒经感官评定和理化检测,最终筛选出适合枣酒发酵酵母菌株Z13和Z34,其酒精度为9.5%vol和10.8%vol。
长红枣;酿酒酵母;筛选;鉴定;枣酒
红枣(Zizyphus jujube)是鼠李科枣属植物枣树(Zizyphus jujubeMill)的果实,枣中含有丰富的糖类、蛋白质、矿物质和维生素等营养物质[1]。研究分析表明,枣中含有16种氨基酸,其中包括8种人体必需氨基酸和幼儿体内无法合成的组氨酸和精氨酸[1-2]。枣不仅具有较高的营养价值,而且具有良好的医疗功效,常被用作天然的兴奋剂、缓和药性和镇咳剂,应用于食品、食品添加剂和增香剂中[3],也有研究表明,红枣也是一种天然的抗氧化剂[4]。近年来,随着人们消费水平的不断提高,具有一定营养保健价值的各类低度果酒的需求量会逐渐增加,果酒同时也成为国家酒类发展的重点[5]。红枣酒是酵母菌株利用红枣中的糖进行酒精发酵而得的一类保健型果酒,由于其风味独特,营养价值较高,深受消费者喜爱,市场前景巨大。
酵母是果酒发酵的原动力,酵母菌种的发酵性能直接影响所酿果酒的口感和风味[6]。目前酿造红枣酒的酵母多为延用葡萄酒酵母或果酒干酵母,缺乏专用的酵母菌株,导致枣酒产品同质化严重,使得枣酒风味不突出。张陈云等[7]以冬枣皮和冬枣汁筛选出了适合冬枣酒酿造的酵母菌株。牛希跃等[8]通过比较3种葡萄酒酵母的发酵性能发现了酿造骏枣果酒的最适酵母为SY葡萄酒酵母。同时关于研究筛选适合红枣酒的专用酵母的报道较少,本研究从山东枣庄当地枣园土壤和红枣发酵液中筛选出了多株野生酵母菌株,通过测试野生酵母菌株对红枣汁的发酵能力和产酒精能力,并通过耐性试验从中选育出符合当地红枣酒酿造的天然野生酵母菌株,以期望来改善当地红枣酒的品质。
1 材料与方法
1.1材料与试剂
1.1.1原料
红枣:市售以及采摘于山东枣庄枣园;土壤:在枣园不同棵枣树下采集;酿酒高活性干酵母:安琪酵母有限公司。
1.1.2培养基
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)液体培养基:1%酵母膏,2%蛋白胨,2%葡萄糖,于1×105Pa条件下灭菌15 min。
YPD固体培养基:YPD液体培养基中添加2%琼脂粉。
麦氏培养基:葡萄糖1 g,氯化钾1.8 g,酵母浸膏2.5 g,醋酸钠8.2 g,琼脂15~20 g,蒸馏水1 000 mL,pH自然,于1×105Pa条件下灭菌15 min。
WL培养基:酵母浸粉0.5%,胰蛋白胨0.5%,葡萄糖5%,琼脂2%,磷酸二氢钾0.055%,氯化钾0.042 50%,氯化钙0.012500%,氯化铁0.000250%,硫酸镁0.012500%,硫酸锰0.000 250%,溴甲酚绿0.002 200%,pH值为6.5,于1×105Pa条件下灭菌20 min。
耐酒精培养基:向YPD液体培养基中加入不同体积分数(5%、10%、12%、14%、15%)的乙醇。
耐酸培养基、耐糖培养基、耐SO2培养基的配制方法类似于耐酒精培养基。
1.1.3试剂
蛋白胨、葡萄糖、氯化钾、醋酸钠、氯化钾、氯化钙、氯化铁、硫酸镁、硫酸锰、溴甲基酚绿等化学试剂均为国产分析纯;酵母膏、酵母浸膏等均为市售生化试剂。
1.2仪器与设备
HCB-1800H水平层流洁净工作台:青岛海尔特种电器有限公司;HNY-恒温培养振荡器:天津市欧诺仪器仪表有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;BCD-257F青岛海尔冰箱:山东青岛海尔公司;G80F23CN3L微波炉:格兰仕微波炉电器有限公司;JT201N电子天平:上海精天电子仪器有限公司;SPL-250生化培养箱:天津市莱伯特瑞仪器设备有限公司;YE3K007064可调式移液器:上海雷勃分析仪器有限公司;BM2000双目生物显微镜:上海议圆光学仪器有限公司。
1.3试验方法
1.3.1酵母菌株的初筛
以枣园土壤和红枣发酵液为分离源,将采集的多棵枣树的土壤分别称取10 g,放入100 mL无菌水的三角瓶中,摇匀后在吸取上述培养液10mL,注入90mLYPD液体培养基中于30℃、120 r/min的摇床培养24 h,同时将培养液以梯度稀释方法涂布于麦氏培养基平板上进行酵母菌株的分离纯化[9]。
将红枣去核后加水打浆,放入30℃的恒温培养箱内发酵5~7 d。取发酵好的红枣发酵液涂布于YPD固体培养基培养酵母菌落,挑取具有典型酵母菌形态特征的菌落转接与麦氏培养基上和YPD固体培养基中进行分离纯化,经镜检合格后转接于斜面保存待用。
1.3.2菌株产气性能比较
将纯化得到的野生酵母菌株活化后每个菌株取1 mL分别接种到装有杜氏小管的YPD液体培养基中,于30℃的恒温培养箱内发酵48 h,记录产气时间和产气量。
1.3.3菌株产酒精能力比较
将上一级得到的产气性能较好的酵母菌株活化后,每个菌株取10 mL接入200 mL枣汁发酵液中,于30℃的恒温培养箱内发酵5~7 d,测定发酵液的酒精度,进一步筛选产出酒精能力较强的酵母菌株。
1.3.4菌株耐性试验
(1)耐酸试验:将活化后的野生酵母菌株取1 mL接种到柠檬酸质量浓度分别为10 g/L、15 g/L、20 g/L、25 g/L、30 g/L的耐酸培养基(内装杜氏管)中,于30℃的恒温培养箱内发酵,观察产气情况。
(2)耐酒精试验:将活化后的野生酵母菌株取1 mL接种到乙醇体积分数分别为5%、10%、12%、14%、15%的耐酒精培养基(内装杜氏管)中[10],于30℃恒温培养箱发酵,观察产气情况。
(3)耐糖试验:将活化后的野生酵母菌株取1 mL接种到白砂糖含量分别为10%、20%、30%、40%的耐糖培养基(内装杜氏管)中[7],于30℃恒温培养箱内发酵,观察产气情况。
(4)耐SO2性能试验:将活化后的野生酵母菌株取1mL接种到相当于二氧化硫质量浓度分别为80mg/L、100mg/L、120mg/L、140mg/L、160mg/L的耐SO2培养基(内装杜氏管)中[11],于30℃恒温培养箱内发酵,观察产气情况。
1.3.5酿酒酵母的鉴定
取一滴0.05%美兰染色液于载玻片中央,用灭菌后的接种环取酵母悬液与染色液混匀,染色2~3 min后加盖玻片。再用低、高倍镜分别观察其细胞形态、芽殖方式。此外可以根据酵母是否染上蓝色区别细胞的死活。
不同的酵母在WL培养基上呈现不同的菌落形态,因此可以利用WL培养基对筛选的菌株作初步的鉴定[12]。
1.3.6枣酒加工工艺流程
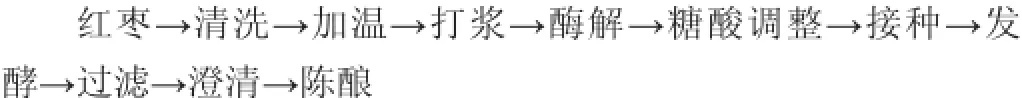
操作要点:将红枣洗干净后去核,于60℃的热水中浸泡1h,打浆后加入0.08%的果胶酶于50℃的恒温培养箱内酶解3 h,可以提高枣汁中可溶性固形物含量。然后按照不同的料液比调整枣汁发酵液,使发酵液含糖量为20%左右。用柠檬酸调pH值为3.5[12],向枣液中加入80 mg/L的SO2[13],同时添加0.05%的酵母粉来补充所需要的氮源[14]。待枣液冷却至35℃左右,以106个/mL接种酵母菌[15](菌株活化参考文献[15]),混匀,进行酒精发酵,于25℃条件发酵7 d。当发酵液糖度不再降低时,酒精度不再升高时,主发酵结束,同时降低发酵温度于4~6℃的恒温箱中进行后发酵[16]。
1.3.7枣酒理化检测及感官评定
样品的色泽在波长425 nm处的吸光度值来表示[17],用吸光度值反映样品的色度值;酒精度的测定采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的比重计法[18];可溶性固形物含量用手持折光仪测定[19]。感官评定按照GB/T 10220—2012《感官分析方法学总论》中的方法[20]。
2 结果与分析
2.1酵母菌的初筛
经过YPD液体培养基的富集培养以及通过在YPD固体培养基和麦氏培养基上多次划线分离纯化,在土壤中分离得到了10株酵母菌株,在枣汁发酵液中得到了36株酵母菌株,一共得到了46株菌株,分别命名为Z01、Z02……Z46。
2.2菌株杜氏小管发酵产气性能比较
对获得的46株菌株进行杜氏管发酵产气试验,以酿酒活性干酵母作为对照菌株,产气量较快的17株菌株试验结果见表1。
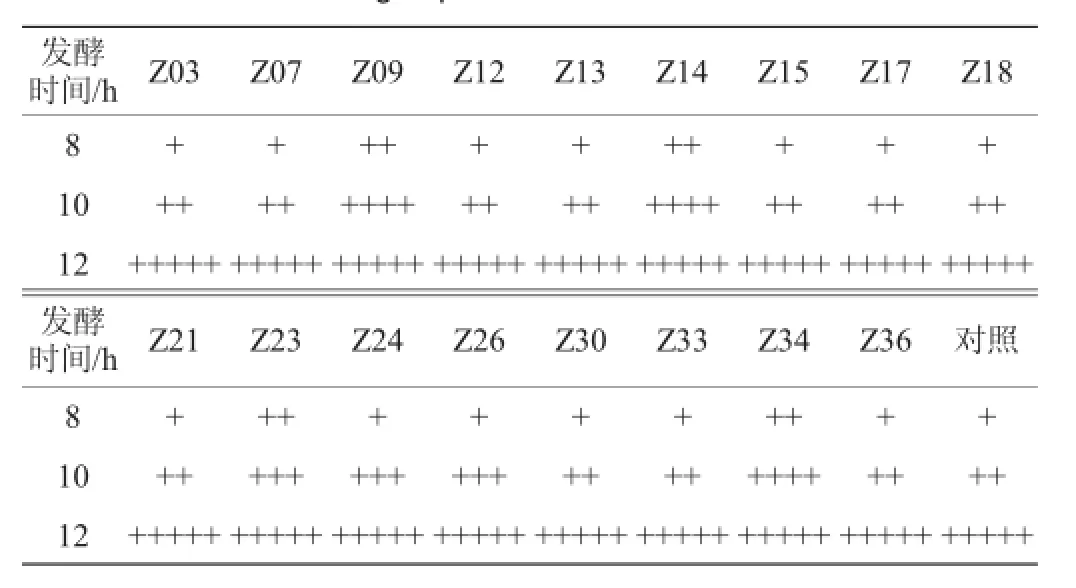
表1 筛选菌株发酵产气试验结果Table 1 Results of gas production tests of screened strains
由表1可知,17株菌株均在第8小时开始发酵产气,并且都能在12 h内产满杜氏小管,这一试验结果说明这17株菌株发酵产气性能优良,并且与对照菌株相比,部分菌株发酵产气速度快于于对照菌株,故将以上菌株作为下一步产酒精能力测试的菌株。
2.3菌株的产酒精能力比较
通过检测以上17株酵母菌株的发酵液的酒精度,得出产酒精度>7%vol的酵母菌有5株,产酒精度5%vol~7%vol的酵母菌有10株,并且这15株酵母菌株发酵生产出的红枣酒枣香味较浓郁,有典型的枣酒风味,故将这15株酵母菌株作为下一步耐性筛选的备选菌株。而菌株Z12、Z14产酒精度<5%vol,产酒精能力较弱,故不予考虑。
2.4菌株耐酸试验
对上述获得的15株菌株进行耐酸试验,以酿酒活性干酵母作为对照菌株,结果见表2。

表2 筛选菌株耐酸试验结果Table 2 Results of acid resistance tests of screened strains

续表

续表
由表2可知,在柠檬酸质量浓度为10 g/L时,所有的菌株均能在10 h内使杜氏小管产满气体,当柠檬酸质量浓度增大至25 g/L时,可以看出Z15、Z17、Z18、Z23、Z24、Z30菌株发酵产气能力较弱,故淘汰这5株菌株。同时Z03、Z07、Z09、Z13、Z21、Z26、Z33、Z34菌株均能在柠檬酸质量浓度>25 g/L时发酵产气,并且耐酸性也优于酿酒活性干酵母,因此将其作为下一步耐酒精的测试菌株。
2.5菌株耐酒精试验
对上述获得的8株菌株进行耐酒精试验,以酿酒活性干酵母作为对照菌株,结果见表3。

表3 筛选菌株耐酒精试验结果Table 3 Results of alcohol resistance tests of screened strains
由表3可知,在酒精度为5%vol和10%vol时,以上菌株发酵产气均能在24 h内产满杜氏小管,当酒精度为12%vol和14%vol时,Z21菌株未能发酵产气,故淘汰Z21菌株。在酒精度为14%vol时,Z03、Z07、Z13、Z26、Z33、Z34均能发酵产气,且产气较快,故作为下一步耐糖试验的备选菌株。
2.6菌株耐糖试验
对上述获得的7株菌株进行耐糖试验,以酿酒活性干酵母作为对照菌株,结果见表4。
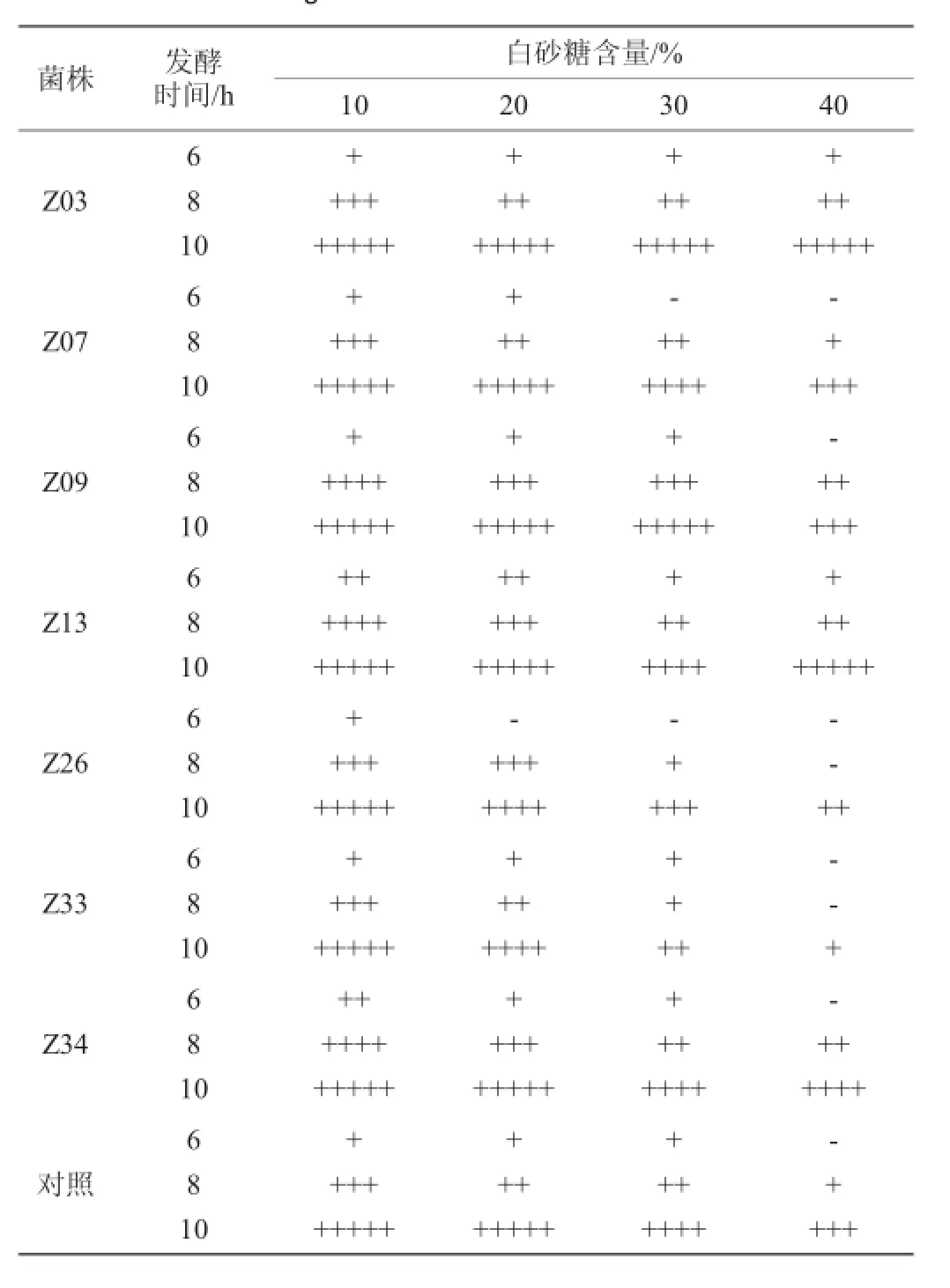
表4 筛选菌株耐糖试验结果Table 4 Results of glucose resistance tests of screened strains
由表4可知,在糖含量为10%~30%时,以上酵母菌株均能发酵产气,其中Z03、Z07、Z09、Z13、Z34酵母菌株与对照菌株相比均能在10h内发酵产气产满杜氏小管,在糖含量为40%时Z03、Z13、Z34等酵母菌株发酵产气能力较好。但Z26、Z33菌株在糖含量逐渐增大时发酵产气能力越来较弱,不合适用于枣酒发酵生产,故淘汰这两株酵母菌株。
2.7菌株耐SO2试验
对上述获得的5株菌株进行耐SO2试验,以酿酒活性干酵母作为对照菌株,结果见表5。

表5 筛选菌株耐SO2试验结果Table 5 Results of SO2resistance tests of screened strains
由表5可知,Z07、Z09酵母菌株在二氧化硫质量浓度为140 mg/L和160 mg/L时产气较慢,且不能产满杜氏小管,故淘汰这两株菌株。而Z03、Z13、Z34酵母菌株在80 mg/L和160 mg/L之间耐受二氧化硫性能较好,故保留这三株酵母菌株作为枣酒发酵生产的菌株,并对其进行进一步鉴定。
2.8菌株的细胞及菌落形态
Z03、Z13、Z34菌株的细胞及菌落形态观察结果分别见图1和图2。
由图1可知,菌株Z03的细胞形态大部分为球形,部分为椭圆形,大部分酵母细胞以单端出芽为主,菌株Z13和菌株Z34细胞形态大部分为球形,也以单端出芽的方式繁殖。同时3株酵母菌的活细胞较多,说明菌株细胞活力较强。
由图2可知,菌株Z03、Z13、Z34在WL培养基上菌落形态特征四周为奶淮色,中间为绿色,球形突起,表面光滑,不透明,符合酿酒酵母的菌落形态特征,所以Z03、Z13、Z34初步鉴定为酿酒酵母。

图1 菌株Z03(A),Z13(B)及Z34(C)的细胞形态Fig.1 Cell morphology of strain Z03(A),Z13(B)and Z34(C)
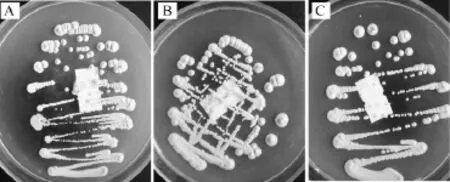
图2 菌株Z03(A),Z13(B)和Z34(C)的菌落特征Fig.2 Colony characteristics of strain Z03(A),Z13(B)and Z34(C)
2.9枣酒发酵质量评定
以筛选出的菌株Z03、Z13、Z34研制枣酒,以酿酒活性干酵母作为对照,其感官评定及理化检测结果分别见表6及表7。

表6 枣酒感官评定结果Table 6 Sensory evaluation results of jujube wine
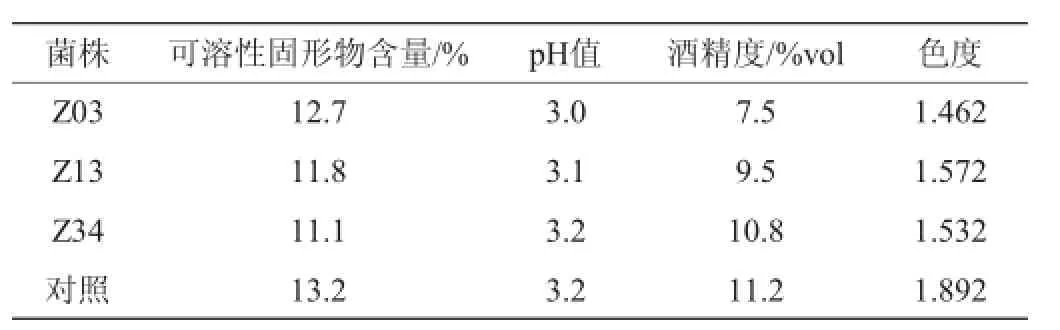
表7 枣酒理化检测指标Table 7 Physical and chemical indexes of jujube wine
由表6和表7可知,Z03菌株发酵出来的枣酒稍浑浊,且枣香味较淡,不适合作为枣酒生产用的菌株。Z13和Z34的菌株发酵生产的枣酒风味和口感较符合人们需求,并且这两株菌株发酵生产的枣酒的酒精度也符合低度酒的要求,因此可以确定菌株Z13和Z34是适合生产枣酒的优良菌株。
3 结论
本研究通过对枣树土壤和红枣发酵液中的酵母菌株进行分离筛选和性能测试,得到了两株具有高性能的酵母菌株,应用这两株野生酵母菌株发酵生产的枣酒的酒精度分别9.5%vol和10.8%vol,并且枣酒的口感、香气、和典型性特征方面均达到果酒生产要求的国家标准,各项理化指标也优于酿酒活性干酵母。本研究对这两株野生酵母菌株只是进行了初步的鉴定,若应用于大规模的生产实践,还需要对菌株深入进行分子生物学方面的鉴定。
[1]杜荷,薛自萍,曹冬冬,等.大枣的保健与抗氧化功能成分的研究进展[J].食品科学,2014,35(Z1):72-74.
[2]樊保目.枣果的功能因子与保健食品的研究进展[J].食品科学,2005,26(9):587-591.
[3]LI J W,FAN L P,DING S D.Nutritional composition of five cultivars of Chinese jujube[J].Food Chem,2007,(2):454-460.
[4]ZHAO H X,ZHANG H S,YANG S F.Phenolic compounds and its antioxidant activities in ethanolicextracts from seven cultivars of Chinese jujube[J].Food Sci Hum Well,2014,3(3-4):183-190.
[5]刘永衡,华惠敏,吴桂君,等.果酒酵母选育及酵母对香气成分影响研究进展[J].中国酿造,2013,32(10):5-8.
[6]ROM ANO P,FIORE C,PARAGGIO M,et al.Function of yeast species and strains in wine flavour[J].Int J Food Microbiol,2003,86(1/2):169-180.
[7]张陈云.冬枣果酒酿造酵母的分离筛选研究[J].中国酿造,2010,29(8):43-47.
[8]牛希跃,许倩,杨海燕.酿制红枣酒酵母菌的筛选[J].新疆农业科学,2012,49(12):2213-2221.
[9]郝瑶,王陶,李文,等.富硒猕猴桃果酒酵母的筛选及鉴定[J].食品科学,2014,35(21):175-179.
[10]LEE Y T,CHOI Y R,LEE S Y,et al.Screening wild yeast strains for alcohol fermentation from various fruits[J].Mycobiol,2011,39(1):33-39.
[11]陈金丽,郭阳,薛洁,等.优良野生葡萄酒酵母的筛选及性能评价[J].食品与发酵工业,2012,38(5):106-111.
[12]薛军侠,徐艳文,杨莹,等.WL培养基在酿酒酵母筛选中的应用[J].中国酿造,2007,26(9):36-39.
[13]王孝荣,罗佳丽,潘年龙,等.草莓果酒酿造工艺的优化及其香气成分分析[J].食品科学,2014,35(7):196-201.
[14]刘延琳,刘伟,夏加贵.白葡萄酒活性干酵母对不同氮源利用的研究[J].微生物学杂志,2007,27(1):88-90.
[15]王立霞,陈锦屏,李鹏,等.和田玉枣酒主发酵的影响因素探究[J].食品科学,2007,28(10):388-391.
[16]任琪,寻华凤,程江华,等.枣酒发酵工艺条件的研究[J].中国酿造,2009,28(5):167-169.
[17]王晨,李志西,郑淑彦,等.红枣酒发酵工艺比较研究[J].中国酿造,2011,30(9):129-131.
[18]中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[19]吴国峰,李国全,马永强,等.工业发酵分析[M].北京:化学工业出版社,2006.
[20]中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量监督检测中心.GB/T 10220—2012感官分析方法学总论[S].北京:中国标准出版社,2012.
Screening and fermentation properties of yeast for jujube wine
WANG Qingke1,2,SUN Zhongguan2,3*,CHEN Qing2
(1.College of Food Science,Hainan University,Haikou 570228,China;2.College of Life Science,Zaozhuang University,Zaozhuang 277160,China;3.College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China)
Superior yeasts for jujube wine was obtained from the jujube fermentation broth and jujube orchard soil by enrichment culture and repeated plate streaking.Comparing with gas production and alcohol production performance of yeast and alcohol resistance,acid resistance,sugar resistance,SO2resistance and other performance tests,the yeast(Z03,Z13,Z34)which had strong fermentation properties were obtained.After staining,cell morphology and budding way,it was determined asSaccharomycetessp.Then it was identified asSaccharomyces cerevisiaeafter WL cultivate. According to the jujube wine fermentation process,using the three strains of yeast and active dry yeast,jujube wine was fermented.By sensory evaluation and physicochemical examination,the yeast which was suited for jujube wine was determined as yeast Z13 and Z34,and the alcohol content of jujube wine was 9.5%vol and 10.8%vol,respectively.
jujube;Saccharomyces cerevisiae;screening;identification;jujube wine
Q939
A
0254-5071(2015)11-0103-06
10.11882/j.issn.0254-5071.2015.11.024
2015-09-21
校级博士科研启动基金(NO.2014BS14)
王庆科(1990-),男,硕士研究生,研究方向为应用微生物技术。
孙中贯(1984-),男,讲师,博士,研究方向为现代酿造技术。
