1H-MRS和临床相关因素在新生儿脑白质弥漫性高信号诊断中的应用价值
2015-09-26孛茹婷姬广海郑义刘岭岭吴玉华杨文君陈志强
孛茹婷,姬广海,郑义,刘岭岭,吴玉华,杨文君,陈志强*
1H-MRS和临床相关因素在新生儿脑白质弥漫性高信号诊断中的应用价值
孛茹婷1,姬广海1,郑义1,刘岭岭2,吴玉华3,杨文君4,陈志强2*
投稿日期:2015-08-19
接受日期:2015-10-05
目的 运用单体素氢质子波谱技术(1H-MRS)观察新生儿脑白质弥漫性高信号(DEHSI)成像特点,探讨DEHSI的演变规律及诊断价值。材料与方法 对95名新生儿运用点分辨波谱序列对其脑组织兴趣区所得代谢数据进行分析研究。结果 生后年龄、胎龄、头围均与DEHSI评估之间呈显著负相关(r=-0.398、r=-0.390、r=-0.269,P值均<0.05)。胎龄、生后年龄与NAA/Cr (r=0.386、r=0.328,P值均<0.05),NAA/Cho (r=0.432、r=0.367,P值均<0.05)呈正相关,与Cho/Cr (r=-0.204、r=-0.211,P值均<0.05),MI/Cr (r=-0.243、r=-0.286,P值均<0.05)呈负相关。此外,随着DEHSI的程度增加,NAA浓度,NAA/Cr和NAA/Cho比值下降(r=-0.320、r=-0.394、r=-0.565,P值均<0.05),而Cho/Cr和MI/Cr增加(r=0.389、r=0.376,P值均<0.05)。单因素方差分析:与正常组相比,轻度DEHSI组及中重度DEHSI组Cho/Cr和MI/Cr比值显著升高(P值均<0.05),而NAA/Cr、NAA/Cho比值显著下降(P值均<0.05)。结论 生后年龄、胎龄、头围与DEHSI评估之间呈负相关;胎龄及生后年龄与新生儿脑组织代谢物水平有关;胎龄越大,胎儿越成熟,DEHSI分级越低,NAA浓度升高。
新生儿;脑;弥漫性高信号;磁共振波谱学
弥漫性高信号(diffuse excessive high signal intensity,DEHSI)是在T2WI以正常无髓鞘化白质为参考,在双侧脑室周围及皮层下白质表现为信号增高的一种现象[1]。研究表明,DEHSI可能导致患儿认知、感觉神经及行为发育障碍等[2]。磁共振波谱(MRS)可无创性定量检测人体细胞生物化学和代谢变化。笔者应用单体素1H-MRS技术对95名新生儿脑白质进行研究,提高对其演变发展规律的理解,明确异常代谢的病理状态,为DEHSI的早期诊断提供依据。
1 材料与方法
1.1临床资料
选取2013年1月至2014年6月宁夏医科大学总医院新生儿科的95名新生儿作为研究对象,其中包括40名适于胎龄早产儿和55名正常足月儿。所有新生儿均无神经功能障碍和窒息史;经临床、实验室及影像学相关检查,存在DEHSI并排除先天代谢性疾病、先天性畸形、颅内感染及其他脑损伤等疾病[3]。本研究经医院伦理委员会批准,检查前均取得受试者家属同意,并与之签订知情同意书。
1.2检查方法
采用GE SignaTwin Speed 1.5T MR扫描仪,在研究对象熟睡时扫描,不能入睡者给予5%水合氯醛50 mg/kg口服镇静。检查需在1名护士或医师陪同下进行,并注意患儿的保暖、听力保护及生命体征的观察。所有研究对象均接受常规MRI检查(扫描参数:T1 FLAIR:TR 1784 ms,TE 21.5 ms,矩阵 288×192;T2WI:TR 5400 ms,TE 111.1 ms,矩阵 320×224;T2FLAIR:TR 7800 ms,TE 146.5 ms,矩阵 320×224;所有序列层厚5 mm,层间距0.5 mm,FOV 24 cm×18 cm)。1H-MRS采用点分辨波谱(point resolved spectroscopy,PRESS)序列,自动预扫描完成匀场及水抑制,兴趣区置于右额叶白质(T2WI横轴面基底节水平),TR 1000 ms,TE 35 ms,矩阵16×8,FOV 11 cm×11 cm,半高带宽<10,自动匀场水抑制>98%,兴趣区大小:18 mm×18 mm×18 mm~20 mm×20 mm× 20 mm,扫描时间约3 min。以Cr作为内参照物,采用FunctoolⅡ对采集的MRS数据进行处理,分别测量N-乙酰天冬氨酸(NAA)、肌酸(Cr)、胆碱复合物(Cho)和肌醇(MI)代谢物的峰下面积,并计算不同物质之间(NAA/Cr、NAA/Cho、Cho/Cr和MI/Cr)的比值,扫描时避开周围颅骨,脂肪和脑脊液的影响。额叶每个兴趣区T2信号值分别测量3次取其平均值,兴趣区面积约30 mm2。
1.3磁共振成像分组
MR图像分别由2名高年资放射科医师独立阅片评价,2名医师独立阅片评分一致性评估采用Kappa检验,Kappa值=0.812,P<0.01 。根据影像学表现将DEHSI定性分组如下:正常:脑白质区无高信号;轻度:脑室前后角旁稍高信号;中度:脑室前后角旁无边界的弥漫性高信号;重度:所有白质区弥漫性高信号[4-5]。由于重度病例相对较少,将中重度合并为一组,结合文献[6]将DEHSI分为3组:无DEHSI,轻度DEHSI,中重度DEHSI;分别测量不同分组额叶T2信号值。
1.4统计学方法
采用SPSS 20.0软件包对所得数据进行统计分析,计量资料以±s表示,本组资料中DEHSI与临床指标、代谢物比值的相关性采用Spearman相关分析。对正常组与轻度、中重度DEHSI的代谢物比值采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1DEHSI的分组
对无DEHSI、轻度DEHSI、中重度DEHSI(图1)各组分别进行定量评估,其信号值分别为1274.53±266.80、1490.32±200.90和1531.18 ±262.42(表1)。95名受试者中正常无DEHSI者25名,轻度DEHSI 者31名,中重度DEHSI者39名。
2.2围产期临床特点与DEHSI的关系
95名受试者平均胎龄(37.4±2.6)周;MRI扫描时平均生后年龄(13.15±7.47) d;平均体重(2866.8±675.2) g;平均头围(33.2±2.6) cm(表1)。胎龄、体重和头围两两之间呈正相关(胎龄与体重,胎龄与头围,体重与头围:r值分别为0.690、0.659、0.844,P均<0.05)。生后年龄、胎龄、头围均与DEHSI程度呈负相关(r值分别为-0.398、-0.390、-0.269,P均<0.05)。DEHSI程度与T2信号值之间呈正相关(r=0.379,P<0.05)。生后年龄与T2信号值呈负相关(r=-0.284,P<0.05)(表2)。
表1 不同信号组间的一般情况(± s)Tab. 1 Each grade of DEHSI in Infant ofThe characteristics (± s)
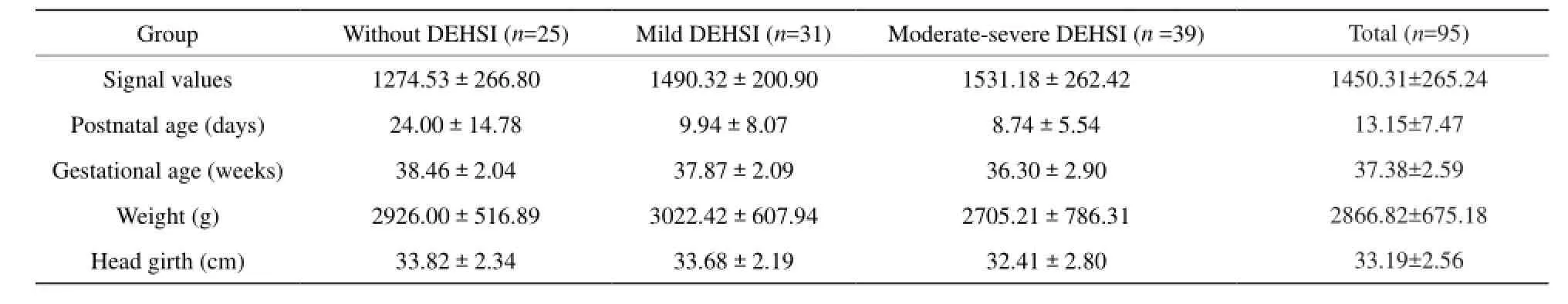
表1 不同信号组间的一般情况(± s)Tab. 1 Each grade of DEHSI in Infant ofThe characteristics (± s)
Group Without DEHSI (n=25)mild DEHSI (n=31)moderate-severe DEHSI (n =39) Total (n=95) Signal values 1274.53±266.80 1490.32±200.90 1531.18±262.42 1450.31±265.24 Postnatal age (days) 24.00±14.78 9.94±8.07 8.74±5.54 13.15±7.47 Gestational age (weeks) 38.46±2.04 37.87±2.09 36.30±2.90 37.38±2.59 Weight (g) 2926.00±516.89 3022.42±607.94 2705.21±786.31 2866.82±675.18 Head girth (cm) 33.82±2.34 33.68±2.19 32.41±2.80 33.19±2.56
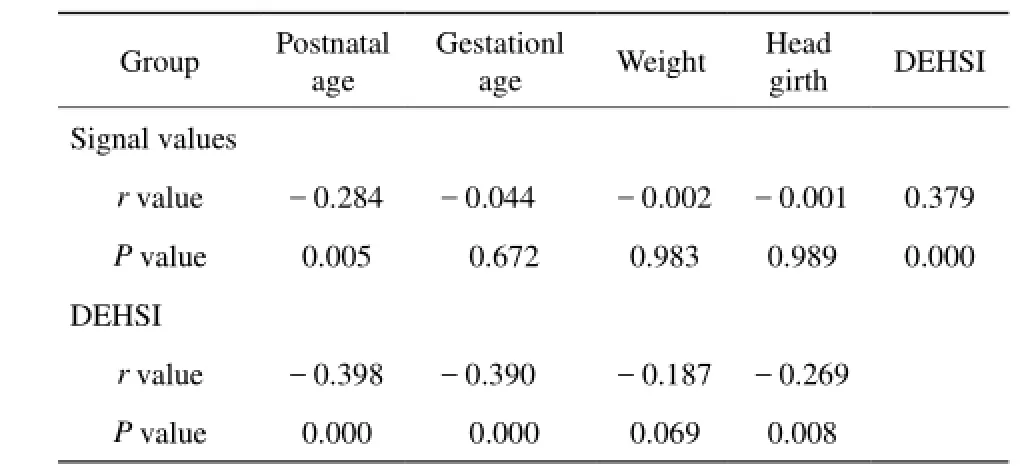
表2 患儿DEHSI与其临床特点的相关性Tab. 2 The correlation between DEHSI and clinical index
2.2围产期临床特点、DEHSI与MRS的关系
早产儿与足月儿脑内代谢物种类相似,1H-MRS均可观察到NAA峰、Cho峰及Cr峰 (图2)。右额叶代谢物相对浓度比值以±s表示(表3)。NAA浓度在围产期逐渐升高并与胎龄及生后天数呈正相关(r值分别为0.301、0.216,P值均<0.05)。胎龄、生后年龄与NAA/Cr (r值分别为0.386、0.328,P值均<0.05)及NAA/Cho (r值分别为0.432、0.367,P值均<0.05)呈正相关;与Cho/Cr(r值分别为-0.204、-0.211,P值均<0.05)及MI/Cr (r值分别为-0.243、-0.286,P值均<0.05)呈负相关(表4)。
表3 不同信号组间代谢物的一般情况(± s)Tab. 3 Infant characteristics in each grade of DEHSI (± s)
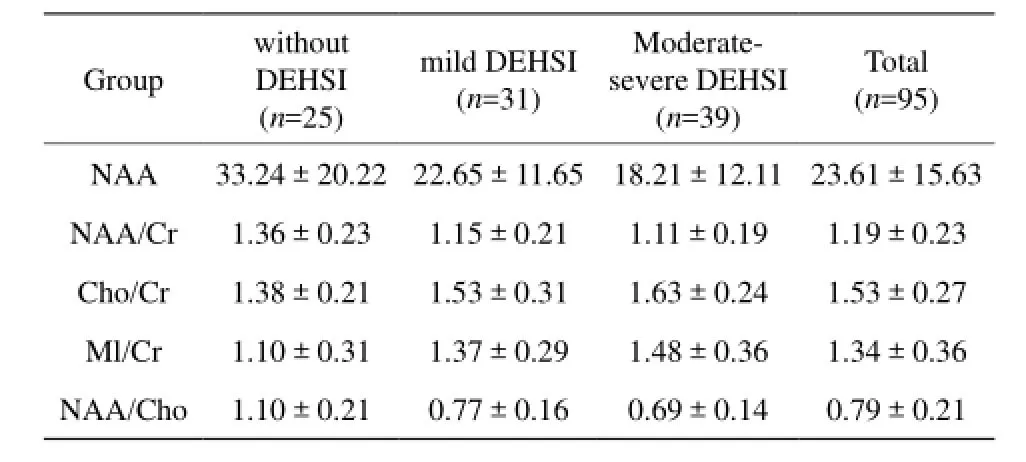
表3 不同信号组间代谢物的一般情况(± s)Tab. 3 Infant characteristics in each grade of DEHSI (± s)
Group without DEHSI (n=25) mild DEHSI (n=31) Moderatesevere DEHSI (n=39)Total (n=95) NAA 33.24±20.22 22.65±11.65 18.21±12.11 23.61±15.63 NAA/Cr 1.36±0.23 1.15±0.21 1.11±0.19 1.19±0.23 Cho/Cr 1.38±0.21 1.53±0.31 1.63±0.24 1.53±0.27 Ml/Cr 1.10±0.31 1.37±0.29 1.48±0.36 1.34±0.36 NAA/Cho 1.10±0.21 0.77±0.16 0.69±0.14 0.79±0.21
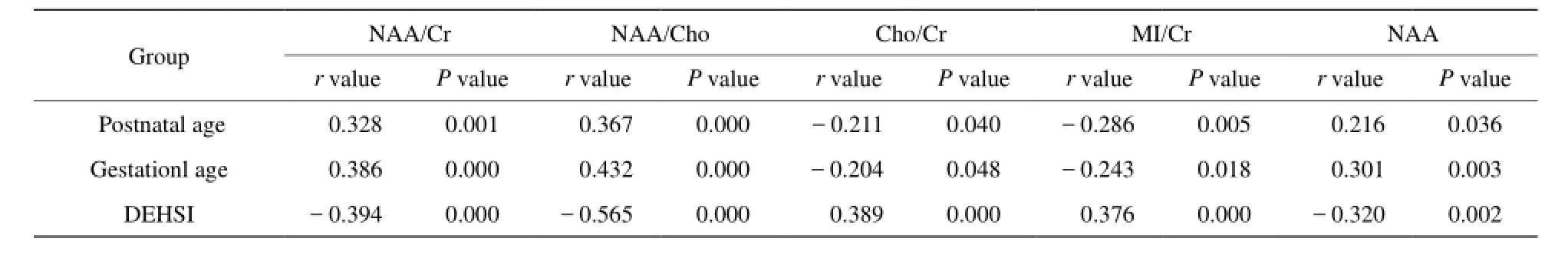
表4 胎龄、生后天数和DEHSI与各代谢物比值的相关性分析Tab. 4 The relationship between MRS ratios and GA、Postnatal age and DEHSI
随着新生儿脑白质DEHSI程度的增加,NAA浓度、NAA/Cr 和 NAA/Cho比值显著下降 (r值分别为-0.320、-0.394、-0.565,P值均<0.05),Cho/Cr和 MI/Cr比值上升(r值分别为0.389、0.376,P值均<0.05)(表4)。采用单因素方差分析分别对患儿正常组与轻度、中重度DEHSI的代谢物比值进行评估,正常组和轻度、正常组与中重度DEHSI的代谢物比值相比较,NAA/Cr、NAA/Cho、Cho/Cr和MI/Cr四项指标均具有统计学意义(P值均<0.05;表5)。
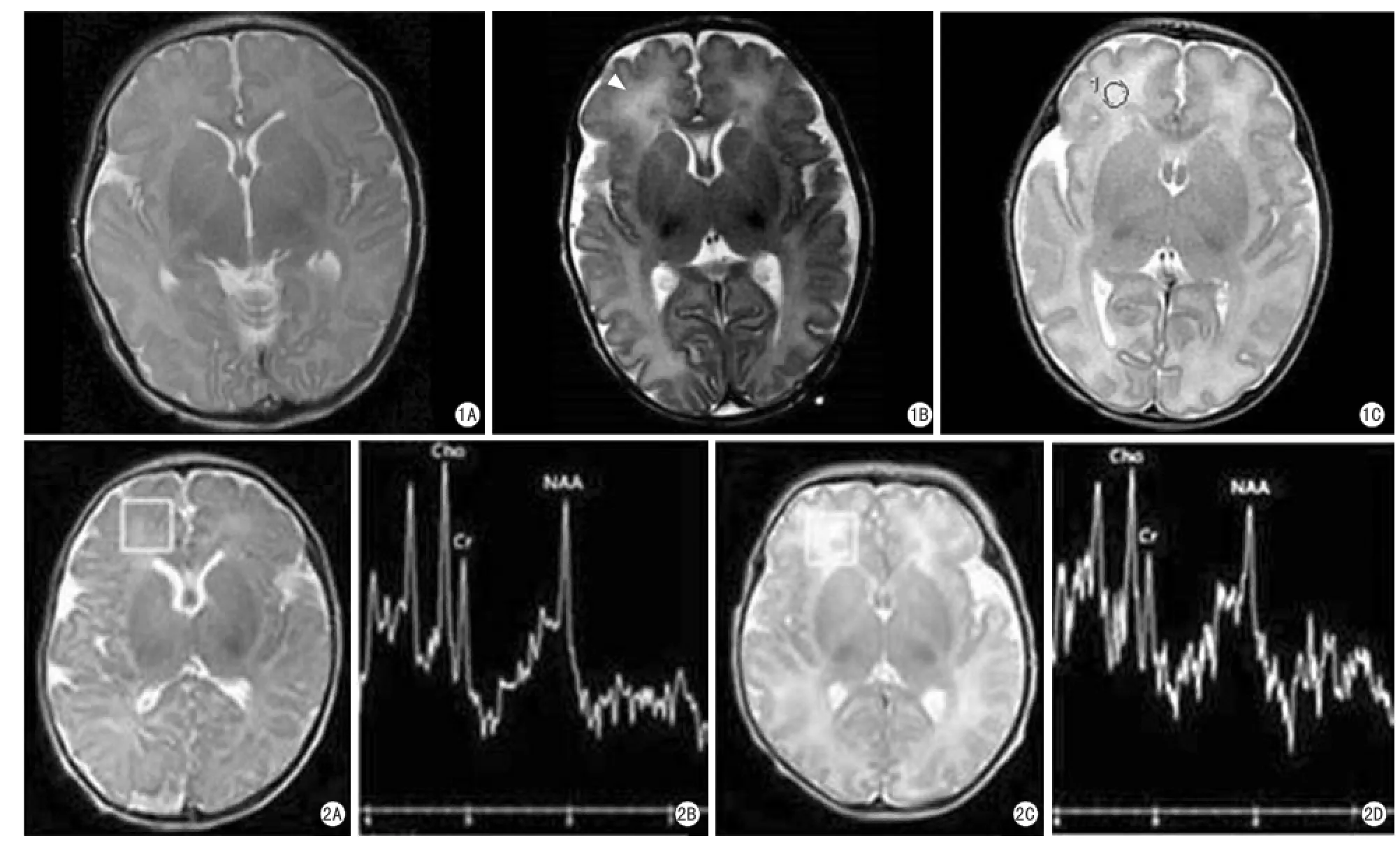
图1 T2WI上DEHSI分度图。A:男,7 d,36+5周,脑白质区无高信号;B:男,3 d,35+4周,脑室前后角旁稍高信号,可见边界(箭头);C:男,7 d,35+2周,所示白质区均呈弥漫性高信号,脑室前后角旁无边界。右额叶ROI面积均为(30±1) mm2图2 A,B:正常足月儿右额叶波谱图,男,年龄5 d,胎龄37+5周,NAA/Cr=1.07。C,D:早产儿DEHSI右额叶波谱图,男,年龄4 d,胎龄36+5周,NAA/Cr=1.03Fig. 1 Samples of different grades of DEHSI are viewed onT2WI. A: Male, 7 days, 36+5weeks, no DEHSIThroughoutThe white matter. B: Male, 3 days, 35+4weeks, high signal intensity is visible only withinThe crossroads (arrow). C: Male, 7 days, 35+2weeks, widespread high signal intensity is visible inThe entire cerebral white matter.The ROI ofThe signal value is measured inThe right frontal area,The area is about (30±1) mm2. Fig. 2 A, B:The MRS inThe right frontal white matter of normalTerm infant, male, 5 days, 37+5weeks, NAA/Cr=1.07. C, D:The MRS inThe right frontal white matter of preterm with DEHSI, male, 4 days, 36+5weeks, NAA/Cr=1.03.

表5 DEHSI 3组间代谢物比值的单因素方差分析Tab. 5 One-way ANOVA was performedThoughThree DEHSI groups’ ratios
3 讨论
胎儿在母体处于动态发育过程,胎儿的体重、头围等呈上升曲线,目前衡量新生儿生长发育的标志很多,如体重、头围等。本组数据证实,随着胎龄的增加,体重与头围呈增长趋势。此外,胎儿出生以后宫外环境暴露时间增加是DEHSI程度减低的相关因素,从而促进婴儿成熟度增高[7]。DEHSI可见于胎儿和新生儿时期,随后消失,因此在婴儿脑发育过程中呈动态变化[8]。
NAA 位于2.02 ppm,存在于少突胶质前体细胞,是轴突病变标记物。Cho 位于3.20 ppm,是新生儿脑组织MRS最高峰,随着脑发育髓鞘化其浓度降低。Cr 位于3.02 ppm,是神经胞质内的高能磷酸储备,Cr总量在脑内不同代谢条件下相对比较稳定,因此在本研究作为内标准。MI位于3.56 ppm,代表脑成熟,是直接参与神经信号系统的一个重要指标。本研究结果表明在脑发育过程中NAA浓度逐渐上升而Cho与Ml浓度逐渐下降,与文献[6,9]研究结果一致。
NAA是在神经元/神经轴突线粒体合成,沿着轴突向下扩散,并为髓鞘脂质合成提供乙酰基,在成熟少突胶质细胞内降解,因此,NAA在细胞水平降解,组织损伤将导致轴突成熟延迟,此外,未成熟的少突胶质细胞也可合成NAA[10]。NAA是大脑发育过程中,脑成熟和髓鞘化的指标之一。在髓鞘化阶段,未成熟少突胶质细胞开始进入轴突,转化为少突胶质细胞祖细胞[11]。但是,未成熟少突胶质细胞可能不会成为髓鞘成熟生成细胞。少突胶质细胞的演变导致轴索大小、轴突细胞膜和胞内成分的变化,从而影响脑白质的细胞外间隙和含水量下降[12]。膜密度改变依赖于未成熟少突胶质细胞破坏,进而导致未成熟少突胶质细胞进入轴突故障。因此,延迟成熟或组织损伤时轴突和细胞外水分子的变化可能是T2WI信号变化的原因[10]。早产儿脑白质损伤主要表现为髓鞘化过程中50%~90%少突神经胶质和轴突及胶质细胞成分的枯竭[13]。文献报道,DEHSI可能代表少突胶质细胞和(或)轴突异常[14]。DEHSI中NAA的降低与未成熟少突胶质细胞损伤及其演变过程中进入轴突障碍有关[15]。本组脑白质DEHSI随程度的增加,NAA浓度、NAA/Cr 和 NAA/Cho比值显著下降,呈负相关也证实了这一结论。
近年来,随着新生儿监护水平不断提高及疾病诊治策略日益完善,新生儿死亡率已明显降低,但新生儿脑损伤致残仍普遍存在。DEHSI是国外医学界研究的热点,国内鲜有报道。Counsell 等[16]认为婴儿脑白质DEHSI是成熟延迟的表现,而非永久性白质损伤。未成熟少突胶质细胞在预产期前最后3个月极其脆弱[17],因此这一时期未成熟少突胶质细胞受损是最常见的早产儿脑损伤形式[18]。有学者认为DEHSI中NAA/Cr的降低与早产儿脑白质损伤有关,DEHSI可能提示认知发育不良[2]。Dyet等[19]通过119例早产儿磁共振成像研究证实DEHSI与神经发育不良有显著相关性,认为脑白质DEHSI可预测矫正年龄后18~36个月的轻度发育延迟,中重度DEHSI会有较差的认知发展。DEHSI的细胞学及解剖学基础尚存争议,因此DEHSI能否代表轻度脑白质损伤或成熟延迟有待进一步证实[10]。
本研究的局限性:(1)T2WI信号可能受到的磁场非均匀性影响,磁场不均匀性与DEHSI信号强度混淆。(2)单体素技术在脑组织覆盖范围及空间分辨率方面较局限。(3) DEHSI是指矫龄后的早产儿,本组部分病例尚未达到矫龄,可能会造成数据偏倚。 近些年MRS极大地拓展和丰富了磁共振成像在新生儿脑组织发育功能和脑损伤评价的应用价值。DEHSI逐渐受到了新生儿领域的关注,因此,准确地揭示DEHSI严重程度的形式和量化标准,识别潜在高危早产儿并行神经保护和早期干预治疗是预后的关键。
[
[1] Plaisier A, Govaert P, Lequin MH, et al. OptimalTiming of cerebral MRI in preterm infantsTo predict long-term neurodevelopmental outcome: a systematic review. AJNR Am J Neuroradiol, 2014, 35(5): 841-847.
[2] Kidokoro H, Anderson PJ, Doyle LW, et al. High signal intensity onT2-weighted MR imaging atTerm-equivalent age in preterm infants does not predict 2-year neurodevelopmental outcomes. AJNR Am J Neuroradiol, 2011, 32(11): 2005-2010.
[3] Liu LL, Bo RT, Yang WJ, et al. DiffusionTensor imaging study of normal neonatal brain maturation. Chin J Magn Reson Imaging, 2015, 6(4): 253-257.
刘岭岭, 孛茹婷, 杨文君, 等. 磁共振弥散张量成像技术在新生儿脑白质发育中的研究. 磁共振成像, 2015, 6(4): 253-257.
[4] Weinstein M, Bashat DB, Gross-Tsur V, et al. Isolated mild white matter signal changes in preterm infants: a regional approach for comparison of cranial ultrasound and MRI findings. J Perinatol, 2014, 34(6): 476-482.
[5] Bhakoo KK, Williams IT, Williams SR, et al. Proton nuclear magnetic resonance spectroscopy of primary cells derived from nervousTissue. J Neurochem, 1996, 66(3): 1254-1263.
[6] Jessica L, Wisnowsk I, Vincent J, et al. Magnetic resonance spectroscopy markers of axons and astrogliosis in relationTo specific features of white matter injury in preterm infants. Neuroradiology, 2014, 56(9): 771-779.
[7] Groppo M, Ricci D, Bassi L, et al. Development ofThe optic radiations and visual function after premature birth. Cortex, 2014, 56: 30-37.
[8]TaokaT, Aida N, OchiT, et al.Transient hyperintensity inThe subthalamic nucleus and globus pallidus of newborns onT1-weighted images. AJNR Am J Neuroradiol, 2011, 32(6): 1130-1137.
[9] Ye BB.The value of magnetic resonance imaging in children with nervous system.Nanjimg:The 14th National Conference on Radiology, 2007: 193-194.
叶滨宾. 磁共振成像在小儿神经系统中的应用价值. 南京: 第十四次全国放射学学术会议, 2007: 193-194.
[10] Hagmann CF, De Vita E, Bainbridge A, et al.T2 at MR imaging is an objective quantitative measure of cerebral white matter signal intensity abnormality in preterm infants atTerm-equivalent age 1. Radiology, 2009, 252(1): 209-217.
[11] Sizonenko SV, Camm EJ, Dayer A, et al. Glial responsesTo neonatal hypoxicischemic injury inThe rat cerebral cortex. Int J Dev Neurosci, 2008, 26(1): 37-45.
[12] Miller S, Vigneron D, Henry R, et al. Serial quantitative diffusion
tensorMRIofThe premature brain: development in newborns with andwithout injury. J Magn Reson Imaging, 2002, 16(6): 621-632.
[13] Back SA, Riddle A, McClure MM. Maturation-dependent vulnerability of perinatal white matter in premature birth. Stroke, 2007, 38(2 Suppl): 724-730.
[14] Skiöld B, Horsch S, Hallberg B, et al. White matter changes in extremely preterm infants, a population-based diffusionTensor imaging study. Acta Paediatr, 2010, 99(6): 842-849.
[15] Volpe JJ. Neurology ofThe newborn. 5th ed. Philadelphia: Saunders, 2008: 414-427.
[16] Counsell SJ, Shen Y, Boardman JP, et al. Axial and radial diffusivity in preterm infants who have diffuse white matter changes on magnetic resonance imaging atTerm-equivalent age. Pediatrics, 2006, 117(2): 376-386.
[17] Haynes RL, Folkerth RD, Keefe RJ, et al. Nitrosative and oxidative injuryTo premyelinating oligodendrocytes in periventricular leukomalacia. J Neuropathol Exp Neurol, 2003, 62(5): 441-450.
[18] Volpe JJ. Brain injury in premature infants: a complex amalgam of destructive and developmental disturbances. Lancet Neurol, 2009, 8(1): 110-124.
[19] Dyet LE, Kennea N, Counsell SJ, et al. Natural history of brain lesions in extremely preterm infants studied with serial magnetic resonance imaging from birth and neurodevelopmental assessment. Pediatrics, 2006, 118(8): 536-548.
Applications of1H-MRS and clinical relative factors in diagnosis of neonatal cerebral white matter diffuse excessive high signal intensity
BO Ru-ting1, Ji Guang-hai1, Zheng Yi1, LIU Ling-ling2, WU Yu-hua3, YANG Wen-jun4, CHEN Zhi-qiang2*
1Ningxia Medical University , Yinchuan 750004, China
2Department of Radiology, General Hospital of Ningxia Medical University, Yinchuan 750004, China
3Department of Neonatology, General Hospital of Ningxia Medical University, Yinchuan 750004, China
4Key Laboratory of Fertility Maintenance, Ministry of Education, Ningxia Medical University, Yinchuan 750004, China
*CorrespondenceTo: Chen ZQ, E-mail: zhiqiang_chen99@163.com
19 Aug 2015, Accepted 5 Oct 2015
Objective: Use proton magnetic resonance spectroscopy (1H-MRS)To observeThe imaging features in neonatal cerebral white matter diffuse excessive high signal (DEHSI) and exploreThe evolution of DEHSI and diagnostic value. Materials and Methods:This study included 95 neonates, using MRS forThe study ofThe region of interest in cerebral white matter lesions. Results: Postnatal age, gestational age, and head girth had significantly negative correlation with DEHSI (r=-0.398, r= -0.390, r=-0.269, all P<0.05). Gestational age and postnatal age withThe ratios of NAA/Cr (r=0.386, r=0.328, all P<0.05), and NAA/Cho (r=0.432, r=0.367, all P<0.05) were discovered with a clearly positive signifcant difference and a marked negatively correlated withThe values Cho/Cr (r=-0.204, r=-0.211, all P<0.05), and MI/Cr(r=-0.243, r=-0.286, all P<0.05). In addition,The increasing extent of DEHSI was associated with a signifcant decrease in NAA concentration, NAA/Cr in relationTo NAA/Cho (r=-0.320, r=-0.394, r=-0.565, all P<0.05), resulting in an increase in Cho/Cr and MI/Cr (r=0.389, r=0.376, all P<0.05). Compared with control group, Cho/Cr and MI/Cr were signifcantly elevated, whereas NAA/Cr and NAA/Cho ratios were signifcantly decreased in infants with mild DEHSI and moderate-sereve DEHSI (all P<0.05). Conclusions: Postnatal age, gestational age, and head girth had negative correlation with DEHSI. Gestational age and postnatal age were relatedTo metabolite levels in neonatal brain. In addition, when it stayed in intrauterine forThe longTime, and it hadThe higher maturity,The lower grade of DEHSI, which was resulting in elevating NAA concentrations.
Neonate; Brain; Diffuse excessive high signal intensity; Magnetic resonance spectroscopy
宁夏科技攻关项目资助(编号:W2015);银川市科技攻关资助项目(编号:W2015-4);宁夏医科大学重点项目(编号:XM2014)
作者单位:
1.宁夏医科大学,银川 750004
2.宁夏医科大学总医院放射科,银川750004
3.宁夏医科大学总医院新生儿科,银川 750004
4.宁夏医科大学生育力保持教育部重点实验室,银川 750004
陈志强,E-mail:zhiqiang_chen99 @163.com
R445.2;R742
A
10.3969/j.issn.1674-8034.2015.11.003
孛茹婷, 姬广海, 郑义, 等.1H-MRS和临床相关因素在新生儿脑白质弥漫性高信号诊断中的应用价值. 磁共振成像, 2015, 6(11): 812-817.
ACKNOWLEDGMENTSThis work was part ofThe Program of Science andTechnology Foundation of Ningxia (No. W2015).The work was supported by Yinchuan Science andTechnology Key Projects Fund (No. W2015-4).The work was supported by Key Project of Ningxia Medical University (No. XM2014).
