TEE指导下心律植入装置感染相关电极导线拔除术的单中心回顾性分析
2015-09-26李学斌姜陆洋
海 艇,姜 燕,鞠 辉,冯 艺,李学斌,姜陆洋*
(北京大学人民医院1.麻醉科;2.心脏中心电生理室,北京100044)
近十年,随着永久性起搏器(Permanent pacemaker,PPM)、植入式心律转复除颤器(Implantable cardiac defibrillator,ICD)和心脏再同步治疗(Cardiac resynchronization therapy,CRT)等心律植入性装置(Cardiovascular Implantable Electronic De-vice,CIED)的广泛应用,植入装置感染(Cardiac Device Infection,CDI)的发生率明显升高,严重危及到患者生命安全。拔除感染的心内电极导线,清除和更换囊袋,放置临时起搏器,控制感染后CIED再植入是此类疾病的最终治疗方法[1]。
目前,最常用手术方式为经静脉拔除感染导线,即术者采用经静脉途径切削分离导线心腔固定端及附近组织,用抓捕器捕捉导线并拔除之。对于感染性心内膜炎病程较短、导线附着的赘生物直径较小、导线植入病史短、未形成心腔内严重粘连的患者可以在严密监测和局部麻醉下进行手术。对于一些复杂的特殊患者,如:CIED植入年限较长、感染较重、造成导线与心腔解剖关系复杂的患者;植入双线圈的ICD导线或粗大带螺旋固定装置的CRT导线的患者;合并心包积液甚至心脏穿孔的患者,这类患者在拔除术中随时可能出现致命的并发症,例如:心脏破裂、心包压塞、赘生物脱落引发肺栓塞及三尖瓣机械性损伤导致严重反流等,因此符合上述情况的患者实施导线拔除术需要进行全身麻醉。目前采用主要术式为(1)经静脉途径导线拔除术(心外科医生在场及备体外循环);(2)开胸体外循环直视下拔除术;(3)内外科联合上台备体外循环小切口开胸的杂交手术。无论采用何种术式,均存在相当多的不可控因素,这对麻醉医生的术中监测、管理及出现并发症时的处理能力是一项重大考验[2,3]。
在我国,开展CIED感染导线拔除手术的医院并不多。本文通过回顾北京大学人民医院近两年来的全麻下CIED感染导线拔除手术,总结CIED感染导线拔除术中急性并发症情况及术中监测要点,总结经食道超声心动(Transesophageal echocardiography,TEE)在术中的应用经验,探讨TEE在导线拔除术中监测中的作用。
1 对象和方法
1.1 研究对象 北京大学人民医院心脏中心于2012年6月至2014年9月期间共对56例患者进行全麻下CIED感染导线取出术。根据患者情况选择经静脉途径、心脏杂交手术或者CPB辅助开胸心脏直视下拔除感染导线。
所有患者术前、术后均行经胸超声心动图(Transthoracic Echocardiography,TTE)检查,术前TTE可以明确心脏功能、瓣膜功能、导线位置、导线上是否附着赘生物及大小等,术后床旁TTE检查患者术后心功能以及除外急性心脏并发症。
入选的患者均存在高危因素而无法在局麻下完成导线拔除手术,必须在全身麻醉下完成,指征至少符合下列任何一项[4]:①CIED导线植入年限≥10年;②导线附着赘生物直径≥2cm;③三尖瓣功能严重受损或心脏穿孔;④经静脉拔除失败或者局麻下拔出导线造成心包压塞;⑤植入导线为ICD或CRT导线。
1.2 研究方法 所有患者均采用全身麻醉方式,麻醉诱导采用静脉注射异丙酚/依托咪酯+爱可松+芬太尼。麻醉维持采用静脉持续泵入异丙酚和瑞芬太尼。所有患者均常规监测有创动脉压(IBP)、中心静脉压(CVP)、心率(HR)、血氧饱和度(SpO2)、呼末二氧化碳浓度(PETCO2)、体温及尿量。其中33例患者诱导后置入TEE探头进行术中实时辅助监测。
麻醉后由心外科和电生理医生决定采取何种术式拔除电极导线:经静脉拔除术指电极导线拔除在X线透视下进行,先经上腔静脉途径拔除,如阻力过大,换经下腔静脉途径拔除[5]。开胸体外循环下拔除技术是指外科医生在手术室,应用心外科技术,在开胸/胸腔镜及体外循环的基础上拔除整个植入系统[6]。杂交手术指结合心脏直视与X光透视下经静脉拔除心内电极导线。患者全麻后,先由外科医生选择合适切口,暴露出局部心脏,然后再由内科医生在X光透视下拔除心内电极导线,同时直视下检查心脏结构有无损伤,如有心脏结构损伤,则紧急建立体外循环进行修补[7]。
2 结果
2.1 患者一般资料 56例患者术前及术中资料(表1),所有患者麻醉诱导过程均平稳,其中33例患者置入TEE进行实时监测。共拔除导线148根,单例患者最多拔除5根导线。
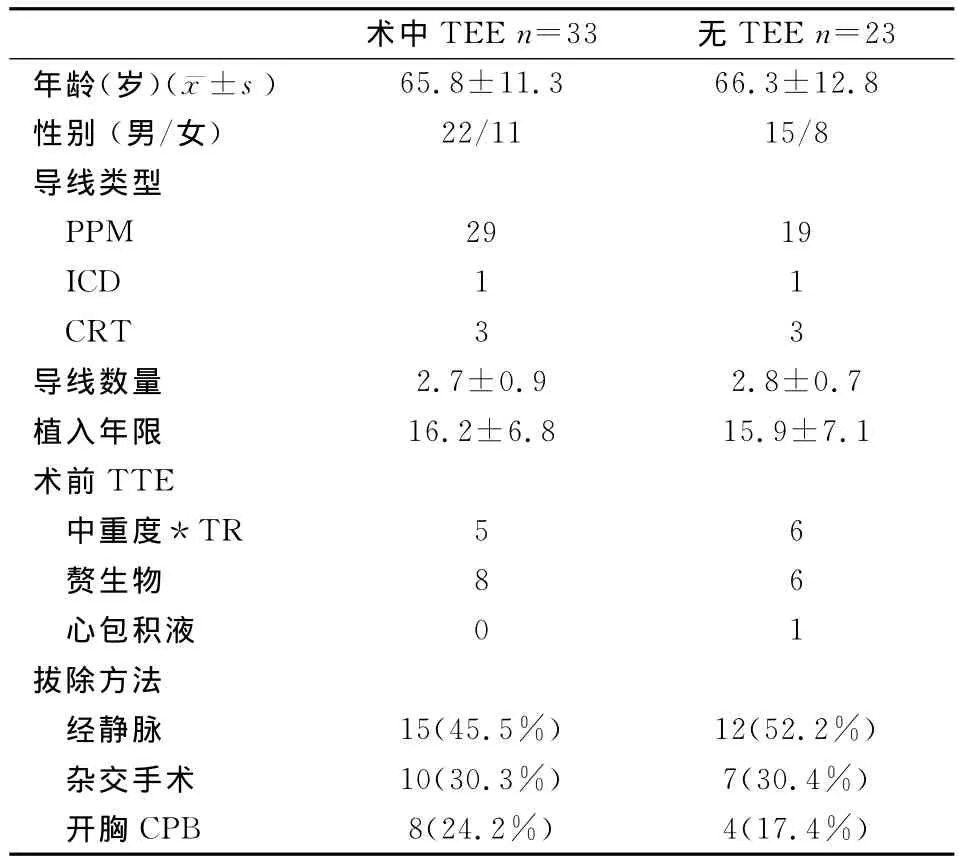
表1 病例资料
2.2 严重并发症及处理 严重并发症共出现7例,5例使用TEE进行监测(表2)。其中1例死亡,75岁女性,术前三尖瓣轻度反流,外科开胸下拔除导线,术后第1天行TTE发现三尖瓣前叶瓣索撕裂,前叶脱垂,三尖瓣大量反流,血流动力学不稳定,急诊行三尖瓣置换术,术后因急性肾功能衰竭死亡;1例心包压塞,71岁男性,拔除导线过程中造成右心耳破裂,心包压塞,紧急开胸行室壁修补,术后恢复良好;1例肺栓塞,为67岁女性,拔除导线后TEE发现赘生物脱落至右肺动脉开口处,同时心电图ST-T改变、心率快、动脉血压下降、PETCO2降低、SPO2降低,诊断为肺栓塞,紧急肺动脉切开取栓,患者术后恢复良好;4例三尖瓣损伤,其中1例为上述死亡病例,2例行三尖瓣成形术,1例术中TEE示中度三尖瓣反流,血流动力学稳定,决定观察;1例二次开胸,为术后大出血开胸止血。

表2 严重并发症及处理
2.3 术中TEE检查与术前TTE结果对比 有33例患者术中使用TEE进行连续-实时监测,对比术前TTE检查结果,发现13例(39.4%)患者共计13处术中TEE检查和术前TTE检查结果不一致(表3),主要是三尖瓣反流程度被低估,以及心内赘生物情况误判。
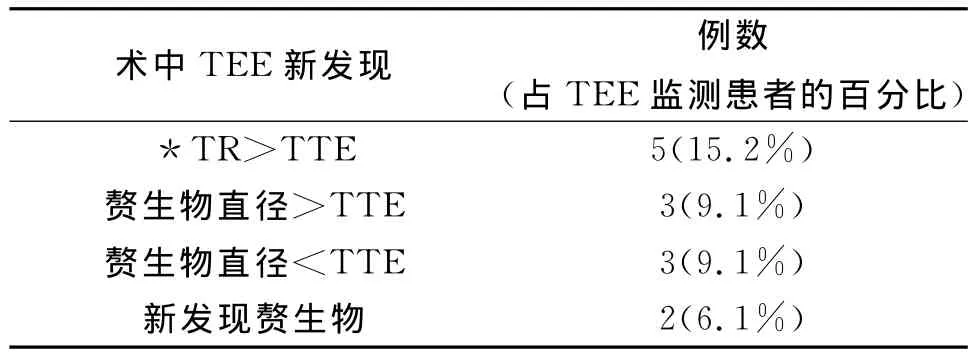
表3 术中TEE检查对比术前TTE结果新发现
3 讨论
近年来,CIED的新植入率和感染率严重不匹配,1990年-1999年期间美国CIED新植入率增加42%,但是感染率增加了124%。而在1996年-2003年期间,新植入率增加49%,感染率增加了310%,CIED感染使住院患者死亡风险增加2倍(OR=2.41,P<0.001)[8,9]。这些患者多为老年患者,常伴有心律失常,心功能差及其他系统并发症。CIED感染分为囊袋感染,血行感染和感染性心内膜炎三个阶段。一旦进展到感染性心内膜炎,病程往往迁延数年,造成患者免疫系统底下,瓣膜功能失调,血小板计数减少,贫血,直至心功能衰竭,死亡[10]。
随着手术技术的发展以及术者经验的提高,CIED感染导线的拔除成功率也明显上升。虽然绝大多数电极导线可以通过创伤较小的经静脉拔除术式成功拔除,但是术者及麻醉医生依然不能忽视其可能出现的严重并发症。拔除CIED感染导线的严重并发症主要包括心脏穿孔、心脏压塞、肺栓塞、三尖瓣损伤、深静脉血栓形成等,这些严重危及到患者生命安全[4,11]。
对于全麻下拔除电极导线的患者,充分的术前检查对于麻醉医生评估患者病情及预测术中可能存在的风险有着重要的意义。经胸超声心动检查简单易行,可做为心律植入装置感染的诊断与随访的基础检查,但检测的敏感度低,初筛检查的阳性结果诊断意义大,但是即使是阴性结果也不能排除电极导线附着赘生物的诊断。此外,经胸超声心动图检查还能确定患者有无心包积液、有无心肌收缩功能异常等,这些与患者临床症状和预后的判断休戚相关[12]。
此次回顾分析体现出CIED感染导线拔除手术的高危和不可预测性。56例患者中出现8例严重手术并发症(表2),基本关于该手术的严重并发症类型全部出现,其中死亡1例。如何及时发现急性并发症并快速明确原因是对麻醉医生的一个考验。术中TEE是一个很好的辅助工具,不仅可以指导手术操作,还能第一时间发现导致并发症的原因,为挽救患者生命抢得先机。如果发生了心包填塞,重度三尖瓣反流,肺栓塞等严重并发症,通过综合分析术中监测指标变化,比如血压迅速下降、CVP急剧增高,呼气末二氧化碳变化等也可以做出初步诊断,但是相对于使用TEE实时监测来说明显存在了滞后性,也没有那么直观明了。根据AHA(美国心脏协会,American Heart Association)于2013年颁布的经静脉途径心律置入装置导线拔除术的专家共识,经食道超声心动已经被列为当临床医师对导线或电极的位置或者毗邻的心脏解剖结构有疑问时,或者中度或高度怀疑感染性心内膜炎(如:葡萄球菌/真菌血症,人工心脏瓣膜,心脏植入装置)进行诊断时,必须进行的辅助检查项目之一[13]。TEE虽然是一种相对创伤较小的检查,但是它要求患者能够耐受探头在食道胃底内的操作,因此在病人在镇静或麻醉状态下进行,最好是气管插管全麻下进行能获得更准确的结果。根据美国Mayo医疗中心实施的心内植入装置感染的现行规范[14],任何血培养阳性的患者都要行TEE检查,因为TTE对感染性心内膜炎患者心内赘生物,瓣膜反流的诊断准确性远逊于TEE。
在杂交手术或开胸手术时,术野与检查区域重叠,TTE探头无法固定进行连续-实时监测,为了迅速发现并发症,指导电极拔除手术进行,TEE是必不可少的监测方式。由于TEE探头置于食管内,毗邻心脏,避免了肺内气体对图像的干扰,同时不受患者体位限制,所以TEE对CIED导线相关的感染性心内膜炎、体积较小的赘生物以及瓣膜反流有很高的敏感性,特别是术中可以实时监测评估赘生物的大小形状,是否拔除中脱落;是否出现三尖瓣损伤,是否出现心脏破裂、心包压塞等[13]。
Rodriguez等通过对比150例患者术前TTE和TEE检查结果发现,其中55例患者TEE检查发现有不同大小的赘生物,并在术中证实,但是术前TTE检查结果中只有14例诊断有赘生物,漏诊率达到74.5%[16]。我们的结果表明,33例术中 TEE患者有8例的心内赘生物情况与术前TTE监测结果严重不符合,由此可见TEE对赘生物的敏感性要远远高于TTE。1例患者在拔取电极术中赘生物脱落形成巨大栓子被血流冲入右肺动脉形成肺栓塞,在TEE中可清晰看到栓子的一部分位于右肺动脉开口处,紧急行肺动脉切开取栓最终挽救患者生命,说明TEE在术中动态监测赘生物情况的必要。
我们的患者有5例(15.2%)术中TEE发现三尖瓣反流程度与术前TTE报告不统一,并经过术者的确认。植入装置导致的三尖瓣反流与三尖瓣瓣叶闭合受限或瓣环扩张有关,多数在导线拔除后可自行恢复,但是因为瓣环扩张导致的反流常常无法恢复,需要手术矫正[15]。因此准确判断三尖瓣反流程度,反流原因,瓣叶活动情况和有无瓣环扩张对指导后续治疗非常重要。本次研究中TEE组发现了2例术中的严重三尖瓣损伤,迅速行三尖瓣成形术,明显改善患者预后,而未行TEE组一例死亡患者就与急性三尖瓣损伤导致大量反流,但是未及时发现和纠正有关。还有1例拔除中导线撕裂右心耳造成心脏穿孔心包压塞,TEE发现大量心包积液,快速做出诊断,床旁紧急开胸治疗挽救了患者生命。
总的来说,在导线拔除过程中使用TEE有三大优势:(1)对心内结构和瓣膜功能判断的敏感性高;(2)可以进行术中连续-实时监测;(3)快速发现严重术中并发症明确诊断便于迅速处理。因此,在导线拔除术中使用TEE具有很高的实用性及指导意义。
心律植入装置感染相关电极导线拔除术将会迎来一个高峰期,虽然电极导线拔除的术式和工具多样化,成功率及安全性也较高,但是随着患者老龄化,电极导线植入年限随之增长,拔除的困难度日益增加,相关的严重并发症种类也很多,一旦未经发现后果极其严重。这要求麻醉医生时刻不能放松警惕,术前要充分评估患者可能潜在的风险,术中密切观察术者操作步骤及患者生命体征变化,发现问题解决问题要及时果断。在CIED导线拔除术中,TEE是麻醉医生的得力助手,应作为此类手术的术中常规监测手段。
[1]Baddour LM,Epstein AE,Erickson CC,et al.Update on cardiovascular implantable electronic device infections and their management:a scientific statement from the American Heart Association[J].Circulation,2010,121(3):458.
[2]Farooqi FM,Talsania S,Hamid S,et al.Extraction of cardiac rhythm devices:indications,techniques and outcomes for the removal of pacemaker and defibrillator leads[J].Int J ClinPract,2010,64(8):1140.
[3]Kratz JM,Toole JM.Pacemaker and internal cardioverter defibrillator lead extraction:a safe and effective surgical approach[J].Ann ThoracSurg,2010,90(5):1411.
[4]心律植入装置感染与处理的中国专家共识2013[J].临床心电学杂志,2013,(04):241.
[5]陈 进,李学斌,王 龙,等.经静脉途径拔除起搏电极导线的影响因素[J].中国心脏起搏与心电生理杂志,2012,(06):489.
[6]刘 刚,陈生龙,汤楚中,等.开胸心脏直视手术治疗起搏装置相关感染性心内膜炎[J].中国心脏起搏与心电生理杂志,2011,(01):25.
[7]刘 刚,陈彧,凌云鹏,等.心脏杂交技术拔除并发症起搏导线的应用[J].中国心血管杂志,2013,(02):10.
[8]Cabell CH,Heidenreich PA,Chu VH,et al.Increasing rates of cardiac device infections among Medicare beneficiaries:1990-1999[J].Am Heart J,2004,147(4):582.
[9]Voigt A,Shalaby A,Saba S.Rising rates of cardiac rhythm management device infections in the United States:1996through 2003[J].J Am CollCardiol,2006,48(3):590.
[10]Bongiorni MG,Marinskis G,Lip GY,et al.How European centres diagnose,treat,and prevent CIED infections:results of an European Heart Rhythm Association survey[J].Europace,2012,14(11):1666.
[11]Kennergren C,Bjurman C,Wiklund R,et al.A singlecentre ex perience of over one thousand lead extractions[J].Europace,2009,11(5):612.
[12]Habib G,Badano L,Tribouilloy C,et al.Recommendations for the practice of echocardiography in infective endocarditis[J].Eur J Echocardiogr,2010,11(2):202.
[13]Hahn RT,Abraham T,Adams MS,et al.Guidelines for performing a comprehensive transesophageal echocardiographic examination:recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists[J].AnesthAnalg,2014,118(1):21.
[14]Sohail MR,Uslan DZ,Khan AH,et al.Management and out-come of permanent pacemaker and implantable cardioverter-defibrillator infections[J].J Am CollCardiol,2007,49(18):1851.
[15]Nazmul MN,Cha YM,Lin G,et al.Percutaneous pacemaker or implantable cardioverter-defibrillator lead removal in an attempt to improve symptomatic tricuspid regurgitation[J].Europace,2013,15(3):409.
[16]Rodriguez Y,Garisto J,Carrillo RG.Management of cardiac device-related infections:a review of protocol-driven care[J].Int J Cardiol,2013,166(1):55.
