脑出血患者血肿周围组织IL-17与NF-κBp65的表达及意义
2015-09-26王李鸣赵岩岩关雪莲侯丽淳田嘉莹王增冕李晓涛李培育
毕 胜,杨 丽,刘 群,范 佳,李 冬,王李鸣,赵岩岩,关雪莲,侯丽淳,田嘉莹,王增冕,李晓涛,李培育*
(1.佳木斯大学附属第一医院,黑龙江 佳木斯154002;2.大庆龙南医院,黑龙江 大庆163000;3.吉林大学白求恩第一医院,吉林 长春130021;4.吉林大学白求恩第二医院,吉林 长春130041)
脑出血是一种常见的神经系统疾病,严重影响人类健康。多种机制参与脑出血后的炎症反应及组织损伤。IL-17是一种重要的细胞因子,在自身免疫病等多种疾病中发挥重要作用。已有研究证实,IL-17A/NF-κB通路存在于多种细胞中,IL-17A 通过激活下游 NF-κB发挥生物学效应[1,2]。本研究拟通过检测脑出血血肿周围组织IL-17及NF-κBp65的表达,探讨IL-17/NF-κBp65通路在脑出血血肿周围组织炎性反应中的作用。
1 材料与方法
1.1 主要试剂
RT-PCR试剂盒,上海普迈生物科技有限公司;PCR引物,上海生工生物工程有限公司;核蛋白提取试剂盒,大连宝生物工程有限公司;
1.2 实验分组
选取2013年1月至2014年12月期间我院神经外科收治的脑出血患者,共48例。按发病距手术取材时间分为4组,分别为≤6h组、6-24h组、24-72h组和>72h组,每组12例标本。血肿旁1cm左右脑组织作为实验组,另选取手术入路中远离血肿的脑组织6例作为对照组。所有病例均符合脑出血的诊断标准[3]。
1.3 取材及实验方法
全部标本均以液氮冻存。RT-PCR法检测IL-17mRNA的表达;Western blot法检测 NF-κBp65核蛋白的表达;
1.4 统计学方法
采用SPSS13.0软件,所有数据以±s表示,组间比较用单因素方差分析(ANOVA),P<0.05为具有统计学差异。
2 结果
2.1 实验组及对照组IL-17mRNA的表达
≤6h组IL-17mRNA的表达与对照组相比无统计学差异(P>0.05),其他各实验组IL-17mRNA的表达与对照组相比有统计学差异(P<0.05)。24-72h组血肿周围组织IL-17mRNA 的表达显著高于其他各实验组(P<0.05),见表1。

表1 各组IL-17mRNA的表达
2.2 实验组及对照组脑组织NF-κBp65核蛋白的表达
各实验组血肿周围组织NF-κBp65核蛋白的水平与对照组相比均具有统计学差异(P<0.05)。24-72h组血肿周围组织 NF-κBp65核蛋白的水平显著高于其他各实验组(P<0.05),见表2。
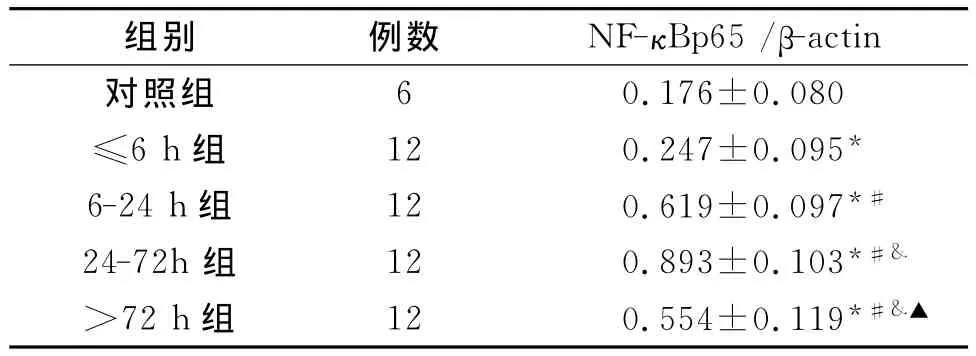
表2 各组脑组织NF-κBp65核蛋白的表达
3 讨论
已有研究证实,脑出血后多种机制参与其发病过程,炎症反应参与脑出血后的病理过程。在脑出血发病早期,中性粒细胞、单核细胞等多种细胞迁徙、渗出到血肿周围组织,分泌多种细胞因子等炎症介质,参与炎症反应及神经细胞凋亡。小胶质细胞等多种细胞能分泌多种细胞因子及补体参与血肿周围的炎症反应。粘附分子亦参与脑出血后的细胞聚集及炎症反应。
IL-17是一种重要的细胞因子,广泛参与多种炎症性疾病的发病过程。已有研究证实,IL-17与其受体结合后,通过 NF-κB、MAPK、JAKs/STATs这三种信号途径传导信号[4]。
NF-κB是一种多向性的转录调节因子,能够影响多种细胞的转录,诱导细胞因子、趋化因子、粘附分子、补体等多种因子的转录。当细胞受到细菌、病毒等病原微生物、活性氧族、细胞因子等多种刺激时,NF-κB能够被活化,多种刺激因素与 NF-κB之间能够形成复杂的正反馈环路,与多种疾病的发病有关。
本研究发现脑出血血肿周围组织IL-17、NF-κBp65的表达逐渐增加,提示脑出血血肿周围组织炎症反应的存在与IL-17、NF-κBp65密切相关。血肿周围组织NF-κBp65表达的动态变化与IL-17的表达具有时间上的高度一致性。提示脑出血后IL-17/NF-κB 通路被激活,IL-17A/NF-κB 通路还通过促进金属基质蛋白酶及水通道蛋白的表达,促进脑出血后脑水肿的发生[5-9]。NF-κB还可能诱导神经细胞的凋亡,促进组织损伤。本实验提示可以通过调控IL-17/NF-κB通路,减轻脑出血后的炎症反应,控制脑水肿,减轻细胞损伤,为脑出血治疗开辟了新的途径。
[1]Doreau A,Belot A,Bastid J,et al.Interleukin 17acts in synergy with B cell-activating factor to influence B cell biology and the pathophysiology of systemic lupus erythematosus[J].Nat Immunol,2009,10(7):778.
[2]Shalom-Barak T,Quach J,Lotz M.Interleukin-17-induced gene expression in articular chondrocytes is associated with activation of mitogenactivated protein kinases and NF-kappaB [J].J Biol Chem,1998,273(42):27467-27473.
[3]王新德.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29:379.
[4]孙创斌,胡晋红.药物作用新靶点:白细胞介素17及其受体[J].国际药学研究杂志,2008,35:169.
[5]Cheng G,Wei L,Xiurong W,et al.IL-17stimulates migration of carotid artery vascular smooth muscle cells in an MMP-9depend-ent manner via p38MAPK and ERK1/2-dependent NF-kappaB and AP-1activation[J].Cell Mol Neurobiol,2009,29(8):1161.
[6]Cortez DM,Feldman MD,Mummidi S,et al.IL-17stimulates MMP-1expression in primary human cardiac fibroblasts via p38 MAPK-and ERK1/2-dependent C/EBP-beta,NF-kappaB,and AP-1activation[J].Am J Physiol Heart Circ Physiol 293(6):H3356-3365.
[7]Rangaswami H,Bulbule A,kundu GC.Nuclear factor inducing kinase:A key regulator in osteopontin induced MAPK/IκB kinase dependent NF-κB-mediated promatrix metalloproteinase-9activation[J].Glycocon J,2006,23(3-4):221.
[8]Rosenberg GA,Navratil M.Metalloproteinase inhibition blocks edein intracerebral hemorrhage in the rat[J].Neurology,1997,48(4):921.
[9]Ito H,Yamamoto N,Arima H,et al.Interleukin-1βinduces the expression of aquaporin-4through a nuclear factor-κB pathway in rat astrocytes[J].J Neurochem,2006,99(1):107.
