罗布麻宁及其苷在植物界中的分布及药理活性研究进展△
2015-09-25黄珺谢国勇袁君陈雨洁秦民坚
黄珺,谢国勇,袁君,陈雨洁,秦民坚
(中国药科大学 中药资源学教研室,江苏 南京 210009)
·综述·
罗布麻宁及其苷在植物界中的分布及药理活性研究进展△
黄珺,谢国勇,袁君,陈雨洁,秦民坚*
(中国药科大学 中药资源学教研室,江苏 南京 210009)
现代生物医学研究表明,罗布麻宁为还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶抑制剂,其作为工具药广泛用于呼吸、神经、心血管等系统疾病的机理研究。为了开发富含罗布麻宁及其苷的天然药物资源,本文综述了罗布麻宁及其苷在植物界中的分布情况,并对其药理作用进行概述。现有研究资料表明,罗布麻宁及其苷广泛分布于植物界,迄今已在60余科上百种植物中发现,集中分布于鸢尾科、玄参科、夹竹桃科等植物类群中。以上综述可为新药资源开发提供线索,并为罗布麻宁治疗疾病的深入机理研究提供参考。
罗布麻宁;植物界分布;药理作用
罗布麻宁(apocynin)别名加拿大麻素、夹竹桃麻素、香荚兰乙酮、乙酰香草酮、胡黄连苷元、茶叶花宁、香草乙酮、乙酰愈创木酮,化学名为4-羟基-3-甲氧基苯乙酮,属于乙酰苯类小分子化合物,化学机构见图1。1883年,罗布麻宁首次由Schmiedeberg从加拿大麻Apocynumcannabinum的根中分离得到[1]。目前多个科属植物中发现含罗布麻宁,如玄参科、夹竹桃科、鸢尾科、唇形科等。罗布麻宁除游离态外,在自然界中还以糖苷等形式存在,如草夹竹桃苷(androsin)、草夹竹桃双糖苷(tectoruside)、罗布麻宁二聚体(diapocynin)[2]。

图1 罗布麻宁(apocynin)
罗布麻宁及其苷是中药胡黄连和西藏胡黄连的主要活性成分,在传统医药中主要用于治疗慢性炎症[3]。现代药理研究发现,罗布麻宁为还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)抑制剂,作用于呼吸、神经、心血管、免疫等系统,对哮喘、动脉粥样硬化、关节炎、糖尿病、高血压等疾病均有治疗作用[4],被广泛用于这些疾病机理研究的工具药。草夹竹桃苷的药理研究主要关注抗炎、平喘方面[5]。为进一步开发利用,本文对罗布麻宁及其苷在植物界中的分布进行综述,并对罗布麻宁的药理研究作出总结,以期为中药新资源的开发提供参考。
1 罗布麻宁及其苷在植物中的分布
1.1 罗布麻宁在植物界中的分布
随着植化分离及鉴定技术的发展,迄今已从越来越多的植物中发现罗布麻宁,见表1。由表可知,罗布麻宁在植物界的分布极为广泛,在60科115属150多种植物中均有发现,其中蕨类植物1科1属1种,裸子植物1科3属5种,单子叶植物10科21属34种,双子叶植物48科90属110多种。其在植物中的分布涵盖蕨类(蚌壳蕨科)、裸子(松科)、被子植物;木本、草本植物;陆生、水生植物(菱科、丝粉藻科、眼子菜科),暂未从低等植物中发现。罗布麻宁集中分布于单子叶植物的鸢尾科、禾本科及双子叶植物的唇形科、萝藦科、菊科、蔷薇科、茄科、夹竹桃科,包括传统中药材、粮食、蔬果、木料、香草各类植物。
罗布麻宁存在于植物多种器官及部位,如根、根茎、叶、花、果、虫瘿、树皮、愈伤组织、组织分泌物等。不同植物及组织中含量差别较大,多数植物中含量较低,含量较高的植物包括加拿大麻(2 g·kg-1根干重)、东北菱(挥发油乙酸乙酯部位81.41%)、白薇、催吐白前、喷瓜、川赤芍、印度胡黄连等。由于植物来源、提取、测定方法的不同,各文献中罗布麻宁的含量会有所差异,仅供参考。其他影响含量的因素包括产地、部位、病原入侵、采摘时间、加工方式等,例如:经过烘烤的栗木、樱桃木、橡木等罗布麻宁含量增高[6];葡萄酒制造过程中,罗布麻宁的含量随着后熟及酿造过程明显增加,可能是由于苷的转化[7];香草豆中罗布麻宁及其苷的含量在加工后比新鲜的更低[8];罗布麻宁及草夹竹桃苷在白云杉嫩枝中的含量较虫瘿中的高[9];地中海白松幼松松针中罗布麻宁的含量显著高于幼松根部及老松[10]。

表1 罗布麻宁在植物界中的分布

表1(续)

表1(续)

表1(续)
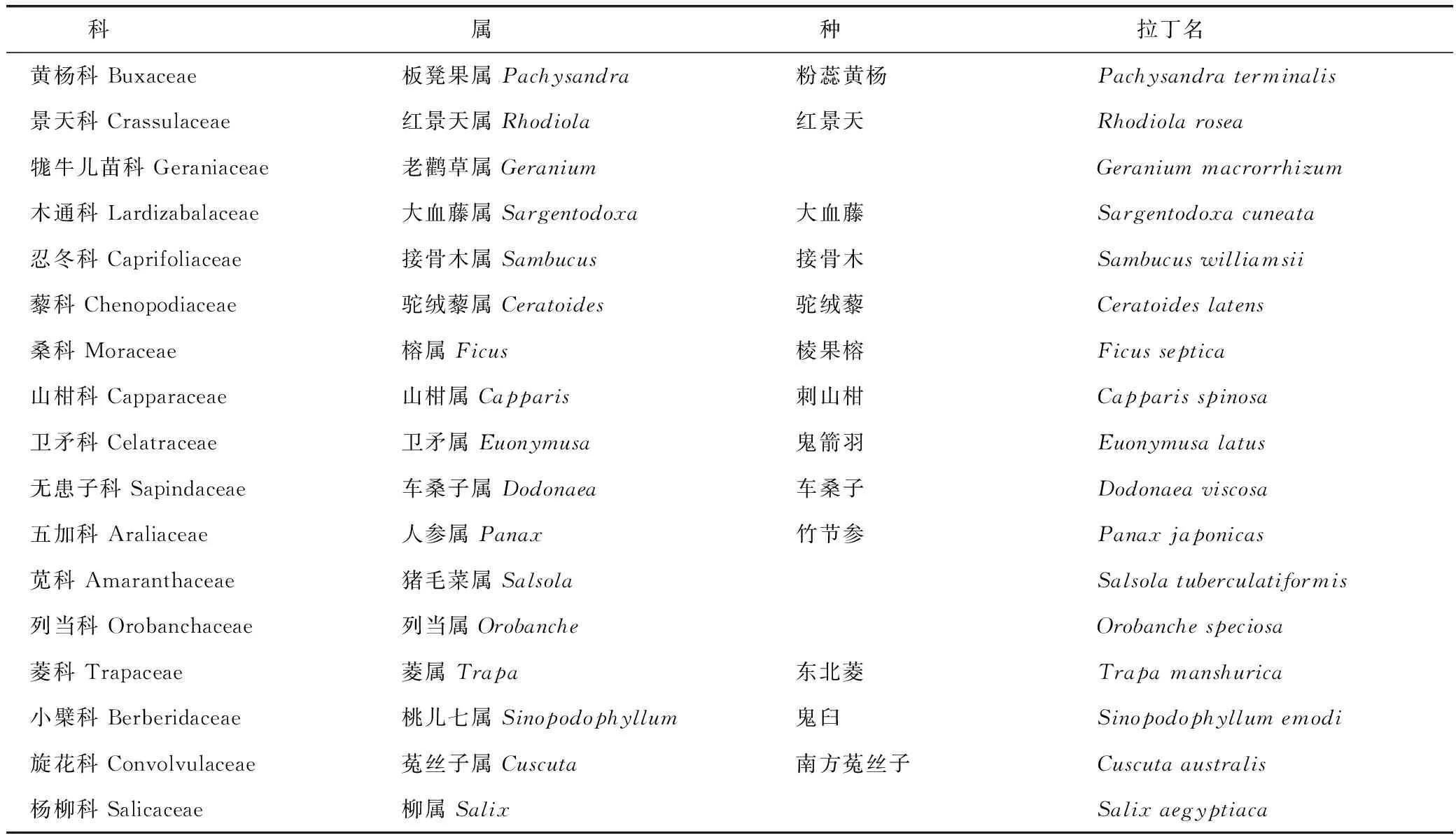
表1(续)
1.2 草夹竹桃苷及双糖苷在植物界中的分布
草夹竹桃苷及双糖苷共分布于14科22属36种植物中,其中蕨类植物1科1属2种,裸子植物1科1属1种,单子叶植物1科2属11种,双子叶植物11科18属22种,见表2。集中分布于鸢尾科和玄参科,仅射干、鸢尾和野鸢尾3种植物中同时含有罗布麻宁、草夹竹桃苷和草夹竹桃双糖苷。

表2 草夹竹桃苷及草夹竹桃双糖苷在植物界中的分布
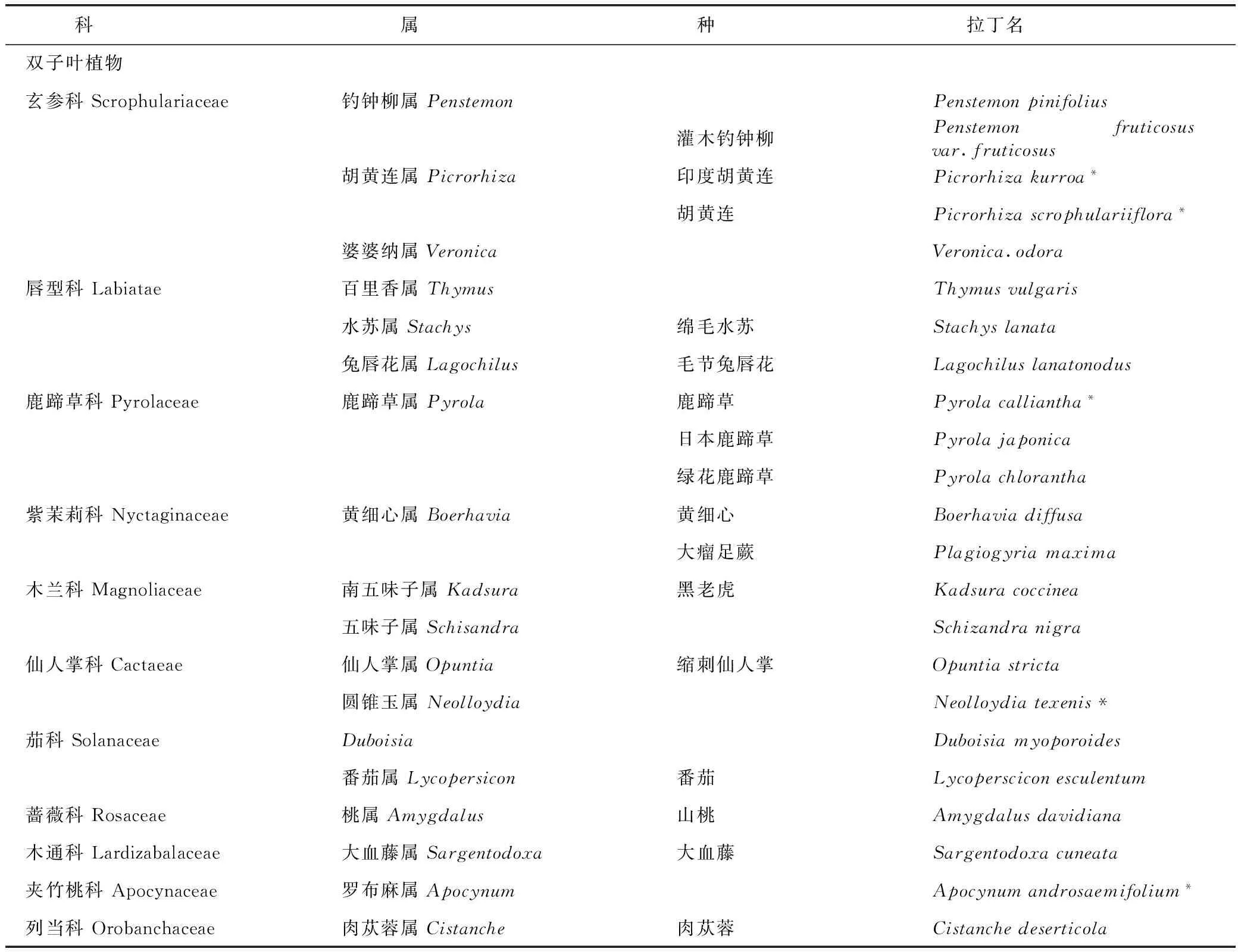
表2(续)
注:*为同时含有罗布麻宁及草夹竹桃苷;▲为同时含有罗布麻宁、草夹竹桃苷及双糖苷。
1.3 游离态和糖苷态罗布麻宁在植物界中的分布
许多研究关注了植物体内游离态和糖苷态物质的含量变化问题。游离态和糖苷态罗布麻宁的分布情况见表3。酶解或酸碱水解前的物质不能确定,可能为草夹竹桃苷、双糖苷或其他形式,因此暂未计入表2中的分布。由表3可以看出,游离和糖苷态罗布麻宁普遍存在于蔷薇科等蔬菜水果植物中,作为其中的芳香成分,但其含量较低。糖苷态比游离态的罗布麻宁分布更普遍,且含量更高。传统的植物化学和成分分析的研究中却发现游离态罗布麻宁比草夹竹桃苷、草夹竹桃二糖苷的分布更广,这可能是由于草夹竹桃苷、草夹竹桃二糖苷含量较低,受技术所限未能检出。

表3 游离态和糖苷态罗布麻宁在植物界中的分布
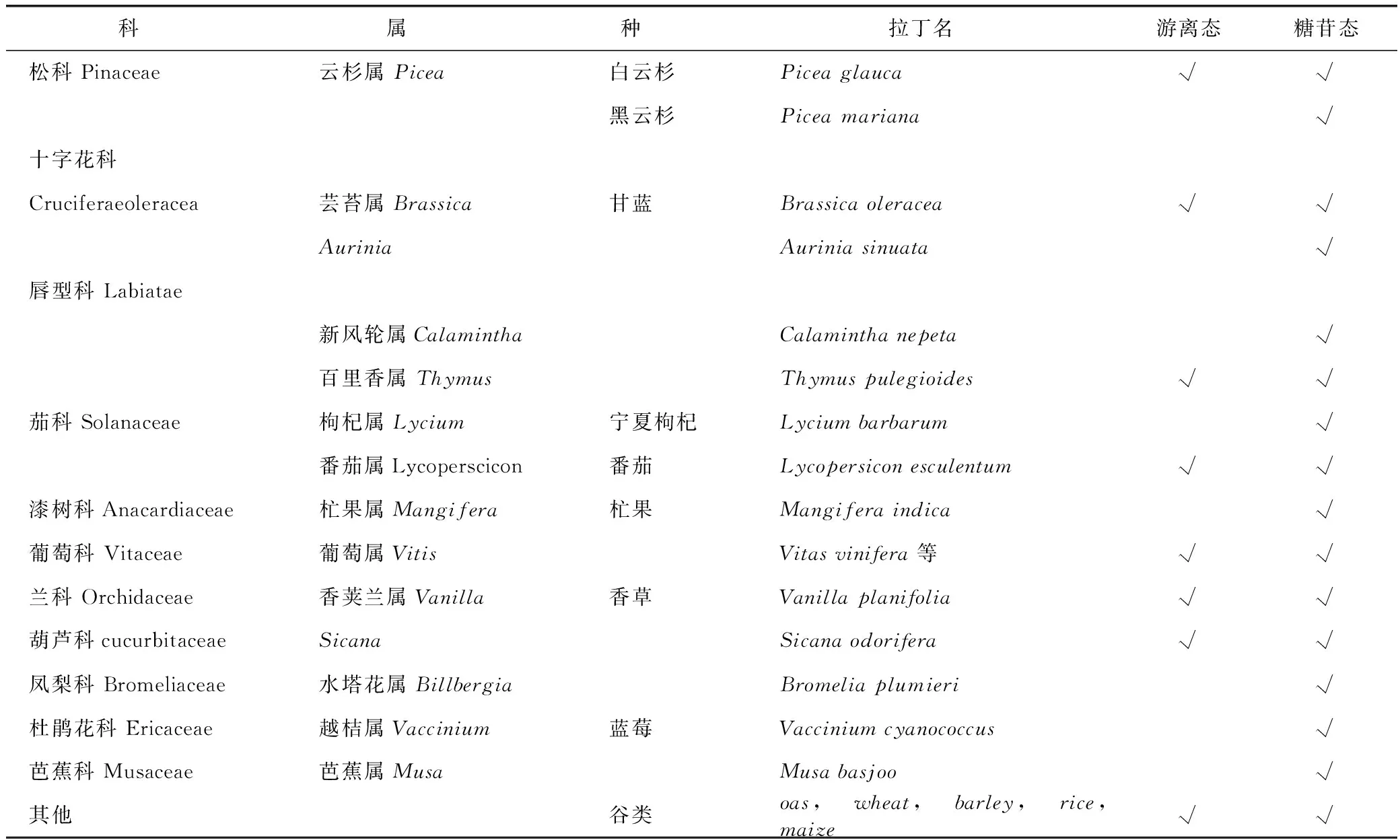
表3(续)
注:√表示含有游离态或糖苷态罗布麻宁。
2 罗布麻宁的药理研究
1990年,Simons等通过对印度胡黄连根的活性导向分离,证实了罗布麻宁能选择性抑制人类中性粒细胞(PMNs)中NADPH氧化酶(NOX)的活性及伴随产生的活性氧(ROS),在治疗由中性粒细胞介导的炎症中发挥重要作用[11]。迄今,罗布麻宁被广泛用作阻断NOX活性的工具药,用于各类炎症相关的药理研究。此外,罗布麻宁衍生物的合成、构效关系、药理活性及代谢也受到越来越多的关注[12]。以下对罗布麻宁在各系统疾病研究中的应用进行概述。
2.1 呼吸系统
Doddo等[13]报道,罗布麻宁能阻止羊肺局部缺血及再灌注引起的血管通透性增加,并呈现剂量依赖性。Chiang等[14]报道,罗布麻宁能降低大鼠的缺血再灌注肺损伤,减弱一系列炎症反应,降低肺通透性,对缺血再灌注肺损伤起到了保护作用。Peters等[15]发现,罗布麻宁能有效缓解臭氧引起的气道高反应,并排除了其消除臭氧的可能性,说明罗布麻宁或能预防臭氧诱发的哮喘。罗布麻宁对于呼吸系统疾病的作用机制可能通过对活性氧及活性氮过氧亚硝基的抑制,从而降低上皮损伤,抑制炎症介质释放及伴随产生的气道高反应[16]。
2.2 神经系统
罗布麻宁通过对NOX产生超氧化物这一过程的抑制,来减弱缺血性中风导致的大脑损伤[17]。Wang等[18]发现,罗布麻宁能保护沙鼠全脑缺血再灌注诱发的氧化胁迫及海马损伤。Lo[19]等研究显示,罗布麻宁能保护胶原酶诱导的颅内出血(ICH)大鼠模型,降低实验性中风模型中的大脑及血管损伤。罗布麻宁通过对先天性免疫的选择性抑制,减弱小神经胶质细胞的氧化反应,从而对多种神经退行性疾病起保护作用,包括肌萎缩性脊髓侧索硬化症(ALS)、阿尔茨海默病(AD)、帕金森病(PD)等,其可作为潜在的治疗药物[20]。
2.3 心血管系统
氧化胁迫与多种心血管疾病的产生和发展密切相关,罗布麻宁通过抑制心血管疾病中导致内皮功能紊乱的主要因素超氧阴离子的产生,及其与一氧化氮反应产生的更多活性氧,来维持血管内皮功能,预防动脉粥样硬化、高血压等疾病的发生。罗布麻宁显著降低了大鼠主动脉的超氧阴离子产生,长期给药更降低了主动脉收缩压[21]。体内外实验均说明,罗布麻宁能抑制高胆固醇血症小鼠的动脉粥样硬化进程[22]。此外,还能减缓受损心脏的肥大与纤维化,可能对心房颤动起效[23]。
2.4 其他作用
罗布麻宁口服给药具有类似于非甾体抗炎药的环氧酶(COX)活性抑制作用,可以部分缓解炎症所致软骨蛋白多糖合成的抑制作用,可能成为慢性炎症性关节疾病的潜在治疗药物[24]。动物实验证明,罗布麻宁能够降低关节炎发病率,减少胶原诱导性关节炎小鼠的关节肿胀,降低大鼠发炎皮肤的溃疡性皮肤损伤。
另有报道,罗布麻宁处理能逆转高草酸尿症导致的大鼠肾脏NOX系统过表达[25]。罗布麻宁通过减弱谷胱甘肽过氧化物酶的活性,能维持糖尿病肥胖大鼠肾脏的谷胱甘肽稳态[26]。此外,还具有保肝、利胆、收缩子宫等作用[27-28]。罗布麻宁的衍生物能抑制肿瘤细胞迁移[27]。
2.5 研究争议
动物实验显示,罗布麻宁低急毒、无长期毒性及遗传毒性,在治疗肺气肿的一期临床实验中无胃肠道反应和其他副作用,具有良好的选择性,作为潜在的抗炎药物有待深入挖掘[28]。近年来对于罗布麻宁的作用机制,学者们有着不同的看法。Vejrazka等[29]发现,罗布麻宁在吞噬细胞中以二聚体形式抑制NOX的作用,而在非吞噬细胞(如血管内皮或平滑肌细胞)中则不具有抑制NOX的作用,在体外试验中甚至有刺激活性氧生成的作用。Castor等[30]认为,高剂量的罗布麻宁可能具有促氧化作用,较窄的治疗剂量范围会使其使用受到限制。Wang等[31]认为,罗布麻宁在体内快速糖基化并运输到血液和其他组织,非体外研究显示的转化为二聚体。
3 结语
通过文献整理,笔者发现罗布麻宁在植物界中普遍存在,自1990年被证实为人类中性粒细胞NOX抑制剂后,引起了众多药理研究者的关注。作为工具药,罗布麻宁在NOX介导的各系统炎症反应机理的研究中发挥了重要作用。然而,越来越多的研究认为其具有除抑制NOX之外的活性,具体机制仍有待深入研究。探寻新的研究方向及模式,有助于人们更好地认识罗布麻宁这一小分子化合物的多方面意义及推动其在药用植物新资源开发中的应用。
[1] Schmiedeberg O.über die wirksamen bestandtheile der wurzel vonApocynumcanabinumL.[J].Arch Ex PPath Pharm,1883,16:161-164.
[2] 张志国,吕泰省,邱庆浩,等.川射干中非异黄酮类化学成分研究[J].中药材,2013,36(8):1281-1283.
[3] Meyer J W,Schmitt M E.A central role for the endothelial NADPH oxidase in atherosclerosis[J].FEBS letters,2000,472:1-4.
[4] Stefanska J,Pawliczak R.Apocynin:molecular aptitudes[J].Mediators of inflammation,2008,2008(1):99-108.
[5] Wagner H,Stuppner H,Dorsch W.Preparation of acetophenone glycosides as antiinflammatories and antiasthmatics:EP,501206 A2[P].1992-09-02.
[6] Fernández de Simón B,Sanz M,Cadahía E,et al.Nontargeted GC-MS approach for volatile profile of toasting in cherry,chestnut,false acacia,and ash wood[J].Journal of Mass Spectrometry,2014,49(5):353-370.
[7] Pereira V,Cacho J,Marques J C.Volatile profile of Madeira wines submitted to traditional accelerated ageing[J].Food chemistry,2014,162(6):122-134.
[8] Pérez Silva A,Gunata Z,Lepoutre J P,et al.New insight on the genesis and fate of odor-active compounds in vanilla beans(VanillaplanifoliaG.Jackson)during traditional curing[J].Food research international,2011,44(9):2930-2937.
[9] Kraus C,Spiteller G.Comparison of phenolic compounds from galls and shoots ofPiceaglauca[J].Phytochemistry,1997,44(1):59-67.
[10] Fernandez C,Lelong B,Vila B,et al.Potential allelopathic effect ofPinushalepensisin the secondary succession:an experimental approach[J].Chemoecology,2006,16(2):97-105.
[11] Simons J M.,Hart B A,I PVai Ching,et al.Metabolic activation of natural phenols into selective oxidative burst antagonists by activated human neutrophils[J].Free Radic Biol Med,1990,8(3):251-258.
[12] Lu X,Wan S,Jiang J,et al.Synthesis and biological evaluations of novel apocynin analogues[J].European journal of medicinal chemistry,2011,46(7):2691-2698.
[13] Doddo J M,Welsh L E,Salazar J D,et al.Effect of NADPH oxidase inhibition on cardiopulmonary bypass-induced lung injury[J].American Journal of Physiology-Heart and Circulatory Physiology,2004,287(2):H927-H936.
[14] Chiang C H,Chuang C H,Liu S L.Apocynin attenuates ischemia-reperfusion lung injury in an isolated and perfused rat lung model[J].Translational Research,2011,158(1):17-29.
[15] Peters E A,Hiltermann J T N,Stolk J.Effect of apocynin on ozone-induced airway hyperresponsiveness to methacholine in asthmatics[J].Free Radical Biology and Medicine,2001,31(11):1442-1447.
[16] Muijsers R B R,van Den Worm E,Folkerts G,et al.Apocynin inhibits peroxynitrite formation by murine macrophages[J].British journal of pharmacology,2000,130(4):932-936.
[17] Tang L L,Ye K,Yang X F,et al.Apocynin attenuates cerebral infarction after transient focal ischaemia in rats[J].Journal of international medical research,2007,35(4):517-522.
[18] Wang Q,Tompkins K D,Simonyi A,et al.Apocynin protects against global cerebral ischemia-reperfusion-induced oxidative stress and injury in the gerbil hippocampus[J].Brain research,2006,1090(1):182-189.
[19] Lo W,Bravo T,Jadhav V,et al.NADPH oxidase inhibition improves neurological outcomes in surgically-induced brain injury[J].Neuroscience letters,2007,414(3):228-232.
[20] Hart B A,Copray S,Philippens I.Apocynin,a Low Molecular Oral Treatment for Neurodegenerative Disease[J].BioMed research international,2014,2014(7):871-882.
[21] Beswick R A,Dorrance A M,Leite R,et al.NADH/NADPH oxidase and enhanced superoxide production in the mineralocorticoid hypertensive rat[J].Hypertension,2001,38(5):1107-1111.
[22] Kinkade K,Streeter J,Miller F J.Inhibition of NADPH oxidase by apocynin attenuates progression of atherosclerosis[J].International journal of molecular sciences,2013,14(8):17017-17028.
[23] Sovari A A,Morita N,Karagueuzian H S.Apocynin:a potent NADPH oxidase inhibitor for the management of atrial fibrillation[J].Redox Report,2008,13(6):242-245.
[24] Hougee S,Hartog A,Sanders A,et al.Oral administration of the NADPH-oxidase inhibitor apocynin partially restores diminished cartilage proteoglycan synthesis and reduces inflammation in mice[J].European journal of pharmacology,2006,531(1):264-269.
[25] Joshi S,Saylor B T,Wang W,et al.Apocynin-treatment reverses hyperoxaluria induced changes in NADPH oxidase system expression in rat kidneys:a transcriptional study[J].PloS one,2012,7(10):e47738.
[26] Winiarska K,Focht D,Sierakowski B,et al.NADPH oxidase inhibitor,apocynin,improves renal glutathione status in Zucker diabetic fatty rats:A comparison with melatonin[J].Chemico-biological interactions,2014,218(2):12-19.
[27] Klees R F,De Marco P C,Salasznyk R M,et al.Apocynin derivatives interrupt intracellular signaling resulting in decreased migration in breast cancer cells[J].BioMed Research International,2006,2006(1):1-10.
[28] van den Worm E.Investigations on apocynin,a potent NADPH oxidase inhibitor[M].Universiteit Utrecht:Faculteit Farmacie,2001.
[29] Vejražka M,Míĉek R,típek S.Apocynin inhibits NADPH oxidase in phagocytes but stimulates ROS production in non-phagocytic cells[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2005,1722(2):143-147.
[30] Castor L R G,Ximenes V F.Pro-oxidant activity of apocynin radical[J].Free Radical Bio Med,2010,48(12):1636-1643.
[31] Wang Q,Smith R E,Luchtefeld R,et al.Bioavailability of apocynin through its conversion to glycoconjugate but not to diapocynin[J].Phytomedicine,2008,15(6):496-503.
DistributionofApocyninandItsGlycosidesinPlantKingdomandItsPharmacologicalResearchProgress
HUANGJun,XIEGuoyong,YUANJun,CHENYujie,QINMinjian*
(DepartmentofResourcesScienceofTraditionalChineseMedicines,ChinaPharmaceuticalUniversity,Nanjing210009,China)
Modern biomedical researchindicates that apocynin is an inhibitor of NADPH oxidase,which has been widely used for mechanism research of respiratory,nervous and cardiovascular diseases as a tool drug.To develop apocynin and its glycosides enriched natural resources,their distributionand pharmacological researches are overviewed.The data show that apocynin and its glycosides arewidespread in plant kingdom,which have been found in over 60 families among hundreds of plants and mainly distributed in Iridaceae,Scrophulariaceae,Apocynaceae,etc.This paperprovides clues to new medicine resources development and further pharmacological research.
Apocynin;distribution in plant kingdom;pharmacology
10.13313/j.issn.1673-4890.2015.6.023
2014-11-17)
国家自然科学基金项目(81373918)
*
秦民坚,教授,博士生导师,研究方向:中药资源与种质评价;E-mail:minjianqin@163.com
