苦参不同部位有效成分含量比较研究
2015-09-25关扎根吴尚英郭宝林魏红国王玉龙杨霞
关扎根,吴尚英,郭宝林,魏红国,王玉龙,杨霞
(1.山西振东道地药材开发有限公司,山西 长治 047100;2.长治县农业委员会,山西 长治 047100;3.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
·基础研究·
苦参不同部位有效成分含量比较研究
关扎根1,吴尚英2,郭宝林3*,魏红国1,王玉龙1,杨霞1
(1.山西振东道地药材开发有限公司,山西 长治 047100;2.长治县农业委员会,山西 长治 047100;3.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
目的:比较苦参不同采收部位中的苦参总生物碱含量,为苦参栽培资源的合理利用提供依据。方法:采用高效液相色谱法分析不同年限苦参不同部位中苦参碱和氧化苦参碱的含量。结果:苦参碱和氧化苦参碱的总量在不同年限苦参不同部位的分布具有类似的规律性,侧根下部>侧根上部>主根>横生根状茎(地中茎)>茎芽。主根上部和下部的含量差异不显著,但主根与侧根下部的有效成分含量差异较大;苦参生长的第1年、第2年生物碱含量均有较大增长,3年生苦参含量均能达到《中华人民共和国药典》标准。结论:3年采收苦参较为合理,且3年生材料中地中茎和茎芽的生物碱含量也比较高,可以多途径利用。
苦参;不同采收部位;苦参总生物碱含量;高效液相色谱法
苦参SophoraflavescensAit.为豆科槐属植物,是我国传统药用植物,以根入药,始记载于《神农本草经》,具有清热燥湿、杀虫、利尿的功能[1-2]。在临床治疗疾病方面,苦参是处方饮片和成方制剂的重要组成原料,同时也用于生产日化用品、消毒剂、生物农药和兽药等。十多年来,山西振东道地药材开发有限公司在山西长治武乡、沁县、屯留等地实现了苦参的规模化栽培,并于2009年通过了GAP认证。种植田采挖的3年生苦参,去掉地上的枯萎茎秆,由主根、侧根、横生根状茎(地中茎)和次年将萌发的茎芽组成,可将不同的部位分开加工成不同等级的药材,但各自质量有待评价。有文献报道了苦参不同部位的生物碱含量[3],具有一定的参考意义,但对于苦参产地加工分级及相应的质量尚不能起到指导作用,本文将根据实际应用进行药材部位划分,并分别测定苦参碱和氧化苦参碱的含量,也将有助于苦参的合理利用,同时比较各部位不同种植年限的含量变化,探讨苦参根部各段的有效成分含量变化规律。
1 仪器与材料
1.1仪器
安捷伦1260HPLC色谱仪;CleanertAlumina-N-SPE固相萃取柱(Agela公司);SHANGPINGFA2104电子天平;KQ-250B型超声波清洗器(昆山市超声仪器有限公司)。
1.2材料
乙腈(色谱纯,美国Honeywell公司),无水乙醇(色谱纯,天津市四友有限公司),其他试剂为分析纯,水为娃哈哈纯净水。苦参碱对照品(批号:110805-200508)、氧化苦参碱对照品(批号:110780-201007)购自中国食品药品检定研究院。
苦参样品来自于山西振东道地药材开发有限公司苦参GAP基地种植的苦参。
2 方法与结果
2.1样品处理
2014年11月采挖1、2、3年生苦参根各20根,清洗干净,将其分为茎芽、地中茎、主根上部(距顶部10~12cm段)、主根下部(距顶部12~25cm段)、侧根上部(距与主根分支处4~7cm段)及侧根下部(距与主根分支处7~12cm段)6个部分,干燥,粉碎,备用。
2.2色谱条件
VenusilXBPNH2色谱柱(250mm×4.6mm,5μm),检测波长:220nm,流动相:乙腈-无水乙醇-3%磷酸溶液(80∶10∶10),流速:1.0mL·min-1,进样量:10μL[4]。
2.3对照品溶液的配制
精密称取苦参碱对照品25.0mg、氧化苦参碱对照品24.7mg,分别加乙腈-无水乙醇(80∶20)溶解定容到50mL量瓶中作为混合对照品溶液。
2.4供试品溶液的制备
取苦参药材粉末(过3号筛)约0.3g,精密称定,置具塞锥形瓶中,加浓氨试液0.5mL,精密加入三氯甲烷20mL,超声处理30min,放冷,摇匀,滤过。精密量取续滤液5mL,通过中性氧化铝柱SPE小柱(5g,容积6mL,内径1cm),依次以三氯甲烷、三氯甲烷-甲醇(7∶3)各5mL洗脱,收集洗脱液,回收溶剂至干,残渣加无水乙醇适量使溶解,并转移至10mL量瓶中,加无水乙醇稀释至刻度,摇匀,测定[5]。
2.5标准曲线制备
分别精密吸取苦参碱对照品溶液0.25、0.5、1.0、1.5、2.5mL及氧化苦参碱对照品溶液0.75、1.50、3.0、4.5、6、7.5mL定容到10mL容量瓶中作为供试液。吸取上述供试品溶液10μL,注入液相色谱仪,测定。以对照品溶液质量浓度为横坐标(X),峰面积积分值为纵坐标(Y),绘制标准曲线,得苦参碱回归方程为Y=4×106X+5400,r=0.9997,在0.125~1.102μg线性关系良好;氧化苦参碱回归方程为Y=5×106X-7838,r=0.9999,在0.370~3.713μg线性关系良好。
2.6精密度试验
精密吸取混合对照品溶液,连续进样6次,测定峰面积值。苦参碱和氧化苦参碱峰面积的RSD分别为2.6%和1.7%,表明仪器的精密度较好。
2.7稳定性试验
取3年生苦参主根上部药材供试品溶液,分别于0、1、2、3、5、6、7、10、12、24h精密吸取10μL注入液相色谱仪,测定峰面积值。结果苦参碱和氧化苦参碱的RSD值分别为3.9%、1.3%,表明供试品溶液稳定性良好。
2.8重复性试验
取3年生苦参主根上部样品粉末共6份,按供试品溶液制备方法制备,分别测定峰面积值,结果苦参碱和氧化苦参碱的RSD分别为2.6%、1.8%,表明本方法重复性良好。
2.9加样回收率试验
精密称定已测定含量的3年生苦参主根上部样品粉末0.15g,共6份,于每份样品中分别加入苦参碱对照品和氧化苦参碱对照品,按2.4制备供试品溶液,精密吸取供试品溶液20μL,注入液相色谱仪,测定。苦参碱和氧化苦参碱的平均加样回收率分别为99.8%、101.1%,RSD分别为4.0%、0.60%。
2.10含量测定
取不同生长年限苦参药材不同部位粉末,按供试品溶液制备方法制备,精密吸取10μL,注入液相色谱仪,按上述色谱条件测定不同部位苦参药材中苦参碱和氧化苦参碱的含量,结果见表1,对照品和样品的HPLC图见图1。
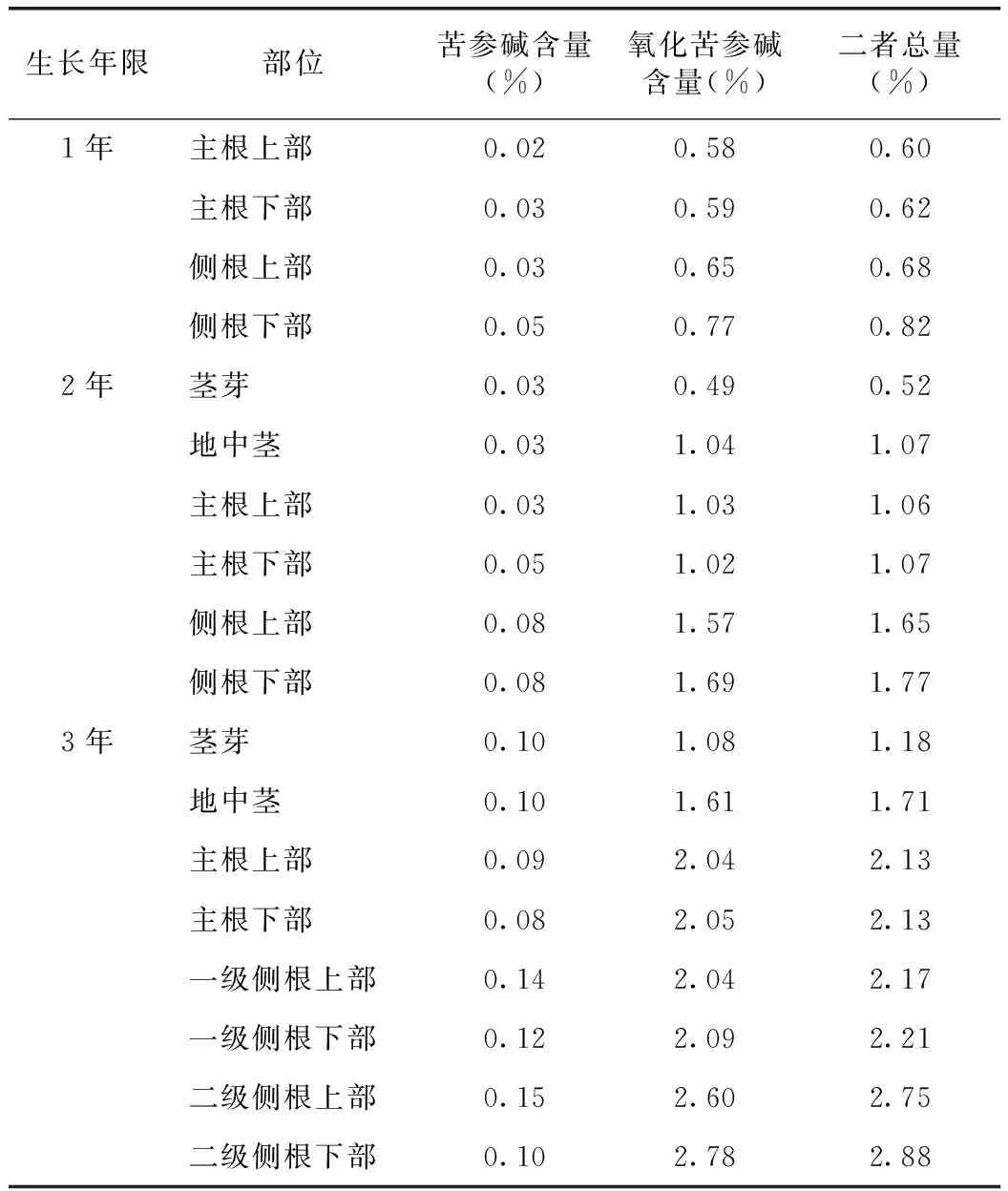
表1 不同生长年限苦参不同部位中苦参碱和氧化苦参碱含量测定(n=3)

注:A.苦参碱与氧化苦参碱混合对照品;B.样品;1.苦参碱;2.氧化苦参碱。图1 苦参样品及对照品HPLC图
3 结论
结果表明,对于总生物碱含量来说,苦参碱的含量贡献较小,主要来自于氧化苦参碱。3年生苦参不同部位的苦参碱和氧化苦参碱的总量大小依次为:二级侧根下部>二级侧根上部>一级侧根≈主根>地中茎>茎芽,表明以主根和一级侧根构成的苦参片含量比较稳定,而细分的侧根表现为含量更高,值得深度开发利用。地中茎和茎芽也有一定的生物碱含量,也可利用,建议和侧根分开等级。为了保证苦参饮片的品质均一性,实现苦参不同部位的最大价值,在苦参加工过程中,应将主根和一级侧根作为苦参片的主要原料,二级侧根作为一级下脚料,茎芽和地中茎作为二级下脚料,或者根据需求再细分,分级进行加工销售。导致主根和侧根中苦参生物碱含量的差异,文献报道称原因为从韧皮部到髓部生物碱的含量呈现逐渐递减的趋势[6],有待本研究组从组织化学的角度进行进一步研究。
1、2年生的苦参各部位的苦参碱和氧化苦参碱总含量规律类似。从1、2、3年生苦参主根的生物碱含量分析,各年度同部位之间生物碱累积呈现明显增多的趋势,见图2。3年生苦参的生物碱积累量比1年生增长约75%,3年生苦参的生物碱积累量比2年生增长约101%,说明苦参第3年的生物碱积累有较大的增长。按照《中华人民共和国药典》标准(1.2%),2年生苦参仅有侧根达标,因此不宜药用,而3年生苦参的各部位均达到或者基本达到标准,但为了保证药用部位符合标准,主根、各级侧根均可作为苦参药用,而地中茎和茎芽建议作为其
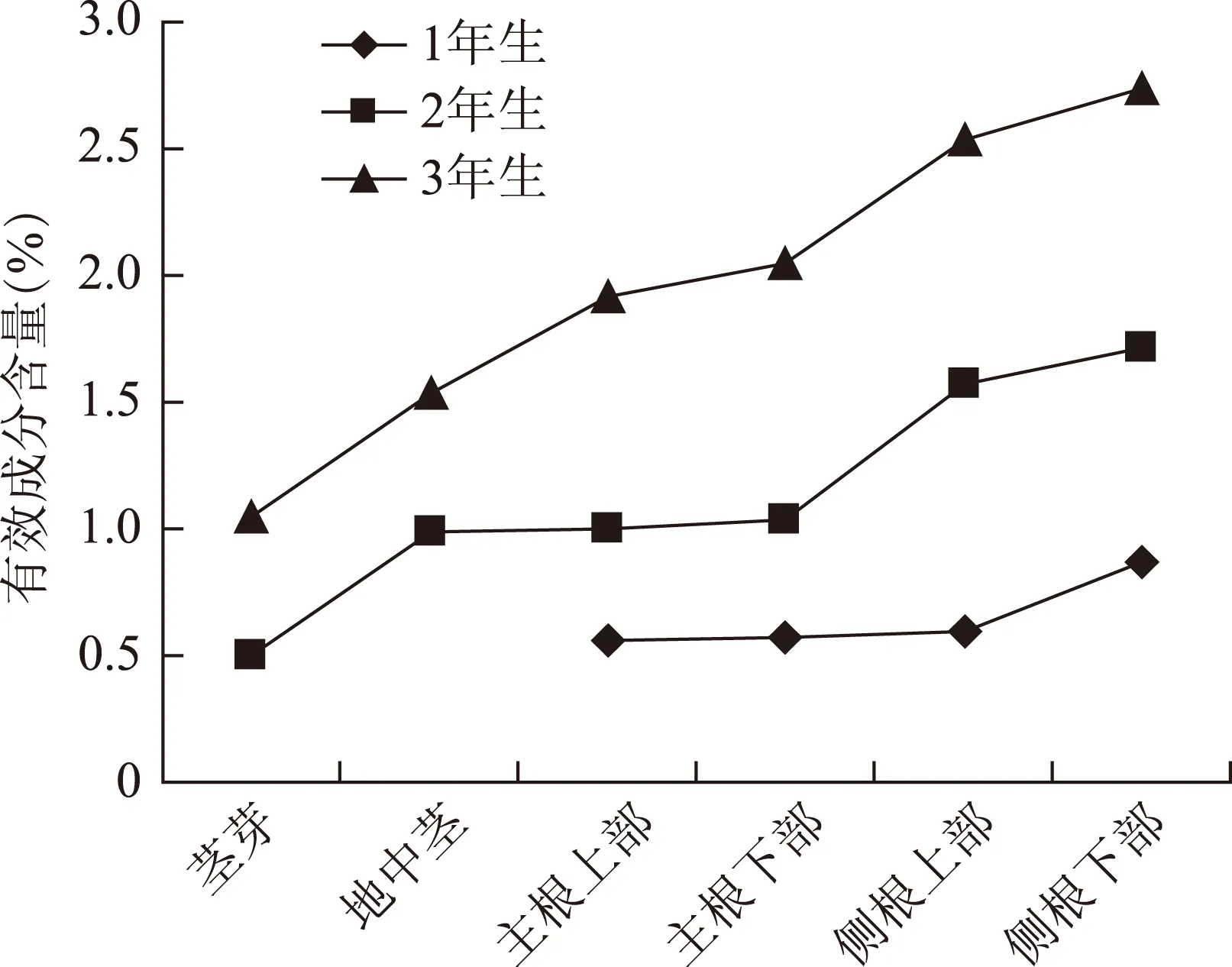
注:3年生侧根指二级侧根。图2 不同生长年限苦参不同部位的苦参碱和氧化苦参碱含量变化
他原料应用。有文献研究表明4年生苦参的生物碱含量主根部分反而较3年生苦参有所降低[3],因此从经济效益和有效成分含量来考虑,苦参的最佳采收年限为3年。
[1] 郭吉刚,关扎根.苦参生物学特性及栽培技术研究[J].山西中医学院学报,2005,6(2):45-47.
[2] 战渤玉,李东霞,高明.苦参的现代研究进展[J].中医药信息,2009,26(1):23-24.
[3] 陈静,王淑美,孟江等.不同生长年限苦参不同部位的生物碱含量[J].中国实验方剂学杂志,2013,19(7):80-84.
[4] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:188.
[5] 杨霞,郭宝林,胡红宇,等.氧化铝固相萃取小柱在苦参碱含量测定中的应用[J].中国中药杂志,2013,38(17):2844-2847.
[6] 陈静,孙飞,孟江等.苦参不同组织部位的生物碱含量研究[J].亚太传统医药,2013,9(1):22-25.
ComparativeStudyonActiveIngredientContentinDifferentPartsofSophoraflavescens
GUANZhagen1,WUShangying2,GUOBaolin3*,WEIHongguo1,WANGYulong1,YANGXia1
(1.ShanxiZhengdongPharmaceuticalCo.,Ltd.,Changzhi047100,China;2.Changzhicountyagriculturecommittee,Changzhi047100,China;3.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences&PekingUnionMedicalcollege,Beijing100193,China)
Objective:To measure the total alkaloid content in different parts ofS.flavescensand provide a reference for reasonable utilization ofS.flavescens.Methods:The total alkaloid content in different parts ofS.flavescensof different growth years were analyzed by HPLC.Results:The total alkaloid content in different parts ofS.flavescensof different growth years had the similar rule,which was in following order:lower lateral root>upper lateral root>main root> underground stem>stem eye. The content of the total alkaloid inS.flavescenswas not significantly different between the upper main root and the lower main root,which were significantly different between the main root and the lower lateral root. The total alkaloid content increased largely in the second year and the third year,the third year can reach pharmacopoeia standards.Conclusion:Three years harvest is more reasonable,and the total alkaloid content in the three years in the underground stem and stem eye is higher.
Sophoraflavescens;different harvested parts;total alkaloid content;HPLC
*
郭宝林,研究员,博士,研究方向:药用植物资源,Tel:(010)57833172,E-mail:guobaolin010@163.com
10.13313/j.issn.1673-4890.2015.12.010
2015-02-03)
