杨梅素影响 EA.hy926 人血管内皮细胞增殖、侵袭迁移及微管形成的实验研究△
2015-09-25秦笑陈美娟
秦笑,陈美娟
(1.南京中医药大学 基础医学院,江苏 南京 210023)(2.南京中医药大学 江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
·基础研究·
杨梅素影响 EA.hy926 人血管内皮细胞增殖、侵袭迁移及微管形成的实验研究△
秦笑1,陈美娟2*
(1.南京中医药大学 基础医学院,江苏 南京 210023)(2.南京中医药大学 江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
目的:探讨杨梅素抗肿瘤血管新生的作用机制。方法:用不同浓度的杨梅素作用于体外培养的 EA.hy926 人血管内皮细胞株,采用MTT 法观察药物对细胞的增殖抑制作用,划痕法及transwell小室实验观察药物对细胞侵袭迁移能力的影响,tube formation 法观察药物对微管形成的影响。结果:杨梅素对EA.hy926细胞的增殖、侵袭迁移及血管生成呈浓度依赖性抑制,尤其在高浓度下(1 mM)其抑制作用最显著(P<0.01)。结论:杨梅素的抗肿瘤血管生成作用不仅通过抑制内皮细胞的增殖,而且通过抑制内皮细胞的侵袭迁移及微管样结构的形成来实现。
杨梅素;血管内皮细胞;增殖;侵袭/迁移;血管生成
杨梅素(myricetin)化学名为3,5,7,3′,4′,5′-六羟基黄酮,是一种重要的黄酮醇类化合物,广泛存在于多种天然植物中。现代药理学研究表明,其具有广泛的药理活性。据报道,杨梅素可以通过抑制肿瘤细胞的生长与增殖、促进其凋亡等途径发挥抗肿瘤作用[1-3],但杨梅素对肿瘤血管新生的抑制作用少有报道。
本研究用不同浓度的杨梅素对人血管内皮细胞株EA.hy926进行干预,通过MTT法、 transwell小室法、tube formation法等体外实验观察杨梅素对细胞增殖、侵袭迁移及微管形成的影响,进一步探讨杨梅素抗肿瘤血管生成作用的机理。
1 材料
1.1 细胞株
EA.hy926人血管内皮细胞株购于苏州大学医学部,培养于含有10%的胎牛血清、1%的羟乙基哌嗪乙硫磺酸缓种液(HEPES)、青霉素(50 IU·mL-1)、链霉素(100 U·mL-1)的1640培养基中,5%CO2、37 ℃恒温培养。
1.2 药物与试剂
杨梅素购自南京泽朗医药科技有限公司,纯度>99%,二甲亚砜(DMSO)助溶,1640 培养基稀释至所需浓度(DMSO的终浓度<0.3%),抽滤除菌。1640培养基、胎牛血清(Gibco公司);Transwell小室(Corning公司);胰酶、十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒(碧云天生物技术研究所)。
兔抗人MMP-2、MMP-9多克隆抗体(北京博奥森生物有限公司);鼠尾胶原蛋白(杭州生友生物技术公司);Matrigel(BD公司)。
2 方法
2.1 MTT法检测杨梅素对EA.hy926细胞增殖的影响
取对数生长期的细胞,胰酶消化后细胞计数,接种于96孔板,每孔加200 μL细胞悬液(含3×103个细胞),常规培养过夜,至细胞贴壁,换上梯度浓度分别为0.01、0.1、1 mmol·L-1的含药培养基,并设空白对照组。每个剂量设6个平行复孔,常规培养24 h后,吸弃培养基,每孔加质量浓度为5 mg·mL-1的MTT溶液20 μL,继续培养4 h,吸弃上清后每孔加DMSO 200 μL,振荡器振荡10 min后,酶标仪(美国 BIO-TEK 公司)测定490 nm的吸光度,重复3次。
2.2 Transwell小室侵袭实验
将细胞消化后用0.1%牛血清白蛋白(BSA)重悬,细胞(1×106)以每孔100 μL种入transwell小室,加药刺激,小室外部空间加入600 μL含10%小牛血清的完全培养基作为化学趋化剂。置5%CO2培养箱,37 ℃培养6 h。取出transwell,用棉签小心将小室膜上表面细胞去除,取下膜,自然风干。甲醇固定5 min,用HE染色法进行染色,苏木素染色10 min,分色剂中浸泡数秒,再投入伊红染色2 min,分别用50%、70%、80%、95%、100%乙醇脱水数秒,二甲苯透明,中性树脂封片。下表面细胞经染色后,显微镜下观察、照相,随机取5个视野计数,计算迁移率。
2.3 杨梅素对血管内皮细胞管腔形成的影响
鼠尾胶原蛋白凝胶的制备(以1 mL为例):取200 μL鼠尾胶原蛋白,置于冰浴的离心管中,加入690 μL蒸馏水,立即混匀,加入到含12 μL浓度为0.1 mol·L-1的氢氧化钠(NaOH)溶液中,混匀,再加入100 μL的10×PBS,混匀,每孔100 μL种于96孔板。先置于25 ℃ 20 min,再置于37 ℃过夜。将细胞消化,重悬,调整细胞浓度为2×105,每孔100 μL种于凝胶上,含终浓度分别为0.01、0.1、1 mmol·L-1的药物。孵育12 h,观察小管形成情况。
2.4 明胶酶谱法检测杨梅素对血管内皮细胞分泌MMP2、MMP9的影响
取对数生长期的细胞,以2×105个/孔的密度接种于24孔培养板中,培养24 h,加入含不同浓度杨梅素的无血清培养液300 μL,继续培养24 h。收集药物作用后细胞的无血清培养液,以12 000 rpm离心5 min,除细胞碎片,收集上清,立即使用或-70 ℃保存。BCA法进行蛋白浓度测定,根据蛋白浓度分别取相应的上清,与等量的上样缓冲液混合,进行SDS-PAGE凝胶电泳。制备10%分离胶和5%浓缩胶,分离胶中加入终浓度为0.32 mg·mL-1的明胶,以80 V电泳至溴酚蓝前沿进入分离胶,加压至110 V,继续电泳至溴酚蓝前沿至凝胶前端约1 cm,停止电泳、剥胶,用蒸馏水漂洗数次后,移入100 mL 2.5%TritonX-100溶液中,在摇床上低速摇动,以洗脱SDS。0.5 h后,用蒸馏水漂洗,换新的TritonX-100溶液,继续洗脱0.5~l h。用蒸馏水漂洗后,加100 mL明胶酶缓冲液,在37 ℃恒温温育42 h。凝胶用蒸馏水漂洗后,放入染色液(0.05%考马斯亮兰R-250,以甲醇-水-冰醋酸=45∶45∶10溶解)中,染色4 h,漂洗后,在脱色液(甲醇-水-冰醋酸=45∶45∶10)中脱色1~2 h,至对照出现清晰的负染酶带,在凝胶成像仪中照相,观察条带变化。
2.5 统计学方法
3 结果
3.1 杨梅素对EA.hy926细胞增殖的影响
MTT法观察不同浓度的杨梅素对EA.hy926血管内皮细胞增殖的影响,结果显示,与对照组相比,浓度分别为0.01、0.1、1 mmol·L-1的杨梅素作用细胞24 h后,对EA.hy926细胞的增殖均有抑制作用,其中以1 mmol·L-1的药物抑制最为显著(P< 0.01),见图1。
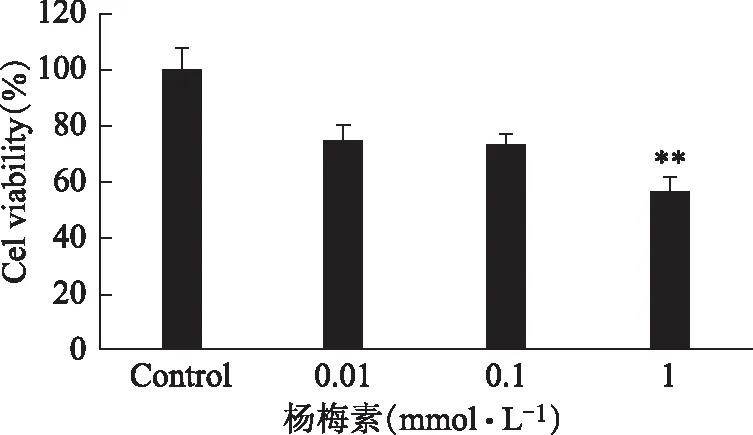
注:与对照组相比**p< 0.01。图1 不同浓度杨梅素对EA.hy926细胞生长的抑制率(n=6)
3.2 transwell实验检测杨梅素对EA.hy926细胞侵袭能力的影响
transwell小室实验检测杨梅素对EA.hy926细胞侵袭能力的改变,结果发现,杨梅素处理后,EA.hy926细胞的侵袭能力下降,且呈剂量依赖性。浓度分别为0、0.01、0.1、1 mmol·L-1的杨梅素处理各组迁移过膜的细胞数分别为(171±13.4)、(76.8±9.19)、(47.2±2.9)、(34.4±5.5),各浓度组与阴性对照组间差异有统计学意义(p<0.05),其中1 mmol·L-1处理组与阴性对照组之间差异极具统计学意义(p<0.01)。见图2。

注:A.Control;B.0.01 mmol·L-1;C.0.1 mmol·L-1;D.1 mmol·L-1。下同。图2 杨梅素对细胞迁移实验的影响
3.3 杨梅素对血管内皮细胞管腔形成的影响
杨梅素浓度为0的阴性对照组和0.01 mmol·L-1的处理组在12 h时均已出现微管样结构,并随着时间延长逐渐显著;而浓度为0.1、0.01 mmol·L-1处理组典型的微管样结构明显减少。见图3。

图3 不同浓度杨梅素对EA.hy926细胞微管形成的影响
3.4 明胶酶谱实验
明胶酶谱法检测结果显示,在杨梅素处理细胞24 h后,其高剂量组(1 mmol·L-1)对MMP-2和MMP-9的酶解条带都有显著抑制作用,尤其是对MMP-9的抑制作用更显著。见图4。

图4 明胶酶谱法检测不同浓度的杨梅素对EA.hy926细胞MMP-2、MMP-9表达的影响
4 讨论
当肿瘤的生长超过一定体积后,必须有新的血管为其提供氧气和营养,并带走代谢产物,否则肿瘤的生长将处于休眠状态。肿瘤血管生成是指肿瘤细胞诱发的毛细血管新生以及肿瘤中微循环网的形成,为实体瘤的后续生长提供物质基础。基于此理论,抗血管生成的治疗策略成为肿瘤治疗的热点方向之一。
肿瘤新生血管的生成过程及调控机制十分复杂,其基本过程包括内皮细胞被肿瘤细胞及其支持细胞分泌的趋化因子募集至肿瘤部位后,在各种生长因子的作用下大量增殖并相互黏附,重排组成血管。在此过程中,内皮细胞的迁移能力、到达新生部位后的增殖能力及血管形成能力是有关肿瘤新生血管形成的几个重要因素[4-5]。
本研究选择EA.hy926血管内皮细胞作为研究对象,通过观察杨梅素对其增殖能力、侵袭迁移能力及血管形成能力的影响,评价杨梅素对肿瘤新生血管形成的抑制作用。研究结果表明,杨梅素在高剂量下,即1 mmol·L-1的剂量下对EA.hy926血管内皮细胞的增殖、侵袭迁移及微管生成具有显著的抑制作用。
另外,在内皮细胞降解并穿透血管与肿瘤间基质,到达肿瘤部位的过程中,基质金属蛋白酶(Matrix metallopeptidases,MMPs)降解细胞外基质是重要的一环。明胶酶谱实验检测结果表明,高剂量(1 mmol·L-1)的杨梅素对MMP-9和MMP-2的蛋白水平均有显著的抑制作用。
综上所述,杨梅素在较高的剂量下能通过抑制细胞的增殖、侵袭迁移及微管形成起到抗肿瘤新生血管形成的作用。
[1] 林国钡,谢燕,李国文.杨梅素的研究进展[J].国际药学研究杂志,2012,39(6):483-487.
[2] 代雄,颜杰宽,甘秀海.黄酮类化合物研究进展[J].贵州师范学院学报,2013,29(9):302-306.
[3] Deeba N S,Vaqar M A,Mohammad I K,et al.Inhibition ofAkt/mTOR signaling by the dietary flavonoid fisetin[J].Anticancer Agents Med Chem,2013,13(7):995-1001.
[4] 陈信义,徐力,张燕明,等.恶性肿瘤新生血管研究进展[J].癌症进展杂志,2005,3(6):528-533.
[5] 赵黎明,徐寒梅,奚涛.肿瘤血管生成及其抑制剂研究进展[J].药物生物技术,2010,17(5):457-461.
InhibitoryEffectsofMyricetinonAngiogenesisofHumanEA.hy926cells
QINXiao1,CHENMeijuan2*
(1.ThePre-clinicalMedicineCollege,NanjingUniversityofChineseMedicine,Nanjing210023,China;2.JiangsuCollaborativeInnovationCenterofTraditionalChineseMedicine(TCM)PreventionandTreatmentofTumor,NanjingUniversityofChineseMedicine,Nanjing210023,China)
Objective:To explore the inhibition effects of myricetin on angiogenesis of human EA.hy926 cellsin vitro.Methods:MTT assay,transwell assay and matrigel tube-formation assay were used to detect the effects of myricetin on the proliferation,invasion and tube-formation of EA.hy926 cells.Gelatin zymography assay was used to detect the effects of myricetin on the enzyme activities of matrix metalloproteinase-2(MMP-2)and matrix metalloproteinase-9(MMP-9).Results:At the concentration of 1 mmol/L,myricetin effectively inhibited the proliferation,invasion and tube-formation of EA.hy926 cells(P<0.01).Conclusion:Myricetin inhibits angiogenesis of EA.hy926 cells mainly through inhibiting the proliferation,invasion and tube-formation in EA.hy926 cells.
Myricetin;EA.hy926 cells;proliferation;invasion;angiogenesis
2015-02-28)
江苏省高校优势学科建设工程项目(PAPD);江苏自然基金(BK20131415);欧盟第七框架项目(PIRSES-GA-2013-612589)
*
陈美娟,博士,副教授,研究方向:中医药抗肿瘤及其机制;E-mail:mjchen9680@sina.com
10.13313/j.issn.1673-4890.2015.5.007
