大蒜中γ-谷氨酰半胱氨酸衍生物对食品加工中晚期糖基化终产物的抑制作用
2015-09-22刘玲石飞闫凤娇白冰
刘玲,石飞*,闫凤娇,白冰
(沈阳农业大学食品学院,辽宁沈阳110866)
大蒜中γ-谷氨酰半胱氨酸衍生物对食品加工中晚期糖基化终产物的抑制作用
刘玲,石飞*,闫凤娇,白冰
(沈阳农业大学食品学院,辽宁沈阳110866)
目的:比较大蒜中提取的γ-谷氨酰半胱氨酸衍生物γ-谷氨酰-甲基-半胱氨酸(γ-glutamyl-methyl-cysteine,γ-GMC)、γ-谷氨酰-丙基-半胱氨酸(γ-glutamyl-propyl-cysteine,γ-GPC)及人工合成的γ-谷氨酰-丁基-半胱氨酸(γ-glutamyl-butyl-cysteine,γ-GBC)对食品加工中产生的晚期糖基化终产物(advanced glycation end-products,AGEs)的抑制作用。方法:在加入抑制剂条件下,通过紫外-可见吸光光度法检测反应初产物乙二醛、果糖胺生成量的变化;运用荧光法检测戊糖素和荧光性AGEs在反应过程中生成量的变化;采用高效液相色谱法检测终产物羧甲基赖氨酸(carboxymethyl lysine,CML)生成量的变化。结果:γ-GMC和γ-GPC对早中期反应产物抑制效果较好,而γ-GBC对末期产物抑制效果明显,3种抑制剂对于抑制荧光性产物效果相似。结论:3种半胱氨酸衍生物均可抑制晚期糖基化反应,因其取代基不同而对糖基化反应产物抑制效果不同,但对荧光性交联产物抑制能力类似。
γ-谷氨酰-甲基-半胱氨酸;γ-谷氨酰-丙基-半胱氨酸;γ-谷氨酰-丁基-半胱氨酸;糖基化终产物;抑制作用
美拉德反应(Maillard reaction)是一种广泛存在于食品工业中的非酶糖基化反应过程,主要由羰基化合物(主要为还原糖)与氨基化合物(氨基酸、蛋白质等)反应产生,形成大量的棕黑色大分子物质(称类黑素)[1],反应过程中还会产生多种具有不同气味的中间体分子,这些产物对食品色、香、味的形成起着极为重要的作用。美拉德反应不仅发生在温度较高的食品烹煮过程,也可发生在室温贮藏条件下,它包括一系列复杂的反应过程,产物也复杂多样,其中反应产物之一晚期糖基化产物(advanced glycation end-products,AGEs)是目前医学上的研究热点[2-3]。AGEs是一类影响蛋白质结构和稳定性、诱导蛋白质发生聚合交联、改变蛋白质功能特性的产物,它涉及到糖尿病和衰老等相关病理的生理变化,并引发动脉粥样硬化、肾病、白内障、阿尔茨海默氏病、帕金森以及肌萎缩侧索硬化等多种疾病[4]。体内的AGEs在高血糖及肾功能衰竭的机体中易形成,体外摄入的AGEs大部分来自高营养膳食。AGEs积累于机体不同组织器官中,AGEs不仅可以直接影响细胞与组织的功能、参与疾病的产生,也可通过与特异受体结合发生反应来改变蛋白质和细胞功能,导致机体的病理变化。人体摄入富含AGEs的高营养食品后,大约有10%的AGEs以小分子颗粒的形式与短肽和氨基酸一同进入血液循环,剩下的AGEs1/3通过肾脏排出体外,其余2/3留在体内参与体内AGEs,激活细胞及促进炎症反应。研究者通过抑制AGEs的形成,加速AGEs的降解,阻隔AGEs的氧化过程,阻断AGEs与体内晚期糖基化终产物受体的结合以及抑制结合蛋白的作用,来降低组织和血液中的AGEs含量,减轻AGEs的致病作用[5]。在AGEs抑制剂中,氨基胍目前作为临床的主要用药,但是它存在一定的致毒性,因此天然产物抑制剂的开发成为当前研究的重点,有研究发现硫胺素等对AGEs中的羧甲基赖氨酸(carboxymethyl lysine,CML)、羧乙基赖氨酸有很好的抑制作用[6]。
大蒜(Allium sativum L.)属百合科葱属,世界各国均有分布,被认为是日常最佳保健食品之一,常食之具有祛湿抗毒、健脾强身的功效。现代医学研究表明,大蒜的保健和药理功能与其中所含的特殊功能成分有关。大蒜独特的辛辣气味及功能成分来源于一类性质稳定的风味前体物质S-烃基-半胱氨酸亚砜(S-hydrocarbylcysteine sulfoxides,CSOs),它是由γ-谷氨酰半胱氨酸肽(γ-glutamine peptides cysteine,γ-GPC)经氧化酶和γ-谷氨酰转肽酶催化、再经过一系列的氧化还原反应形成挥发性的含硫化合物[7]。目前研究表明,CSOs含有4种衍生物,其中S-烯丙基-L-半胱氨酸亚砜(S-allyl-L-cysteine sulfoxide,ACSO,蒜氨酸)含量最高,约占总量的85%,国外研究表明陈年大蒜中的这种物质对体内的非酶糖基化反应有很好的抑制作用[8]。该类有机硫化物也是大蒜的主要功能成分。Malgorzata等[9]研究发现陈年大蒜中的S-烯丙基半胱氨酸对糖基化反应中蛋白质的裂解、交联有很好的抑制作用,并对无交联性的糖基化产物CML有抑制作用;也有研究认为因S-烯丙基半胱氨酸与还原糖的羰基反应而阻碍了糖基化反应及产物的生成[10]。但此类研究主要基于模拟体内糖基化反应,是从医学角度来考察CSOs对机体的作用。目前对食品加工过程中高营养食品糖基化反应的抑制作用鲜有报道,使得高营养食品在加工中存在累积AGEs的隐患。
本课题组经研究发现鲜蒜提取物对非酶糖基化也有很好的抑制作用,特别是在食品加工和贮藏过程中,鲜蒜中的半胱氨酸衍生物能够在食品加工的中温和高温条件下有效抑制糖基化反应,但机理尚不十分明确。本研究以鲜蒜中提取的主要半胱氨酸衍生物:γ-谷氨酰-甲基-半胱氨酸(glutamyl-methyl-cysteine,γ-GMC)和γ-GPC作为抑制剂,比较鲜蒜中不同取代基结构的含硫化合物对AGEs的抑制作用,阐明鲜蒜中抑制AGEs的含硫化合物的主要作用位点,为深入探究鲜蒜中半胱氨酸肽类成分对食品加工过程中产生的糖基化产物的抑制机理提供依据。
1 材料与方法
1.1材料与试剂
L-赖氨酸、D-葡萄糖、磷酸二氢钠、磷酸氢二钠、乙酸钠、盐酸羟胺、硝基四氮唑蓝、无水乙醇、冰乙酸(分析纯)、甲醇、甲酸(色谱纯)上海国药集团化学试剂有限公司;氨水、盐酸(分析纯)沈阳化学试剂厂;Dowex50×4-400阳离子交换树脂、Dowex2×8-200阴离子交换树脂美国Sigma-Aldrich公司;γ-GMC和γ-GPC实验室分离;γ-谷氨酰-丁基-半胱氨酸(γ-glutamyl-butyl-cysteine,γ-GBC)实验室合成。
1.2仪器与设备
722紫外分光光度计北京普析通用仪器有限责任公司;F-4600荧光分光光度仪日本日立公司;D-2000 Elite制备型液相色谱仪日本Hitachi公司;Prominence LC-20AB高效液相色谱仪美国惠普公司。
1.3方法
1.3.1γ-GMC和γ-GPC的分离提取及γ-GBC的合成
称取新鲜大蒜1 000 g,加入800 mL无水乙醇,保鲜膜封口,水浴沸腾并保持5 min,冷却,倒入打浆机,高速匀浆5 min,打碎成泥,6 层纱布粗滤,再滤纸过滤,泥浆添加500 mL无水乙醇二次提取,滤液合并,60 ℃旋转蒸发浓缩至约500 mL,用2 mol/L盐酸调至pH 2.0,经滤纸及0.45 μm膜过滤后离子交换柱分离。采用文献[11-12]的改进方法,Dowex 50×4-400阳离子树脂先用1 mol/L NaCl再生,并用大量去离子水洗涤至无氯离子流出(AgNO3检测),将上步提取液以15 mL/min流速上Dowex 50×4-400阳离子交换柱(5.0 cm×60 cm),15 mL/min流速下先用1 500 mL去离子水淋洗阳离子柱,洗脱液弃去,再用1 500 mL 1 mol/L氨水淋洗阳离子柱,收集黄色洗脱液。将洗脱液合并,75 ℃旋转浓缩至约300 mL,经10%冰乙酸调整至pH 7.0后以15 mL/min流速上Dowex 2×8-200阴离子交换柱(5.0 cm×40 cm,此柱先用1 mol/L乙酸钠再生,后去离子水洗净)。在15 mL/min流速下先用1 000 mL去离子水淋洗阴离子柱,洗脱液弃去,再用1 000 mL 10%冰乙酸淋洗阴离子柱,收集浅黄色洗脱液,经0.45 μm膜过滤后冷冻干燥成淡黄色粉末,得到γ-GPC、γ-GMC粗提物,经D-2000 Elite制备型液相色谱仪(色谱条件:Global Chromatography C18(250 mm×20 mm,5 μm);流动相:V(甲醇)∶V(水)=60∶40;进样质量浓度0.2 g/mL;进样量1 mL,流速4 mL/min;柱温25 ℃)分离纯化得到γ-GPC、γ-GMC。
称取L-半胱氨酸盐酸盐7.9g置于200mL烧杯中,然后加100mL无水乙醇,搅拌均匀后逐滴加入20mol/L的NaOH溶液11.25mL,溶液逐渐变成乳白色,搅拌2min后加7mL溴代正丁烷,搅拌5min,出现黏稠的胶状的物质,放置40min,用乙酸调至pH5.0~5.5,封口置于4℃冷藏过夜,抽滤并收集白色沉淀,干燥,得S-丁基-L-半胱氨酸。取S-丁基-L-半胱氨酸1.4g,加入质量分数10%的NaHCO3溶液15mL及6.5mL蒸馏水搅匀,pH7.5左右加入上步得到的溶液,搅拌7h,去掉有机层,乙酸乙酯洗2次,重复除去有机层,冰水冷却,用6mol/L HCl调至pH2.5~3.0,在真空干燥器中干燥得到固体γ-GBC。
1.3.2L-赖氨酸与葡萄糖反应体系的制备
将0.2mol/L的L-赖氨酸与0.6mol/L的葡萄糖以1∶3的质量比溶解在pH8.0的磷酸盐缓冲液(phosphate buffer solution,PBS)中作为反应体系[13],在温度为60℃恒温箱中反应1~5h。
1.3.3半胱氨酸衍生物抑制剂质量浓度的确定
半胱氨酸衍生物γ-GMC、γ-GPC及γ-GBC分别选取0.10、0.15、0.20mg/mL3个质量浓度,加入配制好的糖基化反应体系,不加抑制剂组作空白对照,60℃恒温培养箱中反应,取4h后的反应样液进行280~500nm波长范围扫描,比较不同质量浓度抑制剂的抑制效果,确定抑制剂最佳抑制质量浓度。
1.3.4早期糖基化产物乙二醛的测定
分别取1、2、3、4h各组反应样液0.5mL于50mL容量瓶中,加入15g/L乙酸钠溶液1.0mL,2g/L盐酸羟胺溶液2.0mL,50℃水浴加热20min,冷却后用蒸馏水定容,不加抑制剂组为空白对照,PBS缓冲液空白调零,测定233nm波长处吸光度(A233nm)。
1.3.5早期糖基化产物果糖胺的测定
硝基四氮唑蓝(nitroblue tetrazolium,NBT)还原法[14]。分别取1、2、3、4h各组反应样液40μL,加0.025mol/L NBT试液2mL,37℃水浴反应5min,以10%醋酸溶液中止反应,不加抑制剂组为空白对照,PBS缓冲液空白调零,测定530nm波长处的吸光度(A530nm)。
1.3.6戊糖素的测定
戊糖素具有荧光性,分别取1、2、3、4h各组反应样液0.1mL于小试管中,用PBS缓冲液30倍稀释,在激发波长335nm,发射波长382nm波长处测定荧光强度[15]。
1.3.7荧光性AGEs的测定
荧光性AGEs生成物具有自发荧光的特性,在激发波长370nm,发射波长440nm处有最大的吸收峰[16]。分别取1、2、3、4h各组反应样液0.1mL于小试管中,用PBS缓冲液30倍稀释,测定其荧光强度。
1.3.8糖基化产物CML的测定
CML是非酶糖基化反应中的重要产物,是产物AGEs中含量最多的一种,无荧光性。本实验采用高效液相色谱(high performance liquid chromatography,HPLC)法来检测比较糖基化反应体系中CML的生成量[17-20]。分别取反应4h的各组反应样液,经0.45μm滤膜过滤,20μL进样。
高效液相色谱法条件:色谱柱:Waters AtlantisT3C18色谱柱(150mm×4.6mm,5μm);流动相:V(0.1%甲酸)∶V(甲醇)=70∶30;流速0.5mL/min;柱温:25℃;进样量:20μL;运行时间:10min。
1.4数据处理方法
采用SPSS13.0软件数据分析;采用Origin8.0软件作图。
2 结果与分析
2.1抑制剂最适质量浓度的确定
通过改变3种抑制剂质量浓度,表明三者的抑制作用都随质量浓度增加而增大,不同质量浓度的γ-GMC、γ-GPC、γ-GBC加入非酶糖基化反应体系中60℃反应4h,冷却后280~500nm紫外扫描,结果见图1。结合提取分离量,选择中间质量浓度0.15mg/mL作为实验中抑制剂的最佳抑制质量浓度。


图1 3种不同质量浓度抑制剂在280~500nm波长范围扫描的光谱图Fig.1Scanning spectra of three inhibitors at different concentrations in the wavelength range of280-500nm
2.2抑制剂对乙二醛的抑制作用
乙二醛是糖基化反应的初中级产物,其生成量可以通过其与乙酸羟胺生成的乙二醛二肟的A233nm值来表示,吸光度大小反映了乙二醛在反应体系中生成量的多少,通过吸光度可比较3种抑制剂的作用能力。由图2可知,γ-GMC和γ-GBC对乙二醛没有抑制作用,甚至这两种抑制剂参与到反应中使羰基化合物释放出更多的乙二醛,而γ-GPC对乙二醛的抑制效果明显(P<0.05)。乙二醛是初中级产物,所以这个结果说明γ-GMC和γ-GBC对糖基化反应的初中期产物抑制效果差,而γ-GPC对初中期产物抑制效果好。
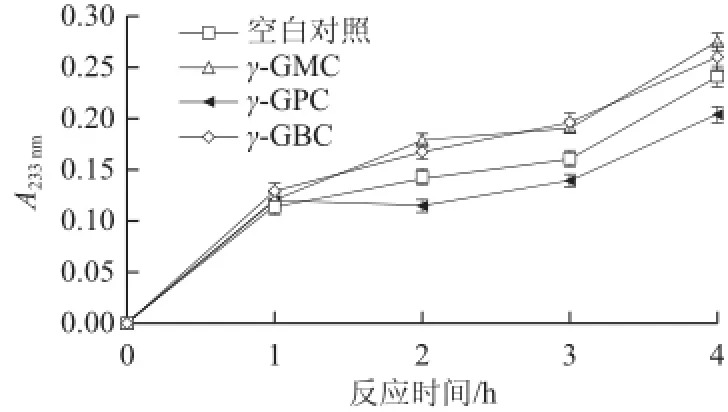
图2不同抑制剂作用下乙二醛生成量随反应时间的变化趋势Fig.2Plots of glyoxal production as a function of reaction time in the presence of different inhibitors
2.3抑制剂对果糖胺的抑制作用
果糖胺作为糖基化的早期产物,极大地影响着糖基化反应的进行。通过还原法对果糖胺测定,其吸光度的大小表明了反应过程中果糖胺生成量的高低,进而反映了抑制剂对糖基化早期反应抑制能力的差异。由图3可知,在不同反应体系中,果糖胺的生成随时间延长逐步下降,后期迅速上升。这说明前期生成的果糖胺因逐步参与美拉德中末期反应而消耗,吸光度呈下降趋势;随反应时间延长,果糖胺生成速率增大,后期累积,吸光度增加;对于抑制体系而言,γ-GMC开始抑制作用明显(P<0.05),后期几乎没有抑制作用;γ-GPC则在后期抑制效果好(P<0.05);γ-GBC始终保持一定的抑制率,没有随反应时间明显变化。这说明γ-GMC从初始就参与了抑制果糖胺的反应,随反应时间的延长γ-GMC消耗殆尽,后期难以抑制果糖胺的生成;相反,γ-GPC可能是缓慢释放参与抑制反应,随反应时间延长内部结构发生变化,暴露出更多的基团参与抑制反应,使后来的抑制率明显增加。通过反应速率的对比,甲基衍生物(γ-GMC)抑制作用出现得早,说明甲基在反应过程中因分子小、空间位阻低,对谷氨酰-半胱氨酸类抑制剂的抑制能力有促进作用,而丙基衍生物(γ-GPC)则相反。对于丁基衍生物(γ-GBC),其变化趋势与空白一致,很可能因为该衍生物为合成物质,在加速反应过程中,丁基侧链基团没有参与反应。

图3不同抑制剂作用下果糖胺的生成量随反应时间的变化趋势Fig.3Plots of fructosamine production as a function of reaction time in the presence of different inhibitors
2.4抑制剂对戊糖素的抑制作用
戊糖素是戊糖和赖氨酸、精氨酸交联反应生成的主要糖基化终产物之一,具有荧光性[20-21]。荧光强度大小反映了戊糖素生成量的多少,戊糖素生成量可评估糖基化过程中蛋白质损伤,也是衡量抑制剂对AGEs抑制作用的参考。由图4可知,3个抑制剂组分别与空白对照组比较,γ-GBC在整个反应过程的抑制效果一致,抑制率基本上在19%左右,而γ-GMC与γ-GPC在反应前期(3h内)抑制效果相似,后期γ-GMC抑制效果略好(P<0.01)。因此就抑制戊糖素而言,3种抑制剂都具有一定的抑制能力,且抑制能力相近。

图4不同抑制剂作用下戊糖素生成量随反应时间的变化趋势Fig.4Plots of pentosidine production as a function of reaction time in the presence of different inhibitors
其机制可能是:半胱氨酸衍生物抑制剂本身是氨基酸类物质,在糖基化反应体系中加入此类抑制剂后,它们可能先与戊糖结合从而参与糖基化反应,或者与阿姆德瑞产物结合,优先占据美拉德反应的交联位点,导致戊糖与赖氨酸或其初级产物的交联无法有效进行,进而抑制了交联产物戊糖素的产生。
2.5抑制剂对荧光性AGEs的抑制作用
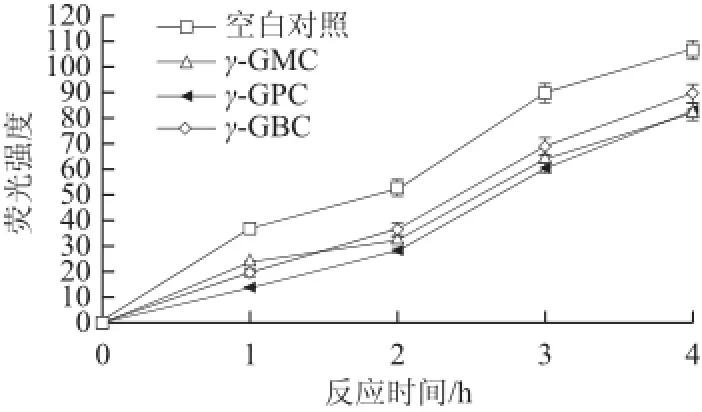
图5不同抑制剂作用下AGEs随反应时间的变化趋势Fig.5Effect of different inhibitors on AGEs as a function of reaction time
AGEs会引起蛋白质变性,导致其结构和功能损伤,由于多数AGEs产物具有自发荧光性,因而可通过测定其荧光强度来反映AGEs水平[21-22]。由图5可知,相对于空白对照组,γ-GBC的抑制效果始终不变,γ-GPC的抑制效果始终优于γ-GBC,γ-GMC虽然前期抑制效果较差,但是后期抑制效果明显增强(P<0.05)。由此可知,3类
γ-谷氨酰-半胱氨酸衍生物对荧光性AGEs均有一定的抑制作用。AGEs是糖基化终产物的总称,包括一些具有荧光性的产物和一些无荧光性的物质,两类物质的反应途径不同,结构也存在很大差异。实验中检测的反应早期产物果糖胺和早中期产物乙二醛是由阿姆德瑞产物与多种糖酵解产物缩合形成的,它们进一步反应生成无荧光的终产物,如CML或吡咯素等;而荧光性AGEs主要是氨基酸之间的交联产物,如戊糖素。2.4、2.5节的结果证明了半胱氨酸衍生物对荧光性产物产生的抑制能力:3种抑制剂对戊糖素和荧光性AGEs的抑制效果一致,说明糖基化反应产物中荧光类物质具有相似结构,而抑制剂对这类产物的抑制能力也类似。
2.6抑制剂对产物CML的抑制作用

图6CML含量的HPLC图HPLCFig.6Effect of different inhibitors on CML production
由图6可知,空白对照组CML质量分数为55.34%,加入γ-GPC的体系中CML生成量最少,为34.96%;加入γ-GBC的次之为37.78%;加入γ-GMC的体系中CML质量分数为38.08%。通过比较可看出,抑制剂γ-GPC对CML生成的抑制作用最好(P<0.05),结合2.2节得到的结论γ-GPC对乙二醛抑制效果最好,推断γ-GPC对CML的抑制作用主要源于其对中间产物乙二醛生成的抑制,由此也间接证明反应过程中乙二醛是合成CML的主要前体物质。
3 讨论
温度是影响美拉德反应的一个主要因素,温度越高,褐变速度越快。实验以60℃作为体系的反应温度,与多数模拟体系设定的温度不同,因为多数文献研究该类反应是以医学研究为目的,所以设定的体系温度多是37℃[23-25],本研究的出发点是抑制食品加工过程中的糖基化反应产物,以60℃作为体系温度,没有采用高温的加热模型,目的是在相对温和的反应条件下观察各中间产物的生成,从而明确抑制剂作用的位点,但这个温度对于鲜蒜提取物的抑制作用是否最适合、是否能够代表高温反应条件下的抑制能力还有待进一步研究。
虽然大量的实验已经证明了大蒜中活性物质的抗氧化性,但其对非酶糖基化产物的抑制能力和机理研究较少。有文献表明陈年大蒜中提取的抗氧化物质,其中最主要是有机硫化合物S-烯丙基-L-半胱氨酸和S-烯丙基巯基-L-半胱氨酸,它们通过与还原糖羰基结合、螯合金属离子等抑制糖基化终产物AGEs的形成[26-27]。比较而言,鲜蒜中半胱氨酸衍生物的抗氧化性鲜有研究,抗糖基化作用也未见报道,鲜蒜中的γ-GMC、γ-GPC在结构上与陈蒜中S-烯丙基-L-半胱氨酸的侧链不同,因而其对糖基化反应的抑制效果可能也不一样。本研究中的3种半胱氨酸衍生物对糖基化反应均有抑制作用,但由于食品的糖基化反应是复杂的化学过程,具体的抑制机理还需进一步深入研究。
4 结论
通过鲜蒜γ-谷氨酰-半胱氨酸衍生物对葡糖糖与L-赖氨酸反应体系早中期产物乙二醛和果糖胺,荧光性产物戊糖素,主要荧光产物AGEs及非荧光性产物CML抑制能力的实验,证明3种半胱氨酸衍生物均可抑制糖基化反应。
进一步对比发现γ-GMC和γ-GPC对无荧光性的糖基化早中期的产物抑制效果好,而γ-GBC的抑制能力有限。3种抑制剂因取代基不同,体现了不同的抑制效果,说明取代基不同对其抑制能力有一定影响,侧链短的衍生物(甲基衍生物)其空间位阻小、分子小、能够快速与还原糖的羰基反应,并易于与小分子底物反应;反之,侧链长的衍生物需要首先在高温条件下变性后才能参与反应。对于荧光性AGEs,3种半胱氨酸衍生物具有类似的抑制效果,说明3种抑制剂能够有效抑制糖基化反应中交联性物质的产生。
[1]BARZEGAR A,MOVAHEDI M,SATTARAHMADY N,et al.Spectroscopic studies of the effects of glycation of human serum albumin on L-Trp binding[J].Protein and Peptide Letters,2007,14(1):13-18.
[2]CONTRERAS C L,NOVAKOFSKI K C.Dietary advanced glycation end products and aging[J].Nutrients,2010,2(12):1247-1265.
[3]CHAO P,HSU C,YIN M.Analysis of glycation in sauces and saucestreated foods[J].Food Chemistry,2009,113(1):262-266.
[4]GOLDIN A,BECKMAN J,SCHMIDT A M,et al.Advanced glycation end products sparking the development of diabetic vascular injury[J].Circulation,2006,114(6):597-605.
[5]KOSCHINSKY T,HE C J,MITSUHASHI T,et al.Orally absorbed reactive glycation products(glycotoxins):an environmental risk factor in diabetic nephropathy[J].Proceedings of the National Academy of Sciences,USA,1997,94(12):6474-6479.
[6]周燕琼,金城,张英.晚期糖基化终末产物(AGEs)形成途径、检测方法和抑制手段研究进展[J].中国食品学报,2013,13(6):175-184.
[7]张百俊,杨和连,刘爱琴.大蒜功能研究现状[J].河南科技学院学报:自然科学版,2007,35(4):33-35.
[8]李娜.大蒜的功效成分及其应用的研究进展[J].中国食物与营养,2007(11):25-27.
[9]MALGORZATA L,INGA M,LIDIA W.Biological properties of garlic and garlic-derived organic sulfur compounds[J].Environmental and Molecular Mutagenesis,2009,50(3):247-265.
[10]MACAN H,UYKIMPANG R,ALCONCEL M,et a1.Aged garlic extract may be safe for patients on warfarin therapy[J].Nutrition,2006,136(3):793-795.
[11]KUBEC R,VEL☒☒EK J,KV☒ČALOV☒M,et al.29Si and13C NMR spectra of tert-butyldimethylsilyl derivatives of amino acids[J].Magnetic Resonance in Chemistry,Analytical Chemistry,2005,33(6):458-460.
[12]LAWSON L D,WOOD S G,HUGHE B G.γ-Glutamyl-S-alkylcysteines in garlic and other Allzum spp.[J].Journal of Natural Products,1991a,54(1):436-444.
[13]YE X J,TB N,RYOJI N.Inhibitory effect of fermentation byproducts on formation of advanced glycation end-products[J].Food Chemistry,2010,121(4):1039-1045.
[14]SHENS C,TSENG C,WUJS B.An analysis of the glucose/glycine Maillard reaction pathways:influence of pH and reactant initial concentrations[J].Food Chemistry,2005,92(3):437-448.
[15]LIMA M,ASSAR S H,AMES J M.Formation of N-(carboxy-methyl)lysine and loss of lysine in casein glucose-fatty acicl model systems[J].Journal of Agricultural and Food Chemistry,2010,58(3):1954-1958.
[16]YAMAGISHI S,MATSUI T,NAKAMURA K.Possible link of food-derived advanced glycation end products(AGEs)to the development[J].Medical Hypotheses,2008,71(6):876-878.
[17]GOLDBERG T,CAI W,PEPPA M,et al.N-(carboxy-methyl)lysine content of foods commonly consumed in a Western style diet[J].Food Chemistry,2012,131(1):170-174.
[18]AMES J M.Determination of N-(carboxy-methyl)lysine in foods and related systems[J].Annals of the New York Academy of Science,2008,1126(4):20-24.
[19]ASSAR S H,MOLONEY C,LIMA M,et al.Determination of N-(carboxy-methyl)lysine in food systems by ultra performance liquid chromatography-mass spectrometry[J].Amino Acids,2009,36(2):317-326.
[20]CHIHAO W,SHANGMING H,JERAN L,et al.Inhibition of advanced glycation endproduct formation by foodstuffs[J].Food Function,2011,2(5):215-280.
[21]吴光杰,田颖刚,谢明勇,等.乌骨鸡活性肽对体外非酶糖基化的抑制作用[J].南昌大学学报,2007,31(5):456-460.
[22]YEAMY J,TORAN N.Inhibitory effect of fermentation byproducts on formation of advanced glycation end-products[J].Food Chemistry,2010,121(4):1039-1045.
[23]XANTHIS A,HATZITOLIOS A,KOLIAKOS G,et al.Advanced glycation end products and nutrition-possible relation with diabetic atherosclerosis and how to prevention[J].Journal of Food Science,2007,72(8):125-129.
[24]JAIME U,SANDRA W,SUSAN G.Advanced glycation end products in foods and a practical guide to their reduction in the diet[J].Journal of American Dietetic Association,2010,110(6):911-916.
[25]阎淼淼,许真,徐蝉,等.大蒜功能成分的研究进展[J]. 食品科学,2010,31(5):312-318.
[26]URIOS P,STERNBERG M.Flavonoids inhibit the formation of the cross-link AGE pentosidine in collagen incubated with glucose,according to their structure[J].European Journal of Nutrition,2007,46(3):139-146.
[27]MEGHA P,YADAGIRI R P,MUTHENNA G,et al.Prevention of non-enzymic glycation of proteins by dietary agents:prospects for alleviating diabetic complications[J].British Journal of Nutrition,2009,101(11):1714-1721.
Effect ofγ-Glutamyl Cysteine Derivatives from Garlic on Advanced Glycation End-Product(AGE)Formation during Food Processing
LIU Ling,SHI Fei*,YAN Fengjiao,BAI Bing
(College of Food Science,Shenyang Agricultural University,Shenyang110866,China)
Three types of cysteine derivatives,γ-glutamyl-methyl-cysteine(γ-GMC),γ-glutamyl-propyl-cysteine(γ-GPC)andγ-glutamyl-butyl-cysteine(γ-GBC),were used for the inhibition of advanced glycation end-product(AGE)formation.
γ-GMC andγ-GPC were extracted from fresh garlic andγ-GBC was synthetic.In this study,after modeling,fructosamine and glycosylation,non-enzymatic glycosylation products were detected by ultraviolet-visible absorption spectrometry.Pentosidine and AGEs were analyzed by fluorescence spectrometry and carboxymethyl lysine(CML)was measured by HPLC.The results showed that the inhibition ability ofγ-GMC andγ-GPC were better for the non-fluorescent early and middle glycosylation reaction products.γ-GBC had an evident inhibitory effect on the late reaction products.In a word,three cysteine derivatives can effectively inhibit advanced glycation reaction but their effects are different because they have different substitution groups,and they have similar effects on the fluorescent cross-linked products.
γ-glutamyl-methyl-cysteine(γ-GMC);γ-glutamyl-propyl-cysteine(γ-GPC);γ-glutamyl-butyl-cysteine(γ-GBC);advanced glycation end-products(AGEs);inhibitory effect
TS201.2
A
1002-6630(2015)05-0050-06
10.7506/spkx1002-6630-201505010
2014-05-17
辽宁省自然科学基金项目(2014027003)
刘玲(1974—),女,副教授,博士研究生,研究方向为基于自由基氧化反应的含脂食品晚期糖基化终产物形成机理。E-mail:1210197616@qq.com
石飞(1988—),女,硕士研究生,研究方向为基于自由基氧化反应的含脂食品晚期糖基化终产物形成机理。E-mail:2604826491@qq.com
