Erode-Dilate结合球形三维分析法在Micro-CT评估牙槽骨量中的应用
2015-09-20刘雪飞
刘雪飞,张 旭,林 江
(哈尔滨医科大学附属第四医院口腔科,黑龙江哈尔滨150001)
牙槽骨吸收是牙周炎的典型病理性改变,也是判定患牙预后的重要依据[1]。牙槽骨吸收包括牙槽骨体积减小和牙槽骨密度的降低,虽可通过组织病理形态学计量法对其进行评估,并一直被视为是评估骨吸收的金标准[2];但组织病理切片制作耗时耗力[3],不仅破坏样本,而且标本易变形,难以保证切面测量位点的准确性[4],更无法测量三维(three-dimensional,3-D)体积,从而影响了评估的准确性。而骨密度的测定主要是通过X线片光密度法或各种骨密度仪,其所获得的数值虽能在一定程度上代表骨密度,但不能反映骨微结构的密度改变[5]。近年来高分辨率的微计算机断层扫描技术(Micro-CT)作为一种无损检测手段,因其图像三维重建功能可清晰显示骨组织的立体结构,并能通过精确测量各骨小梁参数而真实反映骨微结构的性质[6],近年来已逐渐在医学各领域中广泛用于对骨组织的评估。但是牙槽骨疏松多孔,当发生骨破坏时则呈现出非均一性,并且在影像学图像中,牙槽骨的密度与牙根组织的密度比较接近,计算机很难自动识别和分割;因此仅通过Micro-CT图像的常规分析难以准确三维定量分析牙槽骨的骨量,所以现大多数研究只限于进行定性诊断和两维定量评估。本研究运用数学形态学中的对偶运算,对Micro-CT图像进行腐蚀-膨胀(Erode-Dilate)处理,使之快速、准确将牙体组织与牙槽骨组织进行识别和无损性分割;然后再结合MedCAD模块中的球形(Sphere)三维分析法,定量分析小鼠第二磨牙(the second molar,M2)周围剩余骨量。
1 材料和方法
1.1 建立实验性牙周炎动物模型
取8周龄健康C57雌性小鼠(哈尔滨医科大学附属第四医院实验动物中心提供)20只,体质量(20±1)g,随机分为对照组和实验组(n=10)。实验组参照Lin[7]报道的方法,用5-0丝线结扎各小鼠的双侧上颌第二磨牙(the second molar,M2)牙颈部,并将丝线置于龈沟内建立实验性牙周炎动物模型;对照组不作任何处理,置于实验组同样饲养环境[温度(23±1)℃,相对湿度(60±5)%],12 h昼夜循环照明下进行饲养,自由进食、饮水。2周后实验性牙周炎动物模型建立成功,分别处死所有大鼠并取其上颌骨,用于进行Micro-CT扫描。
1.2 Micro-CT扫描
分别将各小鼠的上颌骨标本置于 Micro-CT系统的检测试管内,以空气为介质,应用分辨率为1 024×1 024 的 μCT40(Scanco Medical,瑞士)进行扫描。扫描时保持牙长轴与扫描平面垂直,扫描参数:360°旋转,管电压 70 kV,管电流 114 μA,整合时间300 ms,像素点尺寸12 μm ×12 μm,层间距12 μm。扫描结束后,通过三维重建获得 DICOM格式待分析图像。
1.3 Micro-CT图像分析方法
1.3.1 二维线性分析
调整所有图像使第一磨牙(M1)、第二磨牙(M2)、第三磨牙(M3)的釉牙骨质界(cementalenamelo junction,CEJ)与根尖孔(root apex,RA)处在同一矢状水平的二维(two-dimensional,2-D)切片上,然后应用Mimics 16.0软件进行2-D线性分析。通过线性分析(图1)分别测量出M1-M2或M2-M3之间 CEJ到牙槽骨嵴顶(alveolar bone crest,ABC)的距离,以及CEJ到RA之间的根长度(RLs,以mm为单位);然后按照表1中所列的公式1、2[8],计算出各自用以评估矢状面余留骨量的百分比。
1.3.2 三维体积分析
应用Mimics 16.0软件获取各组各动物包含牙槽骨及牙齿的Micro-CT图像,并在Micro-CT图像中分别测量各动物的M2根分叉到M1远中颊根RA的距离。然后再运用数学形态学的Erode-Dilate进行相关运算:①通过对图像进行Erode运算,以消除牙齿与牙槽骨图像的边界点,并使边界向内部收缩;②运用区域生长算法,将具有相似性的像素集合起来,从而选中牙齿图像;③先运用波尔运算获得Erode后的独立牙槽骨图像,然后再运用Dilate算法对牙槽骨图像进行膨胀处理使之恢复到原始像素水平,从而将牙齿图像(图2绿色部分)与牙槽骨图像(图2紫色部分)无损性的完全分离,并同时将牙齿图像进行3-D化而得到牙齿的3-D图像(图2青色部分)。上述计算结束后,用MedCAD模块中的球形(Sphere)确定ROI(图2):以先前计算得到的M2根分叉到M1远中颊根RA的距离(平均值)作为Sphere的半径r,并将Sphere的中心调整至M2的根分叉处;然后将2-D的Sphere 3-D化(图2红色部分),最后再将ROI及ROI内的牙槽骨图像进行3-D化,此时软件会自动生成ROI的总体积(Total volume,TV)、ROI内牙槽骨(图2蓝色部分)的骨小梁体积(Trabecular bone volume,BV)、骨表面积(Trabecular bone surface,BS);所得数据即可按表1中的公式3、4、5、6[9]分别计算出 ROI内牙槽骨的骨体积分数(Bone Volume Fraction,BVF)、骨小梁数目(Trabecular Number,Tb.N)、骨小梁厚度(Trabecular Thickness,Tb.Th)、骨小梁分离度(Trabecular Separation,Tb.Sp)等骨微参数(表2)。

表1 各种分析方法的计算公式
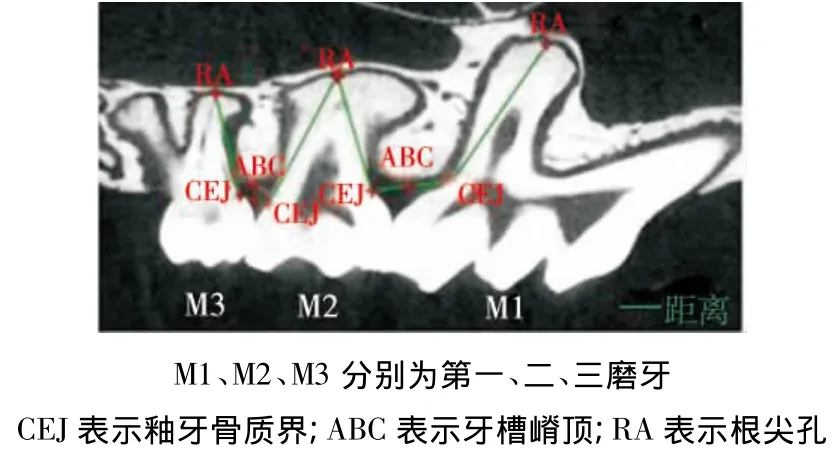
图1 Micro-CT图像2-D线性分析
1.4 统计学分析
用SPSS 21.0软件进行统计分析,两组间各相应数据()的比较用t检验,检验水准α=0.05。并同时对不同检测者采用两种方法分析的结果进行可靠性和可重复性的相关性分析,分别分析其组内、组间的相关系数(ICC)和变异系数(CV)。其中ICC值为0~1,越接近于1,可靠性越强;>0.75时,即表示具有良好的可靠性[10]。变异系数[CV(%)=SD/其平均值×100%]作为精度误差可描述测量的可重复性[11],从而能检验检测者的组内和组间变异。
2 结果
2-D线性分析结果显示,实验组牙槽骨余留量少于对照组(P<0.05)(图3)。
3-D体积分析结果显示,实验组的BV/TV、Tb.N、Tb.Th各骨微参数均小于对照组(P<0.05)(图4a~c);而Tb.Sp的分析结果则是实验组明显大于对照组(P<0.05)(图4d)。
对不同检测者采用两种方法分析的结果进行可靠性和可重复性分析显示,2-D分析方法时检测者的组内变异为:ICC值均>0.75、CV值均>1.5%;组间变异为:ICC值<0.75、CV值>1.5%,可靠性与可重复性相对较差;而采用3-D分析方法时检测者的组内变异和组间变异均为ICC值均>0.75、CV值均<1.5%,可靠性与可重复性均很好(表2)。
对同一检测者采用两种方法所需的检测时间进行统计分析显示,3-D分析方法所需的检测时间明显少于2-D分析方法(图5)。
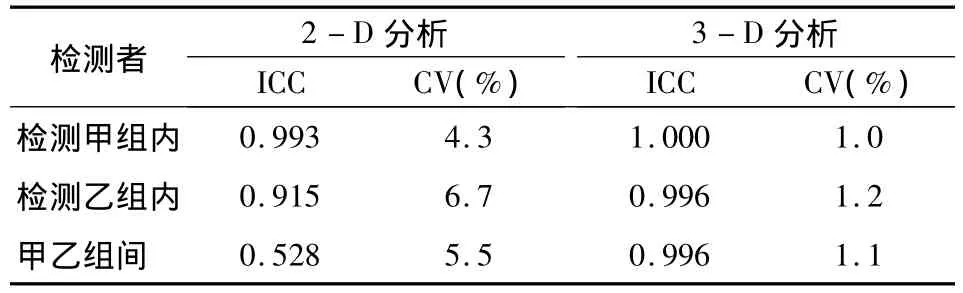
表2 检测者之间相关性检测
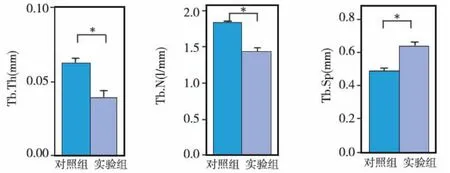
图4 3-D体积分析比较各组的骨微参数(*P<0.05)
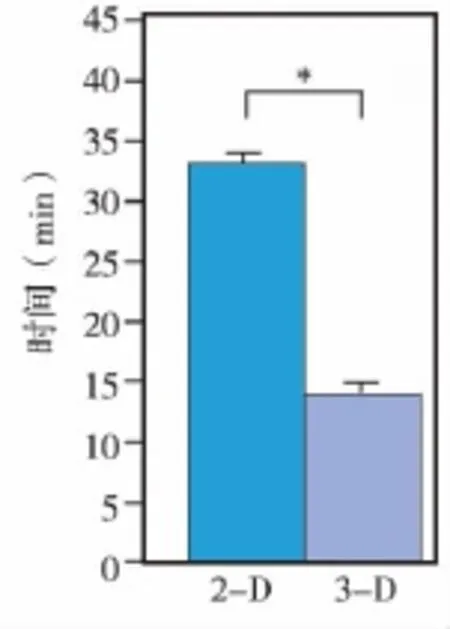
图5 2-D线性距离分析与3-D体积分析用时比较(*P<0.05)
3 讨论
牙周炎中牙槽骨的吸收呈现连续性的非均一性,作为其检测标准的组织病理切片因有时切不到牙槽骨吸收的位置,所以不能真正体现不规则的牙槽骨吸收情况,也不能实时的反映牙槽骨量的变化。而Micro-CT可以在不破坏样品的情况下,对骨骼、牙齿、生物材料等离体样本和活体小动物进行高分辨率(几十微米到亚微米级)的X射线成像,从而获得样品内部详尽的三维结构信息[12]。利用Micro-CT图像可检验的参数包括:BVF、Tb.Th、Tb.Sp、Tb.N 等[13],其中 BVF 是指矿化的骨组织所占总体积的比例;Tb.Th用来比较骨小梁的粗细程度;Tb.Sp可反映骨小梁之间间隙的宽窄水平;Tb.N可反映骨小梁连接的紧密度。以上这些参数均可在骨微结构上反映牙槽骨的变化。
有研究[14-20]表明,Micro-CT的2-D 形态学测量与传统的组织病理的骨形态计量学结果具有高度相关性,是一种可以取代普通组织病理切片的新方法[9],所以本实验选择2-D线性分析作为趋势对比。但是应用Micro-CT图像进行2-D分析的研究[21-26]无法观察牙槽骨在空间各个方向上的变化以及骨组织的微细结构,更无法评估骨组织三维体积的变化,显然会降低测量的准确度和敏感度。Micro-CT中对骨量的三维定量分析需要通过密度识别而准确分割目标组织,但是由于牙槽骨与牙根组织的密度在影像学图像上很接近,计算机不能准确的自动识别,从而限制了Micro-CT对牙槽骨定量分析的应用。虽然也有很多学者试图通过不同的标志点或者平面水平,选取各自不同的ROI对牙槽骨的Micro-CT图像进行了3-D分析[27-30],从而进行吸收量的评估,如密歇根大学的Park等通过手动的方法描绘Micro-CT各个2-D图像上的牙槽骨边界,从而达到牙槽骨与牙齿分离的效果,然后再进行3-D骨微参数的计算,并进行余留牙槽骨的三维定量评估[8]。但这些方法在分析和操作的过程均过于繁琐,实际应用价值不大。所以,怎样将牙根及其周围的牙槽骨进行有效的快速分离,始终是阻碍开展应用Micro-CT定量评估牙槽骨的瓶颈问题;另外在Mircro-CT图像上,以往研究也无理想的解剖定位标准,从而导致了数据结果的可靠性和可重复性较差,难以作多样本图像之间的准确比较,以上这些就是本研究着力解决的问题。
本研究中运用了数学形态学中的运算:腐蚀(Erode)和膨胀(Dilate),其基础是集合论,即在图像的处理中将其所有的像素点当作一个集合,然后通过结构元素来对图像进行探查,并对具有一定形态的结构元进行测量和提取图像中的对应形状,以达到对图像分析和识别的目的[31-32]。基于这一理论,运用Erode-Dilate运算可以优化图像数据、保持它们基本的形状特性、排除不相干的结构,并能实现对图像的边缘检测、特征提取和图像分割,从而达到准确、快速,且无损性的分离出牙齿与牙槽骨的目的。同时使用MedCAD模块中的Sphere,特异的选取了根分叉、根尖孔等解剖标志点作为定位点对ROI进行选取,使之包含全部的牙周病损部位。结果证实,该方法具有极高的可重复性,不仅实现了定位准确的目的,还更便于相关分析人员的辨认和操作。统计结果显示,Erode-Dilate结合MedCAD模块中的Sphere 3-D分析的结果与2-D分析比较趋势一致,并证实通过丝线结扎可导致小鼠的牙槽骨吸收。Erode-Dilate结合MedCAD模块中的Sphere 3-D分析的结果显示,实验组的余留牙槽骨量Tb.N、Tb.Th均较对照组明显降低,而Tb.Sp则较对照组明显升高。以上结果不仅从骨微结构上证明了实验组的牙槽骨密度明显降低,同时也表明了Erode-Dilate结合MedCAD模块中的Sphere 3-D分析法与2-D测量相比,在对牙槽骨吸收的评估中具有更高的灵敏性;并且该方法的离散程度小,灵敏度高,包含的骨评价指标更多,可靠性好。对两种分析方法所需的检测时间进行统计分析也表明,Erode-Dilate结合MedCAD模块中的Sphere 3-D分析法与2-D分析法相比,具有高效、省时的特点。
综上所述,Erode-Dilate结合MedCAD模块中的Sphere 3-D分析法可有效的评估牙槽骨量,是一种非常实用的Micro-CT图像分析方法,有望未来将其应用于临床进行实时动态的牙周炎诊断和疗效评估。
[1]Pihlstrom BL,Michalowicz BS,Johnson NW.Periodontal diseases[J].Lancet,2005,366(9499):1809-1820.
[2]Dalle Carbonare L,Valenti MT,Bertoldo F,et al.Bone microarchitecture evaluated by histomorphometry[J].Micron,2005,36(7-8):609-616.
[3]Gielkens PF,Schortinghuis J,de Jong JR,et al.A comparison of microCT,microradiography and histomorphometry in bone research[J].Arch Oral Biol,2008,53(6):558-566.
[4]González-Garcia R,Monje F.Is micro-computed tomography reliable to determine the microstructure of the maxillary alveolar bone?[J].Clin Oral Implants Res,2013,24(7):730-737.
[5]朱春风.骨密度影像学测量方法简介[J].山西医药杂志,2013,42(6):642-644.
[6]Liu SP,Liao EY,Chen J,et al.Effects of methylprednisolone on bone mineral density and microarchitecture of trabecular bones in rats with administration time and assessed by microcomputed tomography[J].Acta Radiol,2009,50(1):93-100.
[7]Lin J,Bi LJ,Yu X,et al.Porphyromonas gingivalis exacerbates ligature-induced,RANKL-dependent alveolar bone resorption via differential regulation of Toll-like receptor 2(TLR2)and TLR4[J].Infect Immun,2014 ,82(10):4127-4134.
[8]Park CH,Abramson ZR,Taba JM Jr,et al.Three-dimensional micro-computed tomographic imaging of alveolar bone in experimental bone loss or repair[J].J periodontol,2007,78(2):273-281.
[9]Hildebrand T,Laib A,Müller R,et al.Direct three-dimensional morphometric analysis of human cancellous bone:microstructural data from spine,femur,Iliac crest,and calcaneus[J].J Bone Miner Res,1999,14(7):1167-1174.
[10]Zhu F,Sarkar S,Kaitwatcharachai C,et al.Methods and reproducibility of measurement of resistivity in the calf using regional bioimpedance analysis[J].Blood Purif,2003,21(1):131-136.
[11]Kohler T,Beyeler M,Webster D,et al.Compartmental bone morphometry in the mouse femur:Reproducibility and resolution dependence of microtomographic measurements[J].Calcif Tissue Int,2005,77(5):281-290.
[12]David W,Holdsworth,Michael M,et al.Micro-CT in small animal and specimen imaging[J].Trends in Biotechnology,2002,20(8):S34-S39.
[13]Mary L Bouxsein,Stephen K Boyd,Blaine A Christiansen,et al.Guidelines for Assessment of Bone Microstructure in Rodents Using Micro-Computed Tomography[J].J Bone Miner Res,2010,25(7):1468-86.
[14]Bonnet N,Laroche N,Vico L,et al.Assessment of trabecular bone microarchitecture by two different X-ray microcomputed tomographs:a comparative study of the rat distal tibia using Skyscan and Scanco devices[J].Med Phys,2009,36(4):1286-1297.
[15]Waarsing JH,Day JS,Weinans H.An improved segmentation method for in vivo microCT imaging[J].J Bone Miner Res,2004,19(10):1640-1650.
[16]Kuhn JL,Goldstein SA,Feldkamp LA,et al.Evaluation of a microcomputed tomography system to study trabecular bone structure[J].J Orthop Res,1990,8(6):833-842.
[17]Müller R,Van Campenhout H,Van Damme B,et al.Morphometric analysis of human bone biopsies:a quantitative structural comparison of histological sections and micro-computed tomography[J].Bone,1998,23(1):59-66.
[18]Fanuscu MI,Chang TL.Three-dimensional morphometric analysis of human cadaver bone:microstructural data from maxilla and mandible[J].Clin Oral Implants Res,2004,15(2):213-218.
[19]Chappard D,Retailleau-Gaborit N,Legrand E,et al.Comparison insight bone measurements by histomorphometry and microCT[J].J Bone Miner Res,2005,20(7):1177-1184.
[20]Akhter MP,Lappe JM,Davies KM,et al.Transmenopausal changes in the trabecular bone structure[J].Bone,2007,41(1):111-116.
[21]Lu SH,Huang RY,Chou TC.Magnolol ameliorates ligature-induced periodontitis in rats and osteoclastogenesis:in vivo and in vitro study[J].Evid Based Complement Alternat Med,2013:634095.
[22]Sartori R,Li F,Kirkwood KL.MAP kinase phosphatase-1 protects against inflammatory bone loss[J].J Dent Res,2009,88(12):1125-1130.
[23]Aghaloo TL,Kang B,Sung EC,et al.Periodontal disease and bisphosphonates induce osteonecrosis of the jaws in the rat[J].J Bone Miner Res,2011,26(8):1871-1882.
[24]Suda N,Moriyama K,Ganburged G.Effect of Angiotensin II receptor blocker on experimental periodontitis in a mouse model of Marfan syndrome[J].Infect Immun,2013,81(1):182-188.
[25]Wilensky A,Gabet Y,Yumoto H,et al.Three-dimensional quantification of alveolar bone loss in Porphyromonas gingivalisinfected mice using micro-computed tomography[J].J Periodontol,2005,76(8):1282-1286.
[26]Tokunaga K,Seto H,Ohba H,et al.Topical and intermittent application of parathyroid hormone recovers alveolar bone loss in rat experimental periodontitis[J].J Periodontal Res,2011,46(6):655-662.
[27]Guimarães MR,Coimbra LS,de Aquino SG,et al.Potent antiinflammatory effects of systemically administered curcumin modulate periodontal disease in vivo[J].J Periodontal Res,2011,46(2):269-279.
[28]Trombetta-Esilva J,Yu H,Arias DN,et al.LPS induces greater bone and PDL loss in SPARC-null mice[J].J Dent Res,2011,90(4):477-482.
[29]Bak EJ,Park HG,Kim M,et al.The effect of metformin on alveolar bone in ligature-induced periodontitis in rats:A pilot study[J].J Periodontol,2010,81(3):412-419.
[30]Wilensky A,Gabet Y,Yumoto H,et al.Three-dimensional quantification of alveolar bone loss in Porphyromonas gingivalisinfected mice using micro-computed tomography[J].J Periodontol,2005,76(8):1282-1286.
[31]潘建平,李治.基于遥感分类与数学形态学的道路信息提取[J].计算机工程与应用,2010,46(34):213-214,227.
[32]肖大雪.浅析数学形态学在图像处理中的应用[J].科技广场,2013,5:10-19.
