重复经颅磁刺激对抑郁模型大鼠学习记忆功能及海马CA3区突触素表达的影响*
2015-09-18欧阳华任慧聪张朝辉
欧阳华,白 冰,赵 琳,任慧聪,张朝辉#
1)新乡医学院第二附属医院心身疾病二科新乡453002 2)新密市第一人民医院神经内科新密452370
(2014-11-20收稿 责任编辑 王 曼)
海马突触的可塑性变化在抑郁症的发病和治疗方面有着至关重要的地位。研究[1]表明抑郁症与一些脑区的功能和结构的可塑性损伤有关,尤其是海马区。抑郁症与突触的萎缩及突触联系的减少有关联,而且这些神经性改变是抑郁症患者与海马相关的认知缺损的基础[2]。大量研究[3-4]表明,海马与学习记忆(特别是空间认知功能)有关,CA3区被认为与空间辨别性学习记忆活动的关系尤为密切,如CA3区损伤可导致学习及记忆功能障碍。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是在经颅磁刺激基础上发展起来的一项新型神经电生理技术[5]。近年来国内外研究[6-7]均表明rTMS在一定程度上能够改善抑郁症患者的认知功能障碍,但是其确切机制尚不完全明确。突触素(synaptophysin,SYP)是突触前区中重要的囊泡蛋白之一,对于突触的形成和分泌是必需的。其表达可间接反映突触的数量、密度和分布情况,是突触可塑性的重要标志之一[8]。该研究通过给予抑郁模型大鼠rTMS,观察大鼠学习记忆功能、海马CA3区SYP的表达水平的变化,探讨rTMS对抑郁大鼠学习记忆功能的影响及其可能的突触可塑性机制。
1 材料与方法
1.1 实验动物 通过频数表和箱式图来判断个体的行为学分数,按照统计学对离群数据的处理方法,筛选出评分均一、同质性较高的雄性SD大鼠(SPF级)40只,体重200~250 g,6~8周龄,由河南省实验动物中心提供,许可证号:SCXK(豫)2010-0002,质量合格证号:1009570。
1.2 实验分组及处理方法 利用随机数字表法将大鼠随机分为4组:rTMS组、伪刺激组、抑郁组及对照组,每组10只。除对照组外,其余3组大鼠均参考文献[9]采用孤养结合慢性不可预见轻度应激制备抑郁模型并进行模型评估。接受建模处理的大鼠孤养在独立的笼内,在21 d内接受不同的应激,应激包括禁食24 h、禁水24 h、40℃高温5 min、足底电刺激5 min、夹尾2 min、潮湿垫料24 h、昼夜颠倒24 h,7种应激随机安排,1种/d,每种应激出现3次,同种应激不能连续出现,使动物不能预料应激的发生。采用蔗糖水消耗实验及旷场实验进行模型评估。rTMS组大鼠在造模成功后24 h行rTMS治疗。采用武汉依瑞德公司生产的CCY-Ⅰ型磁刺激仪及环形动物线圈,线圈直径约70 mm。刺激时固定大鼠头部,线圈紧贴头皮,与大鼠左侧半球相切,线圈中心与大鼠额顶叶皮质体表投影区中心重合,刺激频率15 Hz,刺激量在100%MT,每天20串,每串80个脉冲,间歇10 s,共1 600次脉冲,连续5 d为1个疗程,疗程间隔2 d,共3个疗程。伪刺激组置于相同的环境,线圈不通电,即无电流脉冲,只施予同样次数的声音刺激。
1.3 学习记忆功能的检测 rTMS干预后,采用Morris水迷宫测试大鼠的学习记忆功能。参照Brightwell等[10]的方法,并结合课题做了部分改动。测试程序主要包括定位航行和空间探索实验两个部分。①定位航行实验:连续训练4 d,2次/d,间隔8 h,每个训练时段4次,分别从四个象限入水点将大鼠面向池壁放入水中,记录大鼠在水中寻找并爬上平台的时间(即逃避潜伏期),停留2 s为找到平台。如果大鼠在90 s内找不到平台,将其引导至平台,并在上面停留30 s,此时的逃避潜伏期记录为90 s。以4 d内的平均值作为学习成绩。②空间探索实验:于rTMS干预后第5天撤去平台,于第一象限入水点将大鼠面向池壁放入水中,记录其在2 min内的运动轨迹,分析其在原平台象限游泳时间及在原平台象限游泳路程占总游泳路程的百分比,将其作为大鼠的记忆成绩。
1.4 海马SYP蛋白表达的检测 在水迷宫测试结束后1 d内,各组随机选取6只大鼠,麻醉后多聚甲醛灌流内固定,切取视交叉后4 mm处至小脑前的脑组织,置于多聚甲醛溶液中4℃过夜,再于蔗糖水溶液中4℃梯度脱水,最后用OCT组织包埋剂将整个大脑包埋成形,于-70℃保存备用。SYP蛋白表达的检测采用免疫组织化学SABC法。一抗SYP及生物素标记的二抗均购自武汉博士德生物工程有限公司。DAB显色,以PBS液代替一抗作为阴性对照。采用Leica Application Suite图像采集系统,在400倍视野下对海马 CA3区拍照,并用Image-Pro Plus图像分析软件测定每张图片中阳性染色区域的平均光密度值,取同一只大鼠6张图片的平均值表示海马SYP蛋白的表达水平。
1.5 统计学处理 采用SPSS 20.0进行统计学分析。4组学习成绩、记忆成绩、海马SYP蛋白表达水平的比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准 α =0.05。
2 结果
2.1 4组大鼠水迷宫测试结果 见表1。在定位航行实验中,与对照组相比,rTMS组、伪刺激组、抑郁组的逃避潜伏期均延长,但rTMS组短于伪刺激组、抑郁组。在空间探索实验中,4组大鼠的运动模式明显不同。对照组大鼠探究能力更强、活动范围更广,均能快速地找到并爬上平台;而抑郁组和伪刺激组大鼠活动范围小,主要沿水迷宫周边游动,较少向内探索,找到平台的时间较长,在原平台象限游泳时间缩短,在原平台象限游泳路程占总路程的百分比减小;rTMS组较抑郁组和伪刺激组大鼠明显改善,在原平台象限游泳时间及原平台象限游泳路程占总路程的百分比较伪刺激组、抑郁组明显延长和增大。
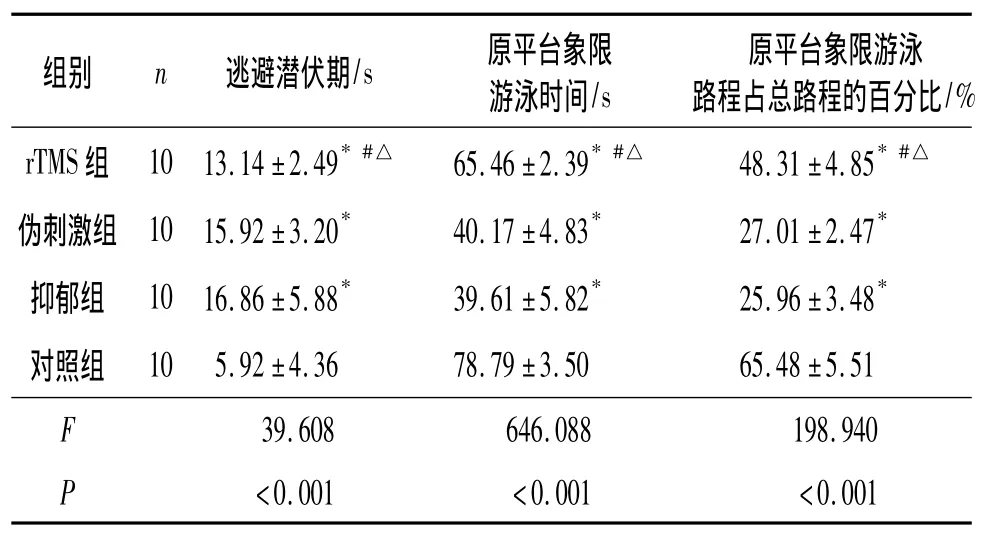
表1 4组大鼠水迷宫测试结果的比较
2.2 4组大鼠海马SYP蛋白表达水平的比较 见图1、表2。海马CA3区SYP免疫反应阳性产物呈板层样分布于辐射层和始层的神经毡内,呈棕黄色点状或颗粒状,颗粒的大小与突触类型及免疫反应强弱有关。与对照组比较,抑郁组、伪刺激组CA3区SYP蛋白表达水平降低;与抑郁组、伪刺激组比较,rTMS组CA3区SYP蛋白表达水平升高,达对照组水平。
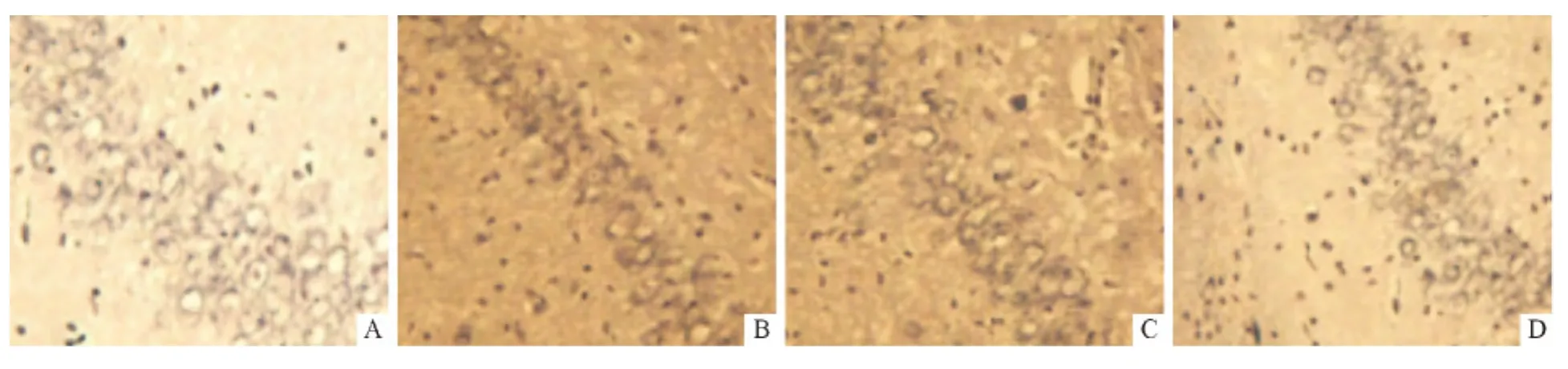
图1 大鼠海马CA3区SYP的表达(SABC,×400)A:对照组;B:抑郁组;C:伪刺激组;D:rTMS组。

表2 4组大鼠海马CA3区SYP蛋白的表达
3 讨论
rTMS的高场强磁脉冲信号可以连续不断地透过颅骨,直接作用于大脑单侧某一特定的皮质部位,从而改善及调节脑功能[6]。该技术已在神经、心理、精神等各个研究领域被广泛应用。研究[7]表明rTMS干预不会进一步恶化抑郁症患者的认知功能,反而可以提高患者的工作执行能力及客观记忆力。既往Ahmed等[11]研究发现15 Hz的rTMS可以改善大鼠在新事物识别方面的能力。Tan等[12]发现1 Hz为期3周的rTMS治疗可增进抑郁大鼠的空间参考记忆功能。该研究发现,rTMS干预能显著改善抑郁大鼠学习记忆功能,与既往文献报道结果一致。
SYP存在于突触囊泡终端神经鞘,构成突触囊泡特异性膜通道,被认为对突触的可塑性是必需的[13]。该研究结果显示,抑郁组大鼠海马SYP蛋白表达水平较对照组降低,提示抑郁组大鼠海马神经元突触数量减少,其可塑性受到影响。Kim等[14]研究表明慢性应激可引起大鼠大脑结构和功能的改变,尤其可导致海马CA3区锥体神经元树突的萎缩,表现为大鼠海马区 SYP 表达下调[15]。研究[16]显示大鼠海马神经元缺血后变性坏死,学习和记忆功能下降,SYP阳性产物表达水平也明显降低,提示SYP与学习记忆关系密切。宿宝贵等[17]研究发现,经Morris水迷宫测试训练后大鼠空间辨别性学习记忆功能明显增强,SYP蛋白的表达水平明显增加,说明空间辨识性学习记忆活动可引起突触的形态可塑性变化,SYP表达与学习记忆功能有直接关系。Sze等[18]研究表明,SYP蛋白的缺失与阿尔兹海默病认知功能的减退密切相关。该研究结果表明,对抑郁模型大鼠进行高频rTMS治疗后,大鼠的学习记忆功能明显改善,同时海马CA3区SYP蛋白表达水平上调,提示rTMS干预可改善抑郁大鼠学习记忆功能障碍,该作用可能与海马CA3区SYP的表达改变有关。
rTMS对抑郁症认知功能障碍的治疗效果虽然显著,但还有许多问题亟待解决。海马的学习记忆功能是通过海马神经环路实现的,该研究只对其中一部分进行了研究,因此,今后可运用电生理技术进一步探讨rTMS改善认知功能障碍的作用机制,并深入探索rTMS独特的作用机制和引起的生物学效应及分子水平的变化。
[1] Neumeister A,Wood S,Bonne O,et al.Reduced hippocampal volume in unmedicated,remitted patients with major depression versus control subjects[J].Biol Psychiatry,2005,57(8):935
[2] Kohen R,Dobra A,Tracy JH,et al.Transcriptome profiling of human hippocampus dentate gyrus granule cells in mental illness[J].Transl Psychiatry,2014,4(4):e366
[3] Amador-Arjona A,Elliott J,Miller A,et al.Primary cilia regulate proliferation of amplifying progenitors in adult hippocampus:implications for learning and memory[J].J Neurosci,2011,31(27):9933
[4] Forcelli PA,Palchik G,Leath T,et al.Memory loss in a nonnavigational spatial task after hippocampal inactivation in monkeys[J].Proc Natl Acad Sci USA,2014,111(11):4315
[5] George MS,Post RM.Daily left prefrontal repetitive transcranial magnetic stimulation for acute treatment of medication-resistant depression[J].Am J Psychiatry,2011,168(4):356
[6] Rossi S,Hallett M,Rossini PM,et al.Safety,ethical considerations,and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research[J].Clin Neurophysiol,2009,120(12):2008
[7] Aleman A.Use of repetitive transcranial magnetic stimulation for treatment in psychiatry[J].Clin Psychopharmacol Neurosci,2013,11(2):53
[8] Evans GJ,Cousin MA.Tyrosine phosphorylation of synaptophysin in synaptic vesicle recycling[J].Biochem Soc Trans,2005,33(Pt 6):1350
[9] Willner P,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic unpredictable mild stress,and its restoration by a tricyclic antidepressant[J].Psychopharmacology(Berl),1987,93(3):358
[10]Brightwell JJ,Gallagher M,Colombo PJ.Hippocampal CREB1 but not CREB2 is decreased in aged rats with spatial memory impairments[J].Neurobiol Learn Mem,2004,81(1):19
[11]Ahmed Z,Wieraszko A.Modulation of learning and hippocampal,neuronal plasticity by repetitive transcranial magnetic stimulation(rTMS)[J].Bioelectromagnetics,2006,27(4):288
[12]Tan T,Xie J,Liu T,et al.Low-frequency(1 Hz)repetitive transcranial magnetic stimulation(rTMS)reverses Aβ(1-42)-mediated memory deficits in rats[J].Exp Gerontol,2013,48(8):786
[13]Lin JY,Peng B,Yang ZW,et al.Number of synapses increased in the rat spinal dorsal Horn after sciatic nerve transection:a stereological study[J].Brain Res Bull,2011,84(6):430
[14]Kim JJ,Diamond DM.The stressed hippocampus,synaptic plasticity and lost memories[J].Nat Rev Neurosci,2002,3(6):453
[15]Thome J,Pesold B,Baader M,et al.Stress differentially regulates synaptophysin and synaptotagmin expression in hippocampus[J].Boil Psychiatry,2001,50(10):809
[16]Schmitt U,Tanimoto N,Seeliger M,et al.Detection of behavioral alterations and learning deficits in mice lacking synaptophysin[J].Neuroscience,2009,162(2):234
[17]宿宝贵,潘三强,韩辉,等.大鼠海马结构在空间辨别性学习记忆时突触素表达的变化[J].中国病理生理杂志,2000,16(5):421
[18]Sze CI,Troncoso JC,Kawas C,et al.Loss of the presynaptic vesicle protein synaptophysin in hippocampus correlates with cognitive decline in Alzheimer disease[J].J Neuropathol Exp Neurol,1997,56(8):933
