TEKT3在特发性弱精子症患者精子中的表达*
2015-09-18李玉山陈河涛杨夕阳王全先刘军杰王琳凯苏彦华
李玉山,陈河涛,杨夕阳,王全先,刘军杰,王琳凯,苏彦华,孙 琳
郑州大学第三附属医院人类精子库郑州450052
(2015-01-24收稿 责任编辑 王 曼)
不孕不育是全球性的生殖健康难题,影响了全世界约15%的夫妇[1]。75%的不育患者原因不明,属于特发性[2]。临床研究[3]表明,超过80%的不育患者存在精子运动缺陷,其中19%为特发性弱精子症。弱精子症发病机制多种多样,其中引起精子活力低下的常见原因有精液液化异常、精索静脉曲张、自身免疫因素、吸烟、饮酒等。为进一步阐明弱精子症的发病机制,作者所在课题组前期进行了一系列基因水平的相关研究。目前已有超过300个精子相关基因被证实与不孕不育发病有关,如精子鞭毛基因 sept4[4]、tcte3[5]和 catsper1[6]。Tektins(简 称TEKT)是一个富含coiled-coil结构域的微管蛋白家族,结构高度保守,目前包含TEKT1~5等5个家族成员,是精子鞭毛轴丝及其附属结构的重要组成部分[7]。TEKT3定位于精子线粒体膜表面和鞭毛中段外周致密纤维[8]。tekt3基因敲除小鼠精子前向运动能力显著降低且精子尾部结构缺陷增加,表明TEKT3的表达缺失可能引起精子运动能力降低,进而导致弱精子症的发生[9]。刘利敏[10]通过构建mRNA差异表达谱,发现弱精子症精子TEKT3 mRNA表达水平下调。然而目前尚缺少TEKT3在人类弱精子症患者精子中表达的研究。该研究采用RTPCR和Western blot方法,检测TEKT3 mRNA和蛋白在正常男性和特发性弱精子症患者精子中的表达水平,探讨特发性弱精子症的发生机制,为深入了解特发性弱精子症提供理论基础。
1 对象与方法
1.1 研究对象 收集2014年6月至10月就诊于郑州大学第三附属医院生殖中心男科门诊的35例弱精子症患者(年龄23~39岁)和35份同期河南省人类精子库健康体检合格供精者(年龄20~40岁)的精液标本。研究对象符合以下标准:①无传染病史。②无性功能障碍,无精索静脉曲张、附睾炎。③无家族遗传病史。④肝肾功能正常,内分泌各项激素检查正常。⑤排除少精子症、无精子症、畸形精子症患者。该研究获得郑州大学第三附属医院伦理委员会批准,所有研究对象签订知情同意书。
1.2 精液检测 受试者禁欲3~7 d,采用手淫方式收集精液于广口干燥无菌取精杯中,精液经37℃水浴30 min液化完全。严格按照第五版《WHO人类精液检查与处理实验室手册》进行分析,排除精液量、液化时间、pH、酸性磷酸酶、精浆果糖、α葡萄糖苷酶、精子形态等参数异常的精液样本。精液标本涂片后自然干燥,95%乙醇和乙醚固定10 min,光学显微镜下选择涂片上多个区域进行精子形态评估,每片计数200个精子,计算正常形态精子百分率。计算机辅助精液分析系统(北京伟力新世纪科技发展有限公司)连续3次检测结果显示,正常对照组精子浓度均≥20×106mL-1,精子前向运动能力≥32%;弱精子症组精子浓度均≥20×106mL-1,精子前向运动能力≤32%。
1.3 精子的分离 采用完全液化的精液标本经45%和90%Percoll分离液(美国Pharmacia公司)非连续密度梯度离心法分离精子。在15 mL离心管中加入体积比为1∶1的45%和90%Percoll分离液,随后加入相同体积的精液标本,600 g条件下离心20 min。收集底部部分精子,用0.01 mol/L PBS(pH 7.4)洗涤 3次,将精子浓度调整为 50 ×106mL-1,-80℃保存。采用改良巴氏染色法观察精子形态。
1.4 精子中TEKT3 mRNA的RT-PCR检测 严格按照RNA提取试剂盒(北京康为世纪公司)操作说明书提取分离纯化精子的总RNA,按照反转录试剂盒(美国Thermo公司)操作说明,每样本取等量总RNA 10μL进行反转录,合成cDNA,取cDNA 3 μL作为模板,按照PCR试剂盒(TaKaRa公司)操作说明在25μL反应体系中进行扩增。引物用Primer Premier 5.0软件设计,由北京鼎国生物公司合成。TEKT3上游引物序列为5'-CTCAGGCAGACACAAC CCAA-3',下 游 为 5'-GATCCGGTAAGCCGTCTGTT-3',产物 389 bp;内参上游引物序列为 5'-CGG GAAATCGTGCGTGAC-3',下 游 为 5'-TGGAAGGTG GACAGCGAGG-3',产物434 bp。PCR产物经10 g/L琼脂糖凝胶电泳,图像扫描仪扫描,用Image J软件进行分析。
1.5 精子中TEKT3蛋白的Western blot检测取分离纯化后的精子,37℃水浴解冻,加入一定量4℃预冷的0.01 mol/L PBS(pH 7.4),4 ℃ 3 000 g 离心5 min,弃去上清,在离心管中加入100μL细胞裂解液RIPA和1μL蛋白酶抑制剂PMSF(北京索莱宝科技有限公司),充分吹打,冰上裂解30 min,进一步超声裂解10 s×5次,低温高速离心机4℃12 000 g离心10 min,吸取上清液(即精子总蛋白),采用BCA蛋白浓度测定试剂盒(上海BestBio公司)检测总蛋白浓度。取30μg等量总蛋白上样,100 g/L SDS-PAGE凝胶电泳(80 V 30 min,120 V 120 min),半干法(20 V 120 min)转移至醋酸纤维素膜,用含50 g/L脱脂奶粉的TBST室温封闭1 h,3次洗涤后与1∶600稀释的一抗(鼠抗人TEKT3抗体,台湾Abnova公司)37℃孵育1 h,TBST洗膜5次,10 min/次;再用1∶2 500稀释的辣根过氧化物酶标记的二抗(兔抗鼠IgG,北京鼎国生物公司)室温孵育1 h,然后TBST洗涤3~5次,5 min/次。以β-actin为内参。处理后的醋酸纤维素膜经Odyssey Clx双红外荧光成像系统(美国LI-COR公司)扫描,用Image Studio软件获取图像并进行处理。
1.6 统计学处理 应用SPSS 17.0进行分析。两组精液基本参数、TEKT3 mRNA和蛋白表达水平的比较采用两独立样本t检验,采用Pearson相关系数来描述TEKT3表达与前向运动精子率的相关性。检验水准 α=0.05。
2 结果
2.1 两组精液基本参数的比较 正常对照组与弱精子症组年龄和精液量、pH值、精子浓度等参数比较,差异均无统计学意义,但弱精子症组前向运动精子率低于正常对照组。见表1。
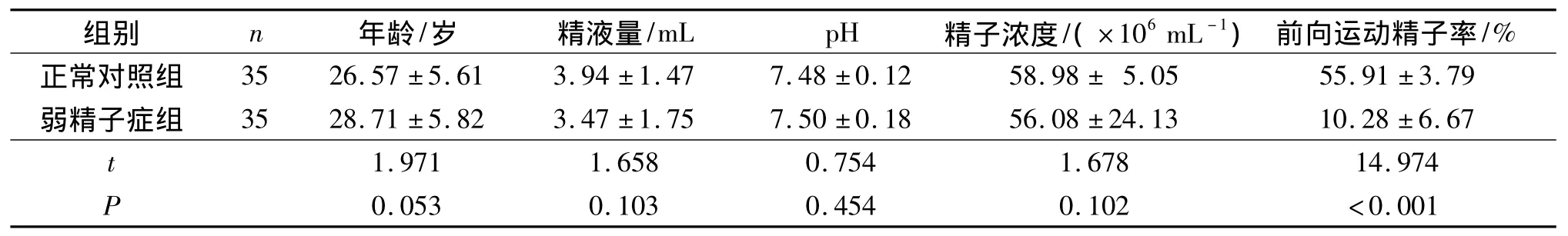
表1 两组精液基本参数的比较
2.2 正常对照组与弱精子症组精子形态学比较见图1。正常对照组正常形态精子百分率为(25.42±5.26)%;弱精子症患者精子形态发生变化,精子尾部畸形、缺陷增加,其正常形态精子百分率为(7.21 ±2.45)%,低于正常对照组(t=18.528,P <0.001)。

图1 正常对照组(A)与弱精子症组(B)精子形态学表现(×400)
2.3 正常对照组和弱精子症组TEKT3 mRNA和蛋白表达的比较 与正常对照组比较,弱精子症组TEKT3 mRNA和蛋白的表达均降低,见图2、3和表2。

图2 正常对照组和弱精子症组TEKT3 mRNA的RT-PCR检测M:Marker;A1、A2、A3:弱精子症组;N1、N2:正常对照组。
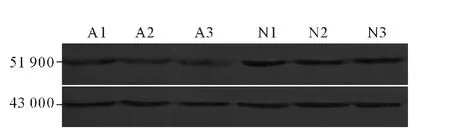
图3 正常对照组和弱精子症组TEKT3蛋白的Western blot检测A1、A2、A3:弱精子症组;N1、N2、N3:正常对照组。
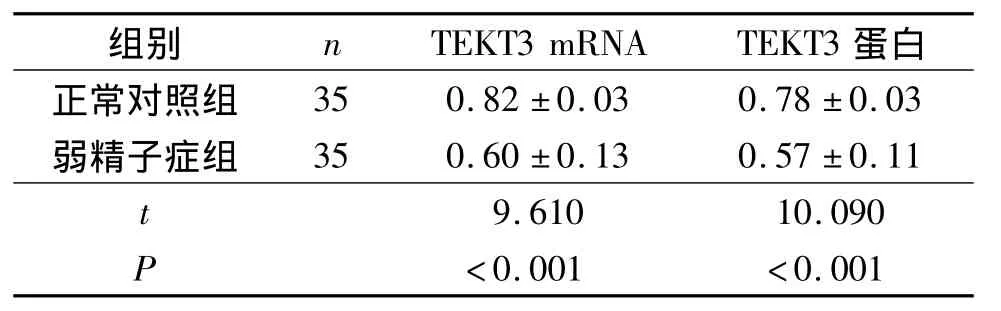
表2 两组精子中TEKT3表达的比较
2.4 前向运动精子率与TEKT3 mRNA和蛋白表达的相关性分析 经Pearson相关性分析,弱精子症组前向运动精子率与精子TEKT3 mRNA表达水平(r=0.684,P=0.001)和 TEKT3 蛋白表达水平(r=0.483,P=0.013)均具有相关性。
3 讨论
弱精子症是引起男性不育的常见原因,其中精索静脉曲张、睾丸炎、隐睾、附属性腺感染等是弱精子症常见的病因,然而多数的弱精子症并不能明确其病因,被称为特发性弱精子症,特发性弱精子症显著的特征为精子活动力低下。
TEKT是精子鞭毛轴丝中与微管相关的蛋白家族[7],最早发现于海胆精子鞭毛中[11],哺乳动物中共有5种。TEKT3是TEKT家族中的一员,研究[8]表明从附睾尾部抽取的精子TEKT3可抵抗S-EDTA溶液的抽提,因此认为其存在于纤毛轴丝周围。免疫荧光显微技术和免疫电镜结果显示TEKT3主要存在于线粒体与中段外周致密纤维表面,此外还存在于精子头部赤道段,由此推断TEKT3不仅可作为精子鞭毛一部分参与鞭毛的稳定性,与精子活力相关,还参与了精卵结合和顶体反应[12]。Roy 等[12]发现敲除小鼠tekt3基因后,小鼠产生的精子尾部缺陷率增加,精子活力显著降低,但小鼠仍能够繁殖后代,因此推测,tekt3基因敲除后小鼠产生的尾部缺陷精子仍具有完整的超活化能力。
人类tekt3基因位于17号染色体的短臂,包含9个外显子,编码含有490个氨基酸、相对分子质量为53 900的蛋白。成年雄性小鼠tekt3基因编码一个1 700 bp的转录本。小鼠与人类的TEKT3有83.5%的同源序列,包括一个在所有TEKT家族中都含有的九肽结构[11]。纤毛蛋白质学研究[7]表明TEKT3与TEKT1、TEKT2可能是轴丝9+2结构的一部分,而TEKT5与TEKT3具有高度的相似性。
精子前向运动能力是精子与卵子结合形成受精卵的重要保障。哺乳动物精子的前向运动主要是靠尾部鞭毛摆动,而外周致密纤维和纤维鞘这两种细胞骨架是精子尾部鞭毛摆动的主要物质基础,精子尾部形态和结构的异常可引起精子运动障碍和精子活力的改变。该研究结果显示,TEKT3 mRNA和蛋白在正常对照组和特发性弱精子症组精子中均表达,但特发性弱精子症组精子TEKT3 mRNA和蛋白的表达水平较正常对照组明显降低,并且前向运动精子率与TEKT3 mRNA和蛋白的表达均呈正相关;表明TEKT3是影响精子活力的重要因素,TEKT3的表达降低可能引起精子鞭毛的缺陷增加和稳定性降低,影响精子前向运动能力,从而导致男性不育。
TEKT家族蛋白表达具有高度相似性,敲除tekt4基因的雄性小鼠产生的精子能量利用低效甚至无效,而同时敲除TEKT3基因和TEKT4基因的雄性子鼠的精子既有结构的缺陷又有能量利用的低效,双重作用导致生育率的降低,然而仍能繁殖后代,表明TEKT家族其他的成员如TEKT1、TEKT2、TEKT5可能在功能上弥补了TEKT3和TEKT4双重缺失所导致的缺陷[13]。因此同时检测TEKT家族在精子中的表达,可能为阐明其在特发性弱精子症中的作用机制提供更明确的指导。
综上所述,TEKT3的表达水平与弱精子症精子前向运动能力呈正相关,提示TEKT3可能成为弱精子症发病机制研究的一个重要的靶标,TEKT3表达水平下降的机制及其与TEKT家族成员的相互作用值得进一步深入研究。
[1] Feng HL.Molecular biology of male infertility[J].Arch Androl,2003,49(1):19
[2] Okada H,Tajima A,Shichiri K,et al.Genome-wide expression of azoospermia testes demonstrates a specific profile and implicates ART3 in genetic susceptibility[J].PLoS Genet,2008,4(2):e26
[3] Curi SM,Ariagno JI,Chenlo PH,et al.Asthenozoospermia:analysis of a large population[J].Arch Androl,2003,49(5):343
[4]李玉山,冯晓霞,吉晓菲,等.SEPT4蛋白在特发性弱精子症患者精子中的表达[J].中华男科学杂志,2011(8):699
[5]李玉山,吉晓菲,王全先,等.特发性弱精子症患者精子中TCTE3的表达[J].郑州大学学报:医学版,2014,49(1):83
[6]武文斌,李玉山,冯晓霞,等.CATSPER1蛋白与特发性弱精子症关系的研究[J].中华男科学杂志,2011,17(2):110
[7] Murayama E,Yamamoto E,Kaneko T,et al.Tektin5,a new Tektin family member,is a component of the middle piece of flagella in rat spermatozoa[J].Mol Reprod Dev,2008,75(4):650
[8] Takiguchi H,Murayama E,Kaneko T,et al.Characterization and subcellular localization of Tektin 3 in rat spermatozoa[J].Mol Reprod Dev,2011,78(8):611
[9] Roy A,Lin YN,Agno JE,et al.Tektin 3 is required for progressive sperm motility in mice[J].Mol Reprod Dev,2009,76(5):453
[10]刘利敏.弱精症精子mRNA和miRNA差异表达谱的构建与分析[D].汕头:汕头大学,2009.
[11]Ogino K,Tsuneki K,Furuya H.The expression of tubulin and tektin genes in dicyemid mesozoans(Phylum:Dicyemida)[J].JParasitol,2007,93(3):608
[12]Roy A,Yan W,Burns KH,et al.Tektin3 encodes an evolutionarily conserved putative testicular microtubules-related protein expressed preferentially in male germ cells[J].Mol Reprod Dev,2004,67(3):295
[13]Iida H,Honda Y,Matsuyama T,et al.Tektin 4 is located on outer dense fibers,not associated with axonemal tubulins of flagella in rodent spermatozoa[J].Mol Reprod Dev,2006,73(7):929
