老年糖尿病肾病肾内动脉阻力指数异常与颈动脉粥样硬化的相关性
2015-09-12暨南大学附属第一医院内分泌及代谢科室广东广州510630
周 颖 冯 烈 (暨南大学附属第一医院内分泌及代谢科室,广东 广州 510630)
糖尿病引发血管病变是导致糖尿病患者致残、致死的重要原因,糖尿病肾病(DN)患者血管硬化等病变更为常见〔1〕。既往研究显示,DN患者的肾功能以及预后与患者肾内动脉阻力指数(RI)存在密切关系,且DN患者出现肾小球硬化症与患者全身大血管的动脉粥样硬化病变存在密切相关〔2〕。本研究采用彩色多普勒超声探究DN患者肾内动脉RI的异常改变与颈动脉粥样硬化之间的关系。
1 资料与方法
1.1 一般资料 选取我院于2013年9月至2014年9月入院治疗的2型糖尿病(T2DM)DN患者116例,均符合《中国2型糖尿病防治指南(2010年版)》诊断标准并合并肾病,年龄50~80岁;排除合并肾移植、肾动脉狭窄术、肾小球肾炎等其他原因导致慢性肾功能损伤患者。根据肾小球滤过率(eGFR)将所有患者分为三组:eGFR <60 ml·min-1·1.73 m-2为 A 组(40例),男22 例,女18 例,年龄(59.11±6.12)岁;60 ml·min-1·1.73 m-2≤eGFR <90 ml·min-1·1.73 m-2为 B 组(35 例),男19例,女 15例,年龄(57.34±6.81)岁;eGFR≥90 ml·min-1·1.73 m-2为 C 组(41例),男 23例,女 18例,年龄(58.27±7.14)岁。eGFR的计算采用适用于中国患者的修改后的肾脏病膳食改良试验公式(MDRD),男性:eGFR=186×(SCr×0.011)-1.154×年龄 -0203×1.233,女性:eGFR=186×(SCr×0.011)-1.154×年龄 -0203×1.233×0.742,血肌酐(SCr)单位为μmol/L。并选择同期在我院进行健康体检者40例作为对照组D组,均为无糖尿病、高血压及肝肾功能等疾病,无代谢病及内分泌病史,其 eGFR为(125.42±8.13)ml·min-1·1.73 m-2,男、女各 20 例,年龄(59.21±6.34)岁。四组研究对象性别、年龄构成均统计学差异(P>0.05)。
1.2 检测方法
1.2.1 肾内动脉RI的测量 使用西门子AcusonSequoia512彩色多普勒超声诊断仪进行检查,频率2~5 MHz,4C1凸阵探头,检测肾叶间动脉。患者取仰卧位,嘱屏住呼吸,取肾脏矢状切面,在近肾锥体处段间动脉放置频谱多普勒取样线,调整取样线的角度,分别取双肾上中下共六点测量部位进行检测,取平均值。
1.2.2 颈动脉内膜中层厚度(IMT)的测量 患者取仰卧位,二维纵切面扫查,在颈总动脉远端及颈内、外动脉近端距分叉处近端和远端处1~1.5 cm处测量血管内径及颈内动脉的IMT。在左右两侧取六点进行测量,取平均值进行分析。采取相应的方法,获得患者颈动脉血管重构指标,包括血管的重构类型(无重构、负性重构或正性重构)和发生血管重构率。所有操作均按照我院标准,由操作员完成。
1.3 统计学方法 应用SPSS13.0软件,两变量间比较采用独立样本t检验,多变量组间比较采用方差分析,组内两两比较采用LSD法,采用Pearson相关分析,ROC获得诊断DN患者肾功能严重损害的RI截断参考值。
2 结果
2.1 四组间RI和IMT比较及变量间相关性分析 四组RI和IMT均有统计学差异(均P<0.05),两两比较发现A组高于其他三组,B组均高于C和D两组(均P<0.05)。相关性分析显示,RI与IMT存在正相关(r=0.55,P<0.05);RI与eGFR存在负相关(r= -0.42,P<0.05)。见表1。
表1 四组各项指标比较(±s)
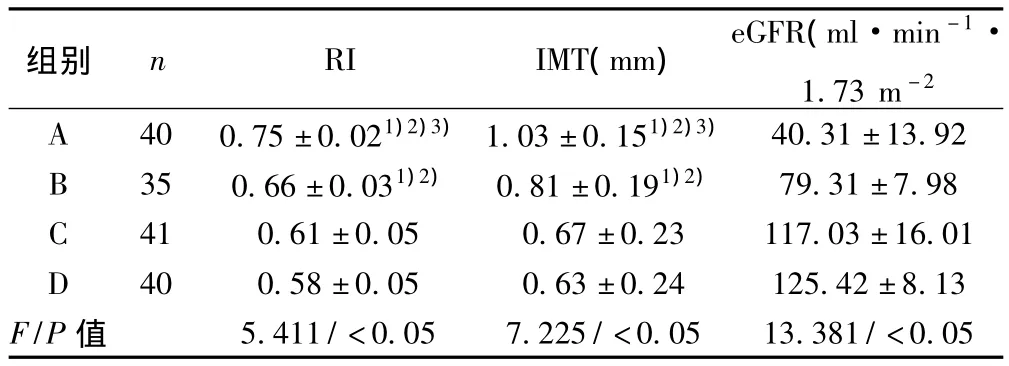
表1 四组各项指标比较(±s)
与D组比较:1)P<0.05;与C组比较:2)P<0.05;与B组比较:3)P<0.05;下表同
组别 n RI IMT(mm) eGFR(ml·min-1·1.73 m -2 40.31±13.92 B 350.66±0.031)2) 0.81±0.191)2) 79.31±7.98 C 410.61±0.050.67±0.23117.03±16.01 D 400.58±0.050.63±0.24125.42±8.13 F/P值A 400.75±0.021)2)3)1.03±0.151)2)3)5.411/<0.057.225/<0.0513.381/<0.05
2.2 四组血管重构发生率比较 四组间血管重构率比较存在差异(F=31.12,P<0.05),两两比较发现A组高于其他三组,B组高于C和D两组(P<0.05);血管重构类型比较发现负性重构随eGFR降低出现增加趋势,但仅有A、B两组分别与D组间存在统计学差异(P<0.05);在C、D组中血管重构情况以无重构为主,其他两组以正向重构为主。见表2。

表2 各组血管重构率及重构类型比较〔n(%)〕
2.3 RI预测DN患者肾功能损伤 以RI>0.726作为判定DN患者肾功能严重受损的阶段参考值,其敏感性为84.21%,特异性为89.43%。
3 讨论
DN的发病率也随着上升。DN是糖尿病严重的并发症之一,可累及肾小管、肾小球、肾脏间质和血管等几乎肾脏的所有结构,病理改变主要有系膜细胞增生、肾小球基底膜增厚、足细胞数量减少、系膜结节状硬化以及肾小球硬化等〔3〕。DN发病主要是由微循环障碍、糖代谢紊乱、生物因子变化、氧化应激反应、遗传等多种因素共同作用的结果〔4〕。DN患者上述改变导致肾脏血流阻力增加,从而使DN患者肾内动脉RI升高〔5〕。目前国内常用按尿白蛋白排泄率(UAER)对患者进行分期,但DN患者UAER升高并不总可以准确反映患者肾功能下降。为更加客观地反映DN患者的肾功能,本研究采用RI、eGFR、IMT对DN患者进行系统临床分析。
本研究结果说明随着eGFR的降低,各组肾内动脉RI逐渐升高,即RI与eGFR存在负相关关系,与相关研究一致〔6〕。同样本研究结果显示,糖尿病组的RI升高,其机制可能与DN患者肾内发生动脉粥样硬化、肾间质出现水肿、肾小球的自我调节能力降低以及肾小球动脉弹性下降等因素导致肾脏的高灌注、高滤过状态有关。因此,可以用RI反映DN患者肾脏损伤的进展情况〔2〕。
糖尿病患者可导致全身外周血管损伤,其中DN是其并发症之一;此外,颈部血管病变被认为是DN患者最常见的并发症,并且颈部血管出现粥样硬化斑块与患者发生脑梗死、缺血性脑血管病等疾病存在密切的关联〔7〕。由于颈动脉IMT指标与大血管病变显著相关,因此被作为动脉硬化亚临床的客观指标,可用于全身动脉粥样硬化情况监测。本研究中,随着RI增高,颈动脉IMT逐渐增厚。因此,肾内动脉RI不仅仅可以反映肾功能损伤状况,而且与颈动脉粥样硬化也存在密切相关,即证实DN与颈动脉粥样硬化有密切关联〔8〕。颈动脉粥样硬化一个主要特征是患者血管出现重构,且糖尿病患者随着病情的加重,其动脉硬化血管从正性重构演变负性重构,即反映病情从早期到后期发展的一个过程。因此,本研究表明DN患者随着疾病的进展,颈动脉粥样硬化的程度不断加重,也证实颈动脉粥样硬化与DN肾脏微血管病在疾病进展上具有一致性〔9〕。
1 Park CW.Diabetic kidney disease:from epidemiology to clinical perspectives〔J〕.Diabet Metab J,2014;38(4):252-60.
2 Insalaco M,Zamboli P,Floccari F,et al.Indication to renal biopsy in DM2 patients:potential role of intrarenal resistive index〔J〕.Arch Ital Urol Androl,2012;84(4):283-6.
3 Kowalski A,Krikorian A,Lerma EV.Diabetic nephropathy for the primary care provider:new understandings on early detection and treatment〔J〕.Ochsner J,2014;14(3):369-79.
4 Yuan C,Lai CW,Chan LW,et al.Cumulative effects of hypertension,dyslipidemia,and chronic kidney disease on carotid atherosclerosis in Chinese patients with type 2 diabetes mellitus〔J〕.J Diabetes Res,2014;2014:179686.
5 张晓玲,白久旭,韩敬明,等.糖尿病肾病与非糖尿病肾病维持性血液透析患者血钙、血磷及甲状旁腺激素水平的分析〔J〕.现代生物医学进展,2013;13(30):5896-9,5928.
6 Basturk T,Akcay M,Albayrak R,et al.Correlation between the resistive index values of renal and orbital arteries〔J〕.Kidney Blood Press Res,2012;35(5):332-9.
7 Segura J,de la Sierra A,Fernández S,et al.Relevance of diabetes in high cardiovascular risk hypertensive patients〔J〕.Med Clin(Barc),2013;141(7):287-91.
8 Mataradzija A,Resié H,Rasi S,et al.Risk factors for development of cardiovascular complications in patients with chronic renal disease and diabetic nephropathy〔J〕.Bosn J Basic Med Sci,2010;10(1):44-50.
9 Jerums G,Macisaac RJ.New approaches for the evaluation of renal vascular function in diabetes〔J〕.Diabetologia,2011;54(9):2223-5.
