基于偏定向相干性(PDC)的脑卒中后抑郁症患者脑网络研究
2015-09-11王春方孙长城王勇军綦宏志欣张万柏坤杜金刚
王春方 孙长城 张 希 王勇军 綦宏志 何 峰 赵 欣张 颖 万柏坤 杜金刚 明 东#*
1(天津市人民医院康复医学科,天津市康复医学研究所,天津 300121)2(天津大学精仪学院生物医学工程系,天津 300072)
基于偏定向相干性(PDC)的脑卒中后抑郁症患者脑网络研究
王春方1孙长城1张 希2王勇军1綦宏志2何 峰2赵 欣2张 颖1万柏坤2杜金刚1明 东2#*
1(天津市人民医院康复医学科,天津市康复医学研究所,天津 300121)2(天津大学精仪学院生物医学工程系,天津 300072)
探究脑卒中后抑郁症(PSD)患者脑网络异常。采集PSD患者及其对照组(卒中后无抑郁症(PSND)患者及健康人(CONT))各10例16导联静息态脑电信号进行偏定向相干性(PDC)分析,利用单尾单样本t检验构建这3类人群的平均脑网络图,并对所得脑网络进行基于图论的拓扑参数比较分析。结果表明,经统计学检验(P<0.05),当PDC阈值取0.2时,三类人群平均脑网络节点度、平均集群系数及中介中心度参数差异最明显。具体表现为脑卒中患者相对健康人出现了优势半球(左半球)信息流入的减弱,PSD患者相对PSND患者在与“情绪”相关的左额叶及左颞叶信息流出减弱。PSD患者相对CONT及PSND人群平均集群系数分别下降2.4%及1.8%,脑网络集团化程度减弱;网络核心节点个数分别增大2.2倍及1.6倍,且核心节点有所转移,枢纽节点核心地位下降。受脑卒中和抑郁情绪的影响,PSD患者的脑网络发生了异常改变。
脑卒中后抑郁症(PSD);脑电(EEG);偏定向相干性(PDC);脑网络
引言
脑卒中以其发病率高、致残率高而成为影响人类健康的重大疾病,由此造成的不仅是肢体活动障碍、认知障碍等,还引发出精神类并发症。脑卒中后抑郁症(poststroke depression,PSD)是指有明显临床症状的卒中(相对于静息性卒中而言)后引发的抑郁症,表现为忧伤或郁闷、情绪低落,是对丧失、失望或者失败所产生的一种异常的负面情绪反应,是脑卒中后发病率最高的精神类并发症。据统计,全国有约3 000万脑卒中患者,其中2/3在卒中后不同时期有不同程度的抑郁症表现[1-3]。
PSD对卒中的全面康复有明显负面影响,有关报道称,脑卒中并发抑郁症状的病死率是无抑郁症状的3~4倍[3],这严重影响了患者今后的生活质量,推迟甚至阻碍了康复和回归社会的过程。但是,目前临床对PSD的误诊漏诊率高达80%[4],且临床重视不足,主要原因是发病机制不明确、缺乏相关的科学研究。
人脑是自然界中最复杂的系统之一,数量巨大的神经元细胞通过无数个突触相互连接,形成了一个高度复杂的脑网络结构。这个复杂而庞大的网络是大脑进行信息处理和认知表达的生理基础,近来,一些神经科学家对人脑连接性的研究取得了重要成果。19世纪下半叶,Wernicke、Meynert和Dejerine等提出了大脑“失连接”的概念。此后,很多研究表明,大多数神经和精神疾病都存在此种失连接症状,如阿尔兹海默症、癫痫、儿童多动症等[5-9]。最新研究发现,抑郁症是由于脑细胞间彼此沟通能力失调所导致,抑郁症中细胞之间的兴奋性信号传播出现异常,恢复大脑正常通讯是血清素等抗抑郁药物成功发挥作用的机制,是缓解抑郁病症的关键[10]。已有研究学者利用偏定向相干性(partial directed coherence, PDC)方法,分析了抑郁症患者额区不同导联位置间EEG信号的交互作用,发现抑郁症患者在静息状态和心算任务下额区半球间和半球内EEG信号交互作用与健康人相比有所减弱[11],这说明抑郁症对一些脑区间信息的交流产生了影响,脑区间的连接强度普遍减弱。情感调节通路受损已被认为是PSD可能的发病机制[12-13],暗示了PSD患者各脑区间的连接性同样出现异常,推测大脑同样会出现“失连接”症状。
基于图论的脑网络分析方法是研究大脑连接性的一种重要手段[10]。图论是目前复杂网络分析领域最主要的数学工具,一个复杂网络在图论中可以表述为由节点和边组成的图。由于它能够提供强大的网络分析方法来研究脑网络的计算模型,定量描述大脑组织的连接性[5,9,14],因此成为复杂脑网络研究的热点。复杂网络理论为研究各类人群大脑间连接性提供了必要的工具和分析方法,利用此方法已有大量研究学者对正常人大脑的结构和功能网络及神经、精神疾病引起的网络异常进行了研究。在脑网络中,不同的连接方式代表不同的信息传递路径,利用基于图论的脑网络方法对PSD患者进行脑连接性分析,探究其各脑区间信息传递机制的异常具有重要意义。
1 材料与方法
1.1 受试者
实验受试人群分为三组:健康对照组(control,CONT)、脑卒中后无抑郁症患者组(poststroke non-depression, PSND)、脑卒中后抑郁症患者组(poststroke depression, PSD)。每组10例,共30例。受试者均由天津市人民医院康复医学科招募,并知情同意。
脑卒中患者入组标准如下:首次发病,符合2005年《中国脑血管病防治指南》的诊断标准,经CT或MRI确诊为脑卒中,距离发病时间小于13个月;年龄超过20岁,且不到80岁;意识清醒;右利手;15 d内未服用助睡眠、抗抑郁等药物;PSD患者符合CCMD-Ⅲ抑郁症诊断标准且Hamilton抑郁量表(24项版本)评分均不小于15分,PSND患者诊断无抑郁症且Hamilton抑郁量表(24项版本)评分均小于15分。
健康对照组入选标准如下:年龄、性别、利手与卒中患者相匹配;身体健康,无严重的神经系统疾病史;无精神类疾病病史及精神药物服用史;右利手。
所有受试者排除标准如下:存在抑郁症或其他精神类疾病病史;严重的心肺功能障碍或血液系统疾病;进行过脑部手术或有过脑部创伤史;存在严重的认知功能障碍(如帕金森病、多系统萎缩等)、不能配合检查者,有中枢神经系统肿瘤(如脑胶质瘤、脑膜瘤等);拒绝参与本研究者。
三组人群基本信息如表1所示。PSD与PSND两组患者在年龄、性别、患病时间经统计学检验均无显著性差异(P<0.05),CONT、PSND、PSD三组的年龄、性别经统计学检验无显著性差异(P>0.05)。
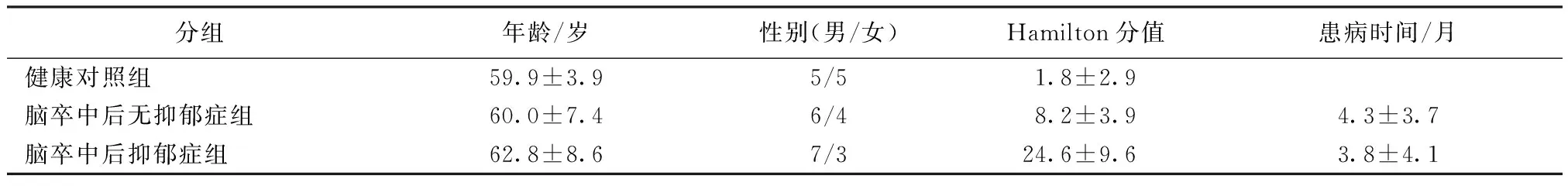
表1 三组受试人群基本信息
1.2 脑电数据采集及预处理
采集静息状态下的EEG信号,受试者在放松情况下保持闭目、清醒状态,静坐于脑电图检查室中进行EEG信号采集。此外,受试者被告知尽量减少肢体动作及眨眼动作,以免引入干扰信号。脑电图检查室安静、弱光,远离电磁干扰。采集设备使用NicoletOne 32通道数字视频脑电图仪。使用盐水电极,电极按照国际标准导联10-20电极系统位置安放,电极阻抗小于10 kΩ,以Cz作为参考电极,记录16导联头皮EEG信号(Fp1、Fp2、F3、F4、C3、C4、P3、P4、O1、O2、F7、F8、T3、T4、T5、T6)及双侧耳垂处电信号;信号采样率为250 Hz,A/D转换精度为12 bit,滤波范围为0.1~70 Hz。
EEG信号去噪过程如下:
1)对原始EEG数据进行变参考,将Cz参考变为双耳A1A2参考;
2)0.6~46 Hz带通滤波,主要去除高频干扰成分;
3)使用独立成分分析(independent component analysis,ICA)的方法去除眼电、心电等干扰信号;
4)对伪迹依然明显的数据进行手动剔除,最终得到90 s静息态EEG数据进行后续处理分析。
1.3 数据分析方法
1.3.1 偏定向相干性
偏定向相干(partial directed coherence, PDC)是一种基于多变量自回归处理时间序列模型的格兰杰因果性频域测量方法。归一化的PDCxj→xk在[0,1]之间,表示xj流向xk的信号占所有从xj流出信号的比例,接近0说明两通道间没有联系,大于0.1则认为两通道间有联系[15]。将每名受试者全频段90 s EEG数据以10 s 为单位进行PDC计算,将9个10 s所得结果的平均值作为最终每名受试者PDC 值的结果。具体研究算法为
对于多通道AR模型,可表示为
(1)
式中,
所处理数据为16导联EEG信号,即16个通道,对应m=16,获得16导联EEG数据时域AR模型之后,再对其(式(1))进行傅里叶变换,得
(2)
(3)
式中,I表示维数为m=16的单位矩阵。
这样,xj→xk的偏定向相干性(PDC)可定义为
(4)
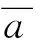
PDCxj→xk的值是归一化的,在[0,1]之间,表示xj流向xk的信号占所有从xj流出信号的比例,接近0说明两通道间没有联系,大于0.1则认为两通道间有联系。因此,最终得到16×16的矩阵,表示16个导联两两间的信息流强度及方向。
1.3.2 基于图论的脑网络构建
本研究将16个导联作为节点,利用PDC计算出的信息流强度(即PDC值)作为边、信息流方向作为边的指向,构建大脑皮层拓扑网络,通过网络拓扑性质分析不同人群脑网络的特点,进而探究脑卒中后抑郁症患者大脑的异常连接性。
网络中不同节点间的连接,即边的组成由邻接矩阵来描述。本研究的网络有N=16个节点,则邻接矩阵为16×16的矩阵,矩阵元素ai,j=0,表示i、j两节点间无连接;矩阵元素ai,j=1,表示i、j两节点间有连接。本研究利用PDC值建立的脑网络为有向加权脑网络,但是在计算某些网络参数时会对PDC取一定的阈值转化为二值网络进行分析与计算。对于生成的网络,应用以下3个拓扑参数进行定量的描述。
1)节点度(degree):节点度为与某一节点相连的边的数目。对于本网络图来说,又分为入度(in-degree)和出度(out-degree),入度即由此节点流入的边的数目,出度即由此节点流出的边的数目。节点度越大表示节点的连接越多,相应节点在网络中的地位也相对越重要。
2)集群系数(clustering coefficient):集群系数用于衡量网络集团化程度,表示与某节点相邻的边之间互相连接的可能性大小。节点i的集群系数Ci为与i相邻的节点间实际相连的数目ei与可能相连的最大数目(ki(ki-1)/2)之比,具体计算公式为
(5)
整个网络的集群系数为所有节点集群系数均值,即
(6)
3)中介中心度(betweenness centrality):中介中心度用来刻画网络节点的作用和地位,中介中心度越大,表示该节点在整个网络中越重要,是该网络的核心节点。一个节点的中介中心度表示所有节点对之间通过该节点的最短路径的条数,具体计算公式为
(7)
式中,σjk为节点j到节点k所有最短路径的数目,σjk(i)为节点j到节点k的最短路径中通过节点i的数目。
三类人群共有30名受试者的EEG数据,每一名受试者对应一个PDC矩阵(16×16)。为了确定每一类人群的平均脑网络,并将其转化为有向二值脑网络进行分析,采用如下方法进行:对于PDC设定不同的阈值μ0(μmin≤μ0≤μmax),其中,最小值μmin取0.1,最大值μmax取节点个数N(16)的自然对数2.77,在取值区间内μ0的递增量为0.05[16]。对于每类人群,利用单样本t检验确定此类人群的功能连接关系,从而确定最终的脑网络结构[16]。
具体检验过程如下:假设某类人群(10个样本)的样本均值为μ,提出零假设,有
μ0为设定的PDC阈值,检验统计量为
(8)
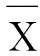
利用单尾单样本t检验,若t落在拒绝域,即拒绝原假设,说明两导联间的连接强度大于阈值μ0,即对应脑网络中两节点间有连接;反之,则说明两节点间无连接。
2 结果
对三类人群在不同PDC阈值下生成的网络应用节点度、集群系数和中介中心度等拓扑参数进行了定量描述,发现在阈值μ0取0.2时,三类人群的脑网络差异性最明显,以下为μ0=0.2时三类人群的差异性描述。
2.1 度分布
网络入度代表了信息流入某节点的情况,即此节点为“果”;出度代表了信息流出某节点的情况,即此节点为“因”。表2为3个脑网络的入度(in-degree)分布;表3为3个脑网络的出度 (out-degree)分布。从两个表的比较可以看出,三类人群的节点入度相对节点出度分布均更为集中,即“果”的分布比“因”的分布更为集中。对于入度,CONT组较大的几个节点左半球分布较多,显示出了对侧优势现象;而卒中患者(PSND组与PSD组)没有明显的左右半球分布的差异;对于出度,CONT组较均匀地分布于16个节点,相对CONT组,PSND患者在前额叶、额叶、枕叶、颞叶出度减少,PSD患者在额叶、枕叶、颞叶出度减少,PSD患者相对PSND患者在与“情绪”相关的左额叶(F7)及左颞叶(T3、T5)的分布减少,表明PSD患者 “情绪”相关脑区信息流出减弱。

表2 三类人群脑网络各节点入度
注:粗体表示入度≥10的导联节点。
Note:Bold indicates that in-degree of the channel node ≥10.

图1 三类人群脑网络连接。(a) CONT; (b) PSND; (c) PSDFig.1 Brain network connection diagram of the three groups. (a) CONT; (b) PSND; (c) PSD

分组导联节点FP1FP2F3F4C3C4P3P4CONT76786877PSND46879878PSD879812999O1O2F7F8T3T4T5T6CONT77888888PSND55668878PSD66377855
注:粗体表示出度≥8的导联节点。
Note:Bold indicates that out-degree of the channel node ≥8.
2.2 集群系数
集群系数可以衡量一个网络的集团化程度,所有节点的平均集群系数越高,代表整个网络的集团化程度越高,对应网络的运行效率越高。CONT、PSND、PSD三类人群平均脑网络图16个节点的平均集群系数分别为0.881、0.876、0.860,依次降低。PSD患者相对CONT及PSND人群分别下降2.4%和1.8%,说明PSD患者相对于PSND患者及健康人脑网络集团化程度降低,网络运行效率降低。
2.3 中介中心度
一个节点中介中心度的大小代表了此节点在网络中的地位,中介中心度越大,表示此节点在整个网络中的地位越重要。图1为基于单尾单样本t检验(P<0.05)所构建的三类人群平均脑网络图,并且标注了某些“枢纽”节点的中介中心度。CONT人群只在5个节点(FP1、F3、P3、P4、O1)处有值,且均为0.20,说明健康正常人的枢纽节点集中分布在上述5个节点;PSND患者中介中心度不为零的节点分散在FP1、FP2、F3、F4、P4、O1、F8,其中较大的仅集中在3个节点处:FP2(0.13)、F3(0.38)、P4(0.38),说明PSND患者枢纽节点有所减少;PSD患者枢纽节点分布相对分散,在节点FP1、FP2、F3、F4、F8、C3、C4、P3、P4、O1、O2处均有取值,中介中心度较大的节点为FP1(0.22)、FP2(0.23)、F3(0.11)、P4(0.14)、O1(0.14)。PSD患者相对CONT及PSND,网络核心节点的个数分别增大2.2及1.6倍。此外,与PSND患者相比,PSD患者中介中心度较大的节点(大于0.1)由3个分散为5个,且在C3、C4、P3、O2处出现增加的核心节点。由此可以看出,PSD和PSND患者相对健康人核心节点有所转移,PSD患者相对PSND患者枢纽节点出现明显分散,说明PSD患者网络集团化程度减弱,枢纽节点出现转移且更加分散,枢纽节点核心地位下降。
3 讨论和结论
本研究利用偏定向相干性(PDC)方法对三类人群的EEG信号进行了信息流向分析,构建了基于图论的脑网络,并对不同人群脑网络特性进行了比较分析,以探究PSD患者脑连接异常。
研究发现,无论是健康人还是卒中患者,节点入度相对节点出度分布均更为集中,即“果”的分布比“因”的分布更为集中,这也进一步证实了广泛分布于大脑各处的神经元的活动导致了几个中枢区域的活动。健康人各脑区间信息的交流显示出了左侧入度优势,说明对于健康人更多的神经信息流向左半球,推测与所选被试为右利手、优势半球为左半球有关。脑卒中患者(PSND组及PSD组)并未表现出对侧优势。由此推测,受脑卒中因素的影响,大脑的对侧优势有所减弱,相应的同侧半球会有一定的补偿。这与已有fMRI研究结果患者卒中后脑功能激活区由对侧转移到同侧相一致。
研究结果显示,PSD患者相对PSND患者在与“情绪”相关的左额叶及左颞叶分布减少,表明PSD患者 “情绪”相关脑区信息流出减弱。此外,PSD患者相对其他两类人群脑网络的集团化程度减弱,网络运行效率降低,脑网络核心节点有所转移,且枢纽节点折核心地位下降。有研究学者利用神经环路连接性损伤假说来解释抑郁症的发病,即抑郁症的发病有一定的神经解剖学机制,大脑有关部位的损伤破坏了相关心境调节神经通路,从而导致了抑郁发生[17-19]。研究表明,抑郁症存在神经回路的连接异常,而抗抑郁药物可恢复脑区间的异常连接,推测抑郁症发病与神经连接障碍有关[17,20]。神经影像学研究表明“边缘-皮质-纹状体-苍白球-丘脑”通路在抑郁症的病理生理机制中起着重要作用。此外近来有研究发现,抑郁症是脑细胞彼此沟通能力失调所致,恢复大脑正常通信是血清素等抗抑郁药物成功发挥作用的机制,是缓解抑郁病症的关键[10]。由此推测,PSD患者存在大脑的“失连接”现象,卒中导致“情绪”相关脑区通信异常,“核心节点”受损,从而整个脑网络运行效率降低,并由此引发抑郁症是PSD发生的一种可能解释。
有研究学者利用不同脑区的度、中介中心度、聚集系数、最短路径长度等参数,对普通抑郁症患者及正常人做分类,可达到70%以上的分类效果[21]。利用PDC构建普通抑郁症患者和正常人的脑网络同样发现,抑郁症患者脑网络运行效率降低[14],这与本研究结果相一致。目前,暂无针对卒中所引起的抑郁症脑网络的相关研究,这也是本研究的创新之处。
综上所述,通过对健康人、脑卒中后无抑郁症患者及脑卒中后抑郁症患者的脑网络对比分析,发现受脑卒中和抑郁情绪的影响,PSD患者脑网络发生了异常改变,具体表现为与“情绪”相关的左额叶及左颞叶信息流出减弱,脑网络集团化程度减弱,网络运行效率降低,脑网络核心节点转移,枢纽节点核心地位下降。深入研究有助于揭示PSD患者的异常脑信息传递机制,并有望将脑电图发展为一种针对PSD疾病的客观评估技术。
[1] 王文志. 中国脑卒中流行病学特征和社区人群干预[J]. 中国医学前沿杂志, 2009, 1(2):49-53.
[2] Whyte EM, Mulsant BH. Post stroke depression epidemiology, Pathophysiology, and biological treatment [J]. Biol Psychiatry, 2002, 5(3):253-264.
[3] Dafer RM, Rao M, Shareef A,etal. Poststroke depression [J]. Topics in Stroke Rehabilitation, 2008, 15(1): 13-21.
[4] Gaete JM, Bogousslavsky J. Post-stroke depression [J]. Expert Rev Neurotherapeutics, 2008, 8:75-92.
[5] 梁夏,王金辉,贺永. 人脑连接组研究:脑结构网络和脑功能网络[J]. 科学通报,2010,55(16):1565-1583.
[6] Lars M, Muthuraman M, Rafael L,etal. Developmental changes of functional and directed resting-state connectivities associated with neuronal oscillations in EEG[J]. NeuroImage, 2013,81: 231-242.
[7] Hong XF. Cortical functional connectivity under different auditory attentional efforts [C]//34th Annual International Conference of the IEEE EMBS. San Diego: IEEE, 2012:6196-6199.
[8] Chiang J, Wang ZJ, McKeown MJ. A multiblock PLS model of cortico-cortical and corticomuscular interactions in Parkinson’s disease [J]. Neuro Image, 2012, 63(3): 1498-1509.
[9] Stam CJ, Haan W, Daffertshofer A,etal. Graph theoretical analysis of magnetoencephalographic functional connectivity in Alzheimer’s disease [J]. Brain, 2009, 132: 213-224.
[10] Cai X, Kallarackal AJ, Kvarta MD,etal. Local potentiation of excitatory synapses by serotonin and its alteration in rodent models of depression [J], Nat Neurosci, 2013,16(4): 464-472.
[11] Sun Y, Li Y, Chen X,et.al. Electroencephalographic differences between depressed and control subjects: An aspect of interdependence analysis [J]. Brain Research Bulletin, 2008,76: 559-564.
[12] Alexopoulos GS, Meyers BS, Young RC,etal. Vascular depression hypothesis [J]. Arch Gen Psychiatry, 1997, 54(10): 915-922.
[13] Alexopoulos GS, Meyers BS, Young RC,etal. Clinically defined vascular depression [J]. Am J Psychiatry, 1997, 154(4):562-565.
[14] Sun Y, Hu S, Chambers J,etal. Graphic patterns of cortical functional connectivity of depressed patients on the basis of EEG measurements [C]// 33rd Annual International Conference of the IEEE EMBS. Boston:IEEE, 2011 (4): 1419-1422.
[15] Sameshima K, Baccala LA. Using partial directed coherence to describe neuronal ensemble interactions [J]. J Neurosci Meth, 1999, 94 (1): 93-103.
[16] 焦静静. 基于复杂网络理论的静息状态脑功能网络建模与分析[D]. 兰州: 兰州理工大学,2011.
[17] 郭琴. 抑郁症患者情绪障碍的脑结构及功能机制研究[D]. 上海: 复旦大学,2008.
[18] Alexopoulos GS, Murphy CF, Gunning-Dixon FM,etal. Microstructural white matter abnormalities and remission of geriatric depression [J]. Am J Psychiatry, 2008, 165:238-244.
[19] Greicius MD, Flores BH, Menon V,etal. Resting-state functional connectivity in major depression: abnormally increased contributions from subgenual cingulate cortex and thalamus [J]. Biol Psychiatry, 2007, 62(5): 429-437.
[20] 吴毅,吴军发. 脑卒中康复干预的基础研究和临床研究[J]. 中国康复医学杂志,2011,26(8): 701-703.
[21] 白瑀,李海芳,郭浩. 抑郁症患者功能脑网络属性特征分类研究[J]. 电脑开发与应用,2012, 25(8): 1-3.
The Brain Network Research of Poststroke Depression Based on Partial Directed Coherence (PDC)
Wang Chunfang1Sun Changcheng1Zhang Xi2Wang Yongjun1Qi Hongzhi2He Feng2Zhao Xin2Zhang Ying1Wan Baikun2Du Jingang1Ming Dong2#*
1(RehabilitationMedicalDepartment,TianjinUnionMedicalCenter,RehabilitationMedicalResearchCenterofTianjin,Tianjin300121,China)2(DepartmentofBiomedicalEngineering,CollegeofPrecisionInstrumentandOpto-ElectronicsEngineering,TianjinUniversity,Tianjin300072,China)
The aim of our study is to investigate the abnormal brain network of poststroke depression (PSD) patients. Sixteen channels of resting state EEG of respectively 10 cases of PSD patients and control groups (poststroke non-depression (PSND) and healthy controls (CONT)) were collected for partial directed coherence (PDC) analysis. The average brain network diagrams for the three populations were built according to the one-tailed single samplettest. Some parameters based on topology graph theory were compared among the three populations. According to the statistical test (P<0.05), apparent difference was performed among the three groups in the brain network parameters of degree, average cluster coefficient and betweenness centrality when PDC=0.2. Compared with healthy subjects, stroke patients showed decreased information inflow to the dominant hemisphere (left). PSD patients performed weaker outflow information than PSND subjects in “emotional” related regions such as left frontal lobe and left temporal lobe. Comparatively to CONT and PSND populations, the cluster coefficient of PSD patients decreased by 2.4% and 1.8% respectively, indicating declined collectivization degree of brain network. The number of “core nodes” in PSD patients increased 2.2 times and 1.6 times respectively, showing transferred core nodes and lower core status. Affected by stroke and depressed mood, PSD patients performed abnormal brain networks.
poststroke depression (PSD); EEG; partial directed coherence (PDC); brain network
10.3969/j.issn.0258-8021. 2015. 04.001
2015-03-24, 录用日期:2015-05-08
国家自然科学基金(81222021);天津市卫计委科技攻关项目(13KG109,14KG107)
R318
A
0258-8021(2015) 04-0385-07
# 中国生物医学工程学会高级会员(Senior member, Chinese Society of Biomedical Engineering)
*通信作者(Corresponding author), E-mail: richardming@tju.edu.cn
