一种高质量的红毛丹基因组DNA提取方法
2015-09-10林兴娥葛宇周兆禧臧小平王甲水肖
林兴娥 葛宇 周兆禧 臧小平 王甲水 肖正新 马蔚红

摘 要 为了提取高质量的红毛丹基因组DNA,本研究以红毛丹叶片为试材,比较改良CTAB法、改良SDS法和试剂盒法对红毛丹叶片DNA的提取效果。结果表明:3种方法均可从红毛丹叶片中提取DNA,但由于改良CTAB法通过多次洗涤,并联合使用PVP和β-巯基乙醇处理,可有效去除红毛丹叶片中的多糖、多酚和蛋白质等物质,所获得的DNA纯度高且完整性较好,可用于SRAP-PCR等分子标记分析。此结果为后续分子生物学等相关研究奠定了基础。
关键词 红毛丹 ;DNA提取 ;改良CTAB法 ;SRAP
分类号 Q949.755.5
A High-quality Extraction Method for Genomic DNA of Rambutan
(Nephelium lappaceum)
LIN Xing'e1) GE Yu1) ZHOU Zhaoxi1)
ZANG Xiaoping1) WANG Jiashui1) XIAO Zhengxin2) MA Weihong1)
(1 Institute of Banana and Plantain, CATAS, Haikou, Hainan 570102;
2 Bureau of State Farm, Baoting, Hainan 572300)
Abstract To obtain high-quality rambutan gDNA used for SRAP-PCR analysis, total DNA was comparatively extracted from fresh leaves by using variant methods of the improved CTAB, improved SDS and a commercial plant genomic DNA Kit respectively. The results showed that all three methods were available for DNA extraction from rambutan leaf, but improved CTAB method by adding β-mercaptoethanol and PVP with rinse and two times washing, could effectively remove polyphenols, polysaccharides, protein and other substances of samples. The yield high-quality DNA from fresh leaves could be used for SRAP-PCR analysis.
Keywords rambutan (Nephelium lappaceum) ; DNA extraction ; improved CTAB method ; SRAP
红毛丹(Nephelium lappaceum)属无患子科(Sapindaceae)韶子属(Nephelium)热带多年生常绿乔木植物,原产于马来西亚和印度尼西亚,是著名的热带珍稀水果之一,与荔枝、龙眼同科,现广泛分布于东南亚、中美洲等地区[1]。红毛丹的果皮多毛,果壳含抗氧化和抗菌活性成分,果肉富含磷、镁、硫、钙、锌、铁和锰,具有极高的食用和药用价值[2-4]。目前,红毛丹的研究范围主要集中在栽培、繁殖、病虫防治、果实采后保鲜、化学成分分离提取等应用技术方面[5-7],而在无性系资源评价、育种改良、基因组变异、重要性状遗传与分子形成机制等基础领域的研究尚未开展。借助分子标记技术,检测基因组DNA水平的遗传变异已成为物种进化分析、种质资源评价、分子遗传育种等研究的重要策略。而提取高质量的DNA是开展相关工作的技术基础。
随着现代分子生物学的巨大进步,已经发展出许多植物DNA提取的方法,广泛应用的CTAB 法、SDS 法、尿素法等均通过裂解植物细胞,释放蛋白质等内含物于有机溶剂中,从而使核酸分离在水相中。但由于不同物种、部位在组织结构、化学成分等方面存在差异,不同方法对具体实验材料的提取效果差异很大。红毛丹的组织细胞中含有大量的多酚、多糖及其他脂类、色素等次生代谢物质[8-10],采用常规方法分离出来的DNA易被多酚氧化呈现褐色,同时由于DNA溶液粘稠,采用多次酚-氯仿抽提也不能得到高质量的DNA,并且在多次抽提过程中易受机械剪切作用而发生降解,不能作为PCR模板进一步分析使用。本试验通过对比改良CTAB法、改良SDS法和商品化试剂盒3种方法的提取效果,旨在选择一种简便、快捷、经济的高质量红毛丹基因组DNA提取方法,为进一步开展红毛丹SRAP等分子标记方面的相关研究奠定基础。
1 材料与方法
1.1 材料
供试材料均取自海南省保亭热作所红毛丹种质资源圃,采集无病虫害的叶片放入冰壶中带回实验室,置于-80℃超低温冰箱内保存备用。本研究随机选取3个样品作为试验材料,每个样品重复3次。
1.2 方法
1.2.1 改良CTAB法
改良CTAB法参照李明芳等[11]的方法,在叶片研磨时预先加入PVP粉末,研磨成粉末后加入2×CTAB提取液和β-巯基乙醇,离心取上清后分别用等体积的酚∶氯仿∶异戊醇(25∶24∶1)和氯仿∶异戊醇(24∶1)进行振荡抽提DNA。具体操作方法为:称取幼嫩叶片0.2 g,加入0.03 g PVP和液氮磨成细粉,然后转入2.0 mL预冷冻离心管中,再加入800 μL 65℃预热的CTAB提取液[2%(m/V)CTAB,100 mmol/L Tris·HCl,20 mmol/L EDTA,1.4 mol/L NaCl,2%(m/V)PVP,pH调至8.0]和20 μL β-巯基乙醇充分混匀,65℃温浴30 min,期间轻摇2次;水浴完成后离心(15℃,12 000 r/min)15 min取上清液,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)抽提上清液,颠倒使之充分混匀,离心(4℃,12 000 r/min)15 min取上清;再加入等体积的氯仿∶异戊醇(24∶1)抽提1次,颠倒混匀,离心(4℃,12 000 r/min)15 min取上清;加入等体积的异丙醇,混匀后可见丝状或絮状沉淀,即为DNA粗提物,用70%乙醇洗涤3遍,吹干;加入100 μL超纯水溶解DNA,再加入0.5 μL RNase A液(10 mg/mL),37℃水浴消化30 min,最后将获得的DNA置于-20℃保存备用。
1.2.2 改良SDS法
改良SDS法参照曹辉庆等[12]的方法,在叶片研磨时预先加入PVP粉末,研磨至粉末后加入SDS提取缓冲液和β-巯基乙醇,离心取上清后分别用等体积的酚∶氯仿∶异戊醇(25∶24∶1)和氯仿∶异戊醇(24∶1)进行振荡抽提DNA。具体操作方法为:称取幼嫩叶片0.2 g,加入0.03 g PVP和液氮磨成细粉,然后转入2.0 mL预冷冻离心管中,再加入800 μL 65℃预热的SDS提取缓冲液[100 mmol/L Tris·HCl(pH 8.0),50 mmol/L EDTA(pH 8.0),500 mmol/L NaCl,2%(m/V)PVP,2% SDS溶液(m/V)]和20 μL β-巯基乙醇充分混匀,65℃温浴30 min,期间轻摇2次;水浴后离心(15℃,12 000 r/min)15 min,取上清液,后续操作同1.2.1。
1.2.3 试剂盒法
称取幼嫩叶片0.2 g,加入液氮充分研磨,用天根生化科技(北京)有限公司生产的DNA secure plant Kit (D2485-01)新型植物基因组DNA提取试剂盒进行DNA提取,具体操作见产品说明书。
1.2.4 DNA质量检测
取DNA样品5 μL 用ddH2O稀释混匀20倍,用紫外分光光度计测定其OD230nm、OD260nm、OD280nm值。根据OD260nm值估测其浓度,根据OD260nm/OD280nm值和OD260nm/OD230nm值估测其纯度。DNA浓度=OD260nm×测定样品体积×稀释倍数;DNA得率=DNA浓度×总样品体积/样品鲜重。
取 DNA样品8 μL,加入3 μL溴酚蓝上样缓冲液,用1%琼脂糖凝胶电泳120 V电泳18 min后拍照,判断DNA的质量和完整性。
1.2.5 SRAP分子标记验证提取效果
以3种提取方法获得的样品DNA为模板,采用引物组合ME5/EM3进行SRAP-PCR扩增,以检测3种DNA提取方法的效果。SRAP-PCR反应体系为20 μL,其中含DNA模板20 ng、dNTPs 0.2 mmol/L、引物0.4 μmol/L、rTaq酶0.8 U、Mg2+ 2.0 mmol/L。扩增程序为:94℃预变性5 min;94℃变性1 min,35℃复性1 min,72℃延伸70 s,5个循环;94℃变性1 min,50℃复性1 min,72℃延伸70 s,35个循环;72℃延伸5 min,4℃保存。扩增反应结束后取5 μL扩增产物进行电泳,染色后在紫外凝胶成像仪上观察并拍照分析。
2 结果与分析
2.1 不同提取方法所得DNA的纯度和得率
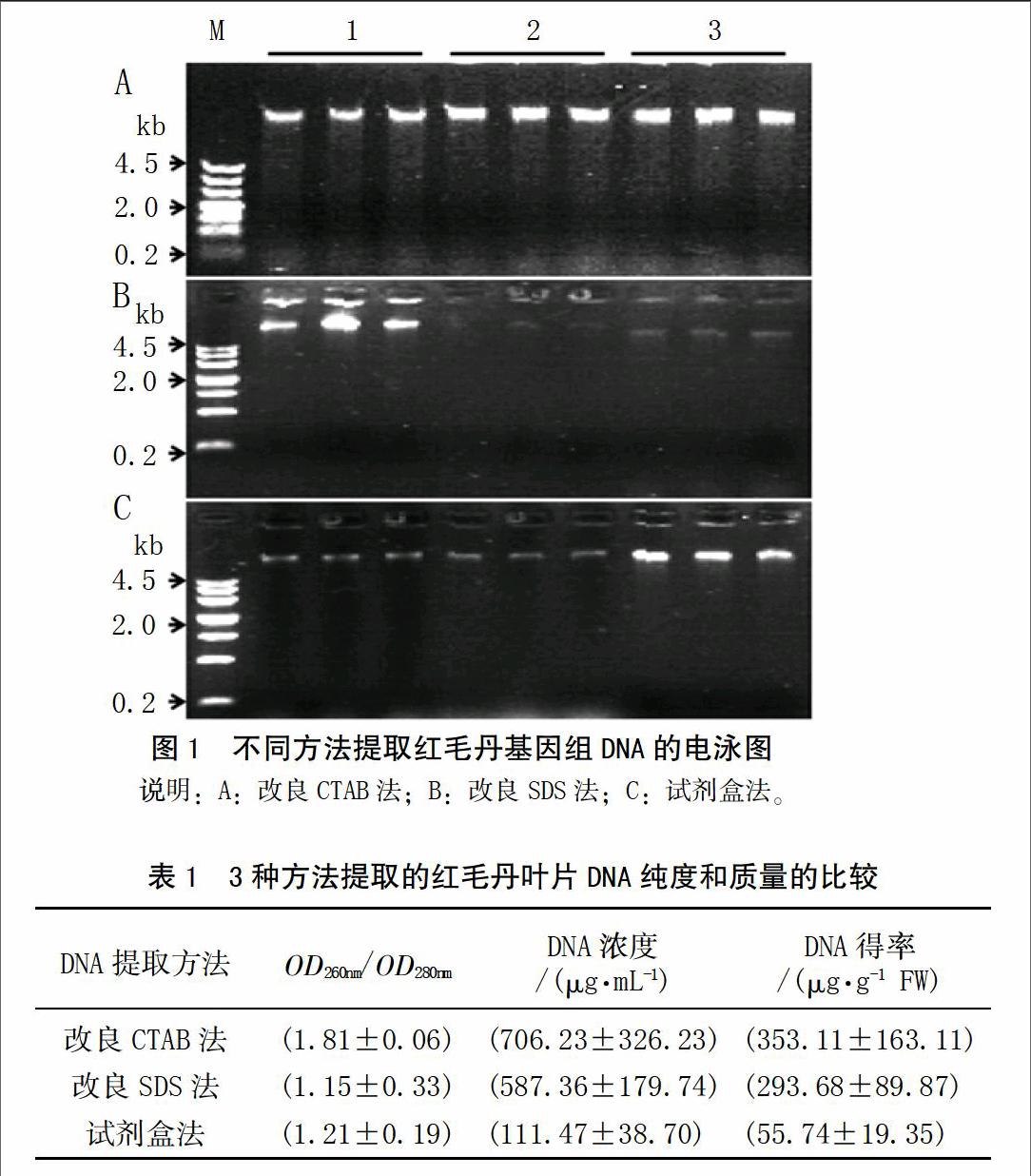
用紫外分光光度法测定DNA纯度时,一般情况下,若1.9>OD260nm/OD280nm值>1.8时,说明该DNA样品受杂质污染最少,质量最佳;若OD260nm/OD280nm>1.9时,表明DNA样品可能受到少量RNA的污染;如果其比值小于1.8,则说明有蛋白质等杂质存在[13]。由表1可知,改良CTAB法提取出的DNA质量较好,纯度较高,杂质量少,说明DNA样品中的蛋白质、酚类和多糖去除充分,较好地避免了RNA污染,可很好的满足后续实验的需求;改良SDS法提取得到的DNA呈褐色,含有较多的蛋白质、酚类和多糖等杂质,纯度较低;试剂盒法提取DNA得率最低,这是由于红毛丹叶片含有丰富的多糖,提取过程中多糖很容易形成粘稠的胶状物质,难于溶解,堵塞柱子造成DNA得率低。
2.2 琼脂糖凝胶电泳
从图1可知,3种方法均能从红毛丹的叶片中提取出完整的DNA,其大小均在4.5 kb以上。但改良SDS法提取的DNA量相对较少,同时含有胶状粘稠杂质,提取效果的稳定性差;而采用改良CTAB法提取的DNA量明显高于改良SDS法,其电泳条带明显比改良SDS法的亮,提取效果的稳定性好;试剂盒提取3个材料DNA所得的效果并不相同,有些材料的DNA条带较亮,有些较暗,条带亮度与DNA产量呈正相关,少数点样孔存在微弱荧光,表明有蛋白质污染,还存在少量RNA污染,这可能是加入RNase A量不足或37℃水浴消化时间过短造成。综合考虑,改良CTAB法可较好的去除蛋白质和多糖,DNA质量较好,最适于红毛丹成熟和幼嫩叶片基因组DNA的提取。
2.3 SRAP-PCR扩增验证
为了进一步评价改良CTAB法、改良SDS法和试剂盒法提取的DNA质量对后续试验的影响,分别以3种提取方法获得的DNA为模板,对其进行SRAP-PCR扩增检测。由图2可知,改良CTAB法提取的DNA模板均可扩增出比较清晰的条带,且稳定性好;试剂盒法提取的DNA纯度高,但不同背景的植物材料差别较大,SRAP-PCR扩增结果稳定性较差;而改良SDS法提取的DNA未成功扩增出清晰的SRAP条带,可能含有较多的蛋白质、糖、色素等反应抑制物。综上所述,改良CTAB法提取的红毛丹基因组DNA纯度高,杂质去除充分,通用性好,完全可满足SRAP等分子标记分析的需要。
3 讨论与结论
目前,关于去除荔枝、龙眼组织中多糖、多酚、蛋白质等杂质的研究报道较多。如易干军等[14]比较了传统SDS法和CTAB法提取荔枝基因组DNA的效果,结果表明2种方法均不适宜荔枝DNA的提取;分别在CTAB缓冲液中加入50 mmol/L的β-巯基乙醇、5%PVP和10 mmol/L Na2S2O5,比较结果发现加入10 mmol/L Na2S2O5提取的DNA质量较好。刘锴栋等[15]采用改良2×CTAB法即在缓冲液中加入β-巯基乙醇和PVP,且把温浴时间延长至2 h,可有效去除野生龙眼叶片中大部分多糖、多酚、单宁、色素等物质,提取到的DNA呈乳白色絮状沉淀,质量较高。肖璇等[16]采用改良的CTAB法和SDS法,即在核裂解之前先破碎细胞,将存在于细胞质中的次生物质去除后再裂解细胞核,细胞核裂解后用氯仿/异戊醇连续抽提2次以上,去除了大部分蛋白和色素,同时将CTAB浓度提高到3%(m/V),增强了裂解细胞和去杂质的能力,在改良SDS法中异丙醇沉淀前加入1/5体积的5 mol/L NaCl,进一步去除细胞碎片及其他杂质,提取到的DNA纯度高。目前关于红毛丹DNA提取的研究尚未见报道。
本试验在参考前人研究的基础上,结合红毛丹的特性,主要通过预先在材料中加入PVP粉末再进行研磨,然后转入含2%(V/V)β-巯基乙醇和2%(m/V)PVP的提取液中,无论材料的老嫩程度,均可有效防止褐变及多糖形成的胶状物质。改良CTAB法较改良SDS法提取到的DNA纯度更高,呈乳白色,可有效去除色素。通过PCR检测,结果发现提取的DNA可用于后续研究。
从本试验结果可看出,不同的红毛丹品系间得到的DNA纯度和产率不一致,可能是由于不同红毛丹品种中多糖和酚类的组成和含量具有一定的差异。植物组织中多酚、多糖等代谢物质随着组织器官的成熟而增加[16-19],因此,在改良CTAB法的基础上,还需根据红毛丹不同的品系、取材部位、发育程度及试验要求等进一步调节试验成分的组成,以便探索一种更好的操作方法,最终得到更高质量的DNA。
参考文献
[1] Wall M M. Ascorbic acid and mineral composition of longan(Dimocarpus longan),lychee (Litchi chinensis) and rambutan(Nephelium lappaceum) cultivars grown in Hawaii[J]. Journal of Food Composition & Analysis,2006, 19(4): 655-663.
[2] Ragasa C Y, De L R D, Cruz W C, et al. Monoterpene lactones from the seeds of Nephelium lappaceum[J]. Journal of Natural Products, 2005, 68(9):1 394-1 396.
[3] 陈嘉曦,李尚德,陈 杰. 红毛丹的微量元素含量分析[J]. 广东微量元素科学,2007,14(4):43-45.
[4] 张会林,孙丽平,范家恒,等. 红毛丹果皮抗氧化物质的提取及其抗氧化作用[J]. 食品工业科技,2011,32(10):129-131.
[5] Uma P, Cheng H M, Theanmalar M. Rind of the rambutan, Nephelium Lappaceum, a potential source of natural antioxidants[J]. Food Chemistry, 2008, 109(1):54-63.
[6] Leong L R, Shui G. An investigation of antioxidant capacity of fruits in Singapore markets[J]. Food Chemistry,2002,76(1):69-75.
[7] Wanrada S, Wannee J, Utai K. Response surface optimization and characteristics of rambutan(Nepheliumlappaceum L.)kernel fat by hexane extraction[J]. LWT-Food Science and Technology, 2011, 2(1): 1-6.
[8] 何 艾,张容鹄,陈秀琼,等. 酶法提取红毛丹果皮花色苷的研究[J]. 热带生物学报,2011,2(4):355-359.
[9] 张 瑜,张换换,李志洲.红毛丹果皮中原花青素提取及其抗氧化性[J]. 食品研究与开发,2011,32(1):188-192.
[10] 李娘辉. 红毛丹果实的发育及采后生理研究[J]. 华南师范大学学报,1999,44(2):88-91.
[11] 李明芳,郑学勤. 荔枝基因组DNA的提取[J]. 生物技术通讯,2004,15(6):591-592.
[12] 曹辉庆,彭宏祥,廖惠红. 不同种质荔枝基因组DNA提取研究[J]. 广西农业科学,2009,40(6):618-620.
[13] 贝盏临,张 欣,杜 进,等.不同方法提取牛心朴子基因组DNA效果的比较研究[J]. 北方园艺,2011,35(18):135-137.
[14] 易干军,霍合强,蔡长河,等. 适于AFLP分析用的荔枝DNA提取方法[J]. 华南农业大学学报,1999,20(3):123-124.
[15] 刘锴栋,袁长春,黎海利,等. 不同方法提取野生龙眼基因组DNA的效果比较[J]. 广东农业科学,2012,39(20):131-133.
[16] 肖 璇,孙 敏,王心燕,等. 顽拗植物龙眼基因组DNA提取方法的研究[J]. 生物技术,2005,15(1):44-47.
[17] 陈惠云,孙志栋,茅轶俊,等. 春兰基因组DNA提取方法的研究[J]. 分子植物育种,2006,4(1):135-142.
[18] 刘 婵,王 博,段 青,等. 滇山茶基因组DNA不同提取方法效果比较[J]. 江苏农业科学,2010,38(6):49-50.
[19] 胡凤荣,任 翠,鲍仁蕾,等. 风信子DNA不同提取方法的效果比较[J]. 沈阳农业大学学报,2011,42(5):570-573.
