不同生长时期泽泻蕨叶片光响应曲线的研究*
2015-09-09范海翔
范海翔,关 旸
(黑龙江省普通高等学校植物生物学重点实验室;哈尔滨师范大学)
0 引言
泽泻蕨Parahemionitis cordataFraser-Jenkins属凤尾蕨科、拟泽泻蕨属,世界范围内分布于中国南部、印度南部、斯里兰卡及东南亚等热带地区,其营养叶先端圆钝,基部深裂,呈美观的“鸡心形”[1],因此又名“心叶蕨”,是近年来国内外新兴的小型观叶蕨类植物.此外,泽泻蕨还具有药用和生物农药价值,对人体外伤感染[2]和植物真菌病[3]等具有明显的抑制作用.目前国内外对于泽泻蕨的研究主要集中在系统分类[4]和天然药化成分分析等方面[5],作为极具潜力的经济型蕨类,关于泽泻蕨栽培相关生态因子控制方面的研究尚未有人报道.
光合作用是植物生长发育过程中最重要的生理反应体系,光照强度是影响光合效率最重要的环境因子.植物的光合作用对光强非常敏感,光强过高会损伤光反应中心,引起光抑制[6],过低则会降低碳同化能力,两者都会引起光合能力下降,不利于植物生长[7].合理的光强有助于实现植物最快生长,节约栽培成本.光响应曲线描述了植物净光合速率(Pn)与有效光辐射(PAR)之间的关系,对该曲线进行分析可以获得光饱和点(LSP)、表观光量子效率(α)等多项指标,其中光饱和点反映了宏观上植物对合理光强的需求,表观光量子效率反映了植物对光能的利用效率,此外,光补偿点(LCP)和暗呼吸速率(Rd)等指标也都反映了植物对光合条件的适应[8].
该实验分别选取了处于营养生长期和生殖生长期的泽泻蕨植株进行光响应曲线相关数据的测定,利用目前应用较为广泛的三种光响应曲线拟合模型对所得数据进行拟合,并对拟合曲线进行比较分析,研究了泽泻蕨生长过程中自身光合能力的变化,探索了一定条件下泽泻蕨几个典型生长阶段所需的光照条件,也为泽泻蕨乃至其他喜阴蕨类植物光响应曲线拟合模型的选用提供了参考.(因泽泻蕨属异形叶蕨类,营养叶与孢子叶结构和功能有较大差别,以下内容涉及叶片均为泽泻蕨的营养叶)
1 材料与方法
1.1 材料的选择与处理
选取处于营养生长期和生殖生长期的健康泽泻蕨植株各6株,所用泽泻蕨植株由刘保东等于哈尔滨师范大学温室进行孢子繁殖并培育成功,所用孢子取自深圳仙湖植物园.
温室环境条件为:光照强度 600~800 μmol·m-2·s-1、光照时间 14h·d-1、温度25±0.5℃、湿度60±5%.
1.2 数据采集方法
选取每个植株相同位置的营养叶叶片,使用美国LI-COR公司出产的6400型便携式手提式光合仪进行测定,每片叶子重复三次,测定时间为连续两个晴天之后的上午9:00-11:00.该光合仪可提供稳定的环境因子,装配LI-COR-6400-02B型红蓝光源叶室,光强梯度依次为1600、1400、1200、1000、800、600、400、200、160、120、80、40、0(μmol·m-2·s-2),CO2由小钢瓶通过注入系统提供,稳定浓度为400(μmol·mol-1),叶室温度 28 ±0.5℃,叶室相对湿度60%.
1.3 数据的处理
所得数据取三次重复的平均值,再取三株数据的平均值,使用SPSS分析软件与EXCEL软件分别进行数据分析与画图.
2 实验结果与分析
以光合的有效辐射(PAR)为横轴,净光合速率为纵轴,采用直角双曲线模型、非直角双曲线模型和双曲线修正模型三种光合作用光响应曲线拟合模型[9-10]对营养生长期和生殖生长期的两组数据分别进行光曲线拟合.
2.1 直角双曲线模型
拟合公式如下:
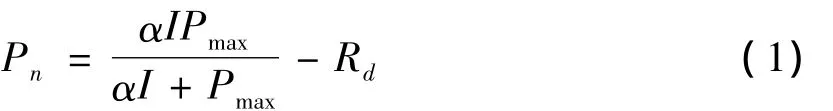
公式中:Pn为净光合速率(μmol·m-2·s-2);Pmax为光饱和时的最大净光合速率(μmol·m-2·s-2);Rd为暗呼吸速率(μmol·m-2·s-2),等于光照强度为0时的净光合速率;I为光量子通量密度(μmol·m-2·s-2);α 为表观光量子效率,即光响应曲线在弱光阶段的斜率.
2.2 非直角双曲线模型
拟合公式如下:
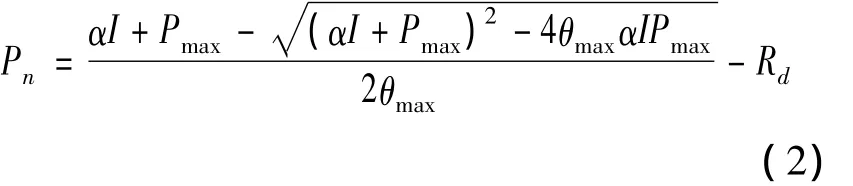
公式中:Pn、Pmax、Rd、α 和I的含义同公式(1),θ为非直角光曲线的凸度(0<θ<1)
2.3 双曲线修正模型
拟合公式如下:
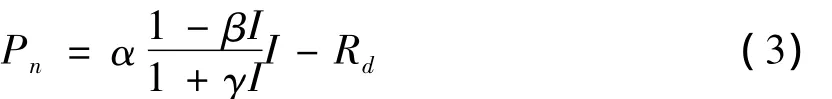
公式中:Pn、Pmax、Rd、α 和I的含义同公式(1)和公式(2);β是修正系数;γ也是一个系数,γ=
2.4 泽泻蕨叶片光响应曲线模型的选取
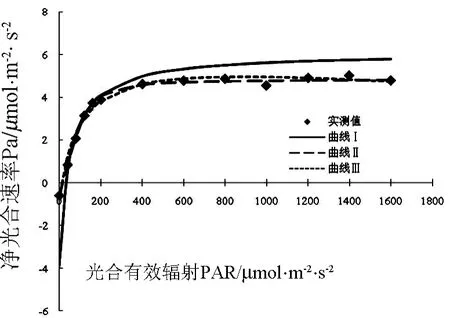
图1 泽泻蕨营养生长期叶片光响应曲线
由图1泽泻蕨营养生长期叶片光响应曲线的拟合可以看出,实测值初期的Pn伴随PAR上升迅速上升,达到一定程度后(该点应为LSP),Pn值基本保持稳定.由直角双曲线模型拟合的营养生长期泽泻蕨叶片的光响应曲线可以看出,总体上泽泻蕨叶片的Pn变化初期随PAR的增强而迅速增大,同时增幅逐渐减弱,这一趋势与实测值相似.然而在 PAR为0 ~ 40 μmol·m-2·s-2阶段,拟合值远远低于实测值,此外,伴随着实测值达到LSP,实测值不再变化,而拟合值仍呈缓慢上升趋势,400 μmol·m-2·s-2至 1600 μmol·m-2·s-2阶段,拟合值明显高于实测值,且拟合曲线不能给出LSP.非直角在双曲线模型和修正的双曲线模型拟合的营养生长期泽泻蕨叶片的光响应曲线整体效果较好,变化趋势与实测值基本相同,但非双曲线模型仍然不能给出LSP.
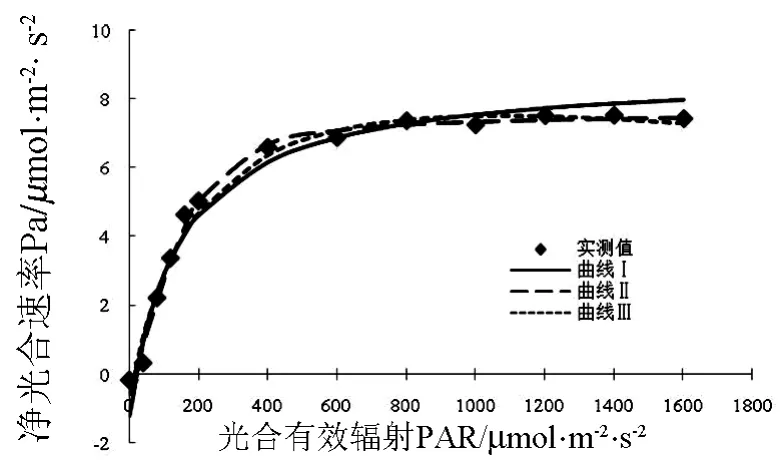
图2 泽泻蕨生殖生长期叶片光响应曲线
泽泻蕨生殖生长期叶片光响应曲线的拟合可以看出,实测值的变化初期Pn伴随PAR上升迅速上升,达到一定程度后(该点应为LSP),Pn不再变化.由直角双曲线模型拟合的生殖生长期泽泻蕨叶片的光响应曲线可以看出,泽泻蕨叶片的Pn变化初期随PAR的增强而迅速增大,同时增幅逐渐减弱,这一趋势与实测值相似.然而伴随着实测值达到LSP,实测值不再变化,而拟合值仍呈缓慢上升趋势,1200 μmol·m-2·s-2至1600 μmol·m-2·s-2阶段,拟合值明显大于实测值,且拟合曲线不能给出LSP.非直角在双曲线模型和修正的双曲线模型拟合的营养生长期泽泻蕨叶片的光响应曲线整体效果较好,变化趋势与实测值基本相同,但非双曲线模型仍然不能给出LSP(见表1).

表1 泽泻蕨营养生长期和生殖生长期叶片光响应曲线参数
综合分析三种常用的光曲线拟合模型对泽泻蕨营养生长期和生殖生长期叶片的光响应曲线拟合效果,三种模型均能拟合出与实测值较为相符的曲线.其中直角双曲线模型的拟合值与实测值相对差异较大,且不能给出光饱和点;非直角双曲线模型能够拟合出与实测值较为相符的拟合值,但仍不能给出LSP;而双曲线修正模型既能给出良好的拟合值,又克服了前两者不能给出LSP的缺点.光曲线拟合模型的决定系数(R2)大小可以用来判断拟合模型的精确性,该试验中,直角双曲线拟合模型对营养生长期叶片和生殖生长期叶片的拟合的决定系数分别为0.6905和0.9741,认为对营养生长期叶片的拟合不够精确[11].非直角双曲线模型和双曲线修正模型对两种叶片的拟合决定参数在0.9841~0.9961之间,表明着两种模型对泽泻蕨叶片的光响应曲线的拟合能力比较好.双曲线修正模型对两种叶片能够给出LSP,因此该文以下对营养生长期和生殖生长期两种叶片光响应曲线相关参数的分析与讨论均选取双曲线修正模型的拟合参数进行讨论.
2.5 泽泻蕨叶片营养生长期与生殖生长期的光响应曲线与相关参数
泽泻蕨叶片在营养生长期与生殖生长期的光响应曲线变化趋势基本相同,前期Pn随PAR的增加逐渐升高,到达LSP后,Pn保持稳定,不再随PAR的增加而变化.营养生长期的表观光量子效率α高于生殖生长期,Pmax和LSP均大于生殖生长期,LCP和Rd与生殖生长期基本相同.
3 结论与讨论
非直角双曲线模型与双曲线修正模型较直角双曲线模型引入了更多的未知参数,拟合精确度明显高于后者,这一点由决定参数R2也能证明.直角双曲线模型拟合得到的Pmax明显大于实测值;非直角双曲线模型引入了凸度θ的概念,更好的反映了光曲线的弯曲程度,拟合所得的Pmax较实测值仍较高,且它的方程与直角双曲线模型的方程都不具有极值,因此不能给出LSP,双曲线修正模型是由叶子飘结合上述两种双曲线模型及其他模型的优缺点进一步推导出的新的拟合模型,克服了拟合值与真实值差异较大的缺点,且该模型有极值,能便捷的给出LSP,也因此该模型还能够反映出LCP点附近的表观光量子效率α变化,降低了α的误差导致的比较困难[12-13].该实验中,泽泻蕨营养生长期与生殖生长期泽泻蕨叶片的Pmax、α、LSP、LCP等参数与实测值的契合度均显示双曲线修正模型的拟合效果较其他两种模型更好,这与朱永宁对干旱胁迫下玉米光响应曲线模型的比较[14]及徐伟洲对不同水肥条件下白羊草的光响应曲线的研究[15]中得到的结果是一致的.
泽泻蕨叶片在营养生长期α高于生殖生长期,表明营养生长期叶片在弱光条件下具有更好的光合能力[16];同时营养生长期叶片的LSP和Pmax小于生殖生长期,或是由于孢子等生殖相关组织的形成需要大量的有机物和能量,诱导植物体进行大规模的光合作用,增加碳水化合物的累积,这与李友军对小麦灌浆期碳水化合物的含量显著上升[17]以及路苹对切花百合花芽分化期鳞茎碳水化合物含量上升[18]的结论相一致.
[1]Zhang X C,L B,W C Taylor.Parahemionitis cordata Fraser-Jenkins.In:Flora of China Editorial Committee.Flora of China St Louis:Missouri Botanical Garden Press,2013.
[2]Joshi P R,Harisha C R,Bupesh R P.Regionally accepted popular source of Ayurvedic medicinal plants in Southern India[J].Int J of Pharm & Life Sci(IJPLS),2011,2(10):1123-1132.
[3]Sahayaraj K,Francis Borgio J,Raju G.Antifungal activity of three fern extracts on causative agents of groundnut early leaf spot and rust diseases.Journal of Plant Protection Research,2009,49(2):141–144.
[4]Fraser-Jenkins C R.New species syndrome in indian pteridology and the ferns of Nepal[M].Dehra Dun(India):International Book Distributors,1997.
[5]Kumudhavalli M,Jaykar B.Pharmacological Screening on Leaves of the Plant of Hemionitis arifolia(Burm).T Moore[J].Res J Pharma Bio Chem Sci,2012,3(2):79–83.
[6]冯志立,冯玉龙,曹坤芳.光强对砂仁叶片光合作用光抑制及热耗散的影响[J].植物生态学报,2002(1):77-82.
[7]秦玉芝,邢铮,邹剑锋,等.持续弱光胁迫对马铃薯苗期生长和光合特性的影响[J].中国农业科学,2014(3):537-545.
[8]韩瑞锋,李建明,胡晓辉,等.甜瓜幼苗叶片光合变化特性[J].生态学报,2012,32(5):1471-1480.
[9]叶子飘,于强.光合作用光响应模型的比较[J].植物生态学报,2008,32(6):1356–1361.
[10]叶子飘,于强.一个光合作用光响应新模型与传统模型的比较[J].沈阳农业大学学报,2007,38(6):771-775.
[11]张中峰,黄玉清,莫凌,等.岩溶植物光合-光响应曲线的两种拟合模型比较[J].武汉植物学研究,2009,27(3):340-344.
[12]叶子飘,李进省.光合作用对光响应的直角双曲线修正模型和非直角双曲线模型的对比研究[J].井冈山大学学报:自然科学版,2010,31(3):38–44.
[13]叶子飘.光合作用对光响应新模型及其应用[J].生物数学学报,2008,23(4):710–716.
[14]朱永宁,张玉书,纪瑞鹏,等.干旱胁迫下3种玉米光响应曲线模型的比较[J].沈阳农业大学学报,2012,43(1):3-7.
[15]李威.东北红豆杉幼树和幼苗光合生理适应性研究[D].哈尔滨:东北林业大学,2012.
[16]徐伟洲,徐炳成,段东平,等.不同水肥条件下白羊草光合生理生态特征研究Ⅱ.光响应曲线[J].草地学报,2010,18(6):773–779.
[17]李友军,熊瑛,骆炳山.不同类型小麦籽粒灌浆期碳水化合物代谢及相关酶活性研究[J].西北农林科技大学学报:自然科学版,2006,34(1):13–19.
[18]路苹,郭蕊,于同泉,等.切花百合鳞茎花芽形态分化期碳水化合物代谢变化[J].北京农学院学报.2003,18(04):259-261.
