加味黄芪建中汤对脾虚证肺癌小鼠肿瘤转移及HIF-1α、V-ATPase c mRNA表达的影响
2015-09-06包素珍张誉引
包素珍,陈 淇,张誉引
(浙江中医药大学,浙江杭州310053)
肺癌是一种严重危害人类健康的疾病。据统计,中国的肺癌发病率及死亡率均居恶性肿瘤中的第一位[1],且呈逐年递增态势[2]。目前患者的 5 年生存率仍然过低,易发生肿瘤转移,而肿瘤转移是治疗失败及患者死亡的首要原因[3]。肿瘤的侵袭、转移与多种基因突变、分子通路改变有关,更是与其乏氧酸性微环境有显著的关联[4]。临床上,我们发现脾虚证是肺癌辨证中的常见证型。在前期研究基础上,本实验对加味黄芪建中汤对脾虚肺癌小鼠肿瘤转移及HIF-1α、V-ATPase c mRNA表达的影响进行了探索,现报道如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及瘤株 C57BL/6小鼠(浙江中医药大学实验动物中心),小鼠Lewis肺癌瘤株(浙江中医药大学中医临床基础实验室提供)。
1.1.2 实验药物 加味黄芪建中汤:黄芪、白芍、桂枝、甘草、生姜、大枣、饴糖、浙贝母、白花蛇舌草、仙鹤草,经水煎、过滤、灭菌,制成含生药1.00 g/mL的药液;生大黄粉加蒸馏水,50℃水浴5 h后,经旋蒸仪于50℃负压浓缩成含生药1.00 g/mL的大黄液。上述药物均在4℃冰箱保存备用。
1.1.3 试剂与仪器 RNAiso Plus RNA提取试剂、SYBR Premix EX TaqTM Ⅱ、PrimeScriptTMRT Master Mix(大连宝生物工程有限公司),V-ATPase c、gapdh引物(上海生工生物工程技术服务有限公司),HIF-1α单克隆抗体(美国Novus Biologicals公司),山羊抗小鼠IgG/HRP聚合物(北京中杉金桥生物技术有限公司),7500型实时定量PCR仪(美国应用生物系统公司)。

表1 RT-PCR引物的序列、碱基数
1.2 实验方法
1.2.1 造模 C57BL/6雌性小鼠,30只,6~8 w龄,经3 w常规饲养适应环境,体重(20±2)g,随机取20只小鼠,采用苦寒泻下(大黄液灌胃,每日1 mL/20 g)、过度疲劳(每日强制游泳至耐力极限为止)及隔日禁食16 h建立脾虚证模型,连续14 d;其余小鼠在正常环境下饲养。取接种第14天的新鲜无坏死Lewis肺癌组织,加生理盐水制作成肿瘤细胞悬浊液,调整浓度,显微镜下计数为1×107个/mL。取0.2 mL上述悬浊液,注射于小鼠右侧腋部皮下。
1.2.2 分组及给药 瘤株接种后,将小鼠分为肺癌对照组、脾虚肺癌组、脾虚肺癌治疗组,每组10只。脾虚肺癌治疗组以加味黄芪建中汤灌胃,每日0.4 mL/20 g;肺癌对照组、脾虚肺癌组以等量生理盐水灌胃。
1.2.3 指标检测 观察并记录小鼠整体状态变化,如精神、活动、大便、体重、毛发等,接种瘤株后第10天处死,取肺脏,压片法计肺结节数。无菌剥取瘤块,RT-PCR法检测V-ATPase c mRNA表达,Power Vision法检测HIF-1α的表达,用Image-Pro Plus 6.0测量阳性反应物的累积光密度(IOD)。
1.3 统计学方法
用SPSS 17.0统计软件分析,计量资料采用均数±标准差(±s)进行统计描述,组间比较采用t检验、单因素方差分析等。均采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般状态
造模第2天起,小鼠出现便溏;第5天起,出现蜷缩、扎堆、弓背;第7天起,出现明显的体重下降,游泳时间缩短;第13天起,见毛发稀疏发黄,无光泽。符合脾虚证模型标准。
2.2 各组肺转移结节数比较
与肺癌对照组比较,脾虚肺癌组肺转移结节数增多(P<0.05);与脾虚肺癌组比较,脾虚肺癌治疗组肺转移结节数减少(P<0.01)。结果见表2。
2.3 各组肿瘤组织中HIF-1α阳性表达累积光密度(IOD)值、V-ATPase c/gapdh基因表达比较
表2 各组肺转移结节数比较 (±s)
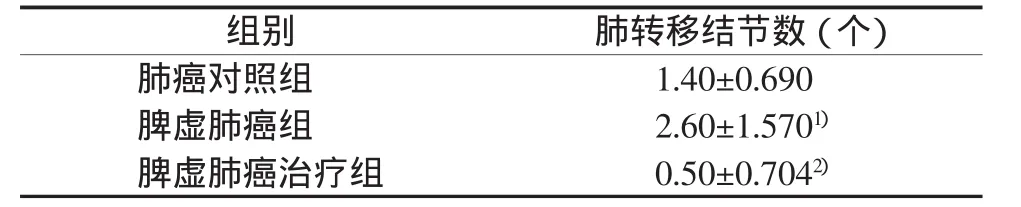
表2 各组肺转移结节数比较 (±s)
注:与肺癌对照组比较,1)P<0.05;与脾虚肺癌组比较,2)P<0.01
组别 肺转移结节数(个)肺癌对照组 1.40±0.690脾虚肺癌组 2.60±1.5701)脾虚肺癌治疗组 0.50±0.7042)
结果见表3。
表3 各组肿瘤组织中HIF-1α阳性表达累积光密度值比较(±s)

表3 各组肿瘤组织中HIF-1α阳性表达累积光密度值比较(±s)
注:与肺癌对照组比较,1)P<0.05,2)P<0.01;与脾虚肺癌组比较,3)P<0.01
组别 HIF-1α阳性表达累积光密度值 V-ATPase c/gapdh肺癌对照组 6693.77±3577.010.02832±0.01060脾虚肺癌组 13443.40±5645.172) 0.05699±0.014241)脾虚肺癌治疗组 4208.46±2454.782)3) 0.05703±0.017881)
HIF-1α阳性表达于肿瘤细胞的细胞质和(或)细胞核,阳性细胞主要出现在肿瘤组织边缘。肿瘤坏死组织呈假阳性,正常组织呈阴性。由表3可见,与肺癌对照组比较,脾虚肺癌组HIF-1α阳性表达IOD值升高(P<0.01),脾虚肺癌治疗组HIF-1α阳性表达IOD值降低(P<0.01);与脾虚肺癌组比较,脾虚肺癌治疗组HIF-1α阳性表达IOD值降低(P<0.01)。与肺癌对照组比较,脾虚肺癌组、脾虚肺癌治疗组VATPase c/gapdh比值升高(P<0.05);与脾虚肺癌组比较,脾虚肺癌治疗组V-ATPase c/gapdh比值升高,但差异无统计学意义。
3 讨论
实体肿瘤的生长过程中,微环境会因肿瘤细胞增殖迅速而始终处于乏氧状态,并使得糖酵解增强,产生大量酸性代谢产物,呈酸性微环境[5]。因此,乏氧和酸性是肿瘤微环境的重要特征,并为肿瘤细胞增殖、侵袭、转移提供条件[6]。细胞乏氧反应中,HIF-1α处于核心控制地位[7]。HIF-1α上调后,可通过上调细胞运动、基质降解,下调细胞黏附分子表达等环节,促进实体瘤的侵袭与转移[8]。孙国贵等[9]分析 1488例非小细胞肺癌病理及临床资料,发现在非小细胞肺癌中HIF-1α呈高表达,且随着过表达的增加,肿瘤转移范围随之广泛。
V-ATPase广泛存在于真核细胞的胞膜系统中,能逆浓度梯度地将H+转运到细胞外[10],是肿瘤细胞在酸性微环境中侵袭、转移的重要pH调节机制。VATPase c是位于V-ATPase V0功能区的亚基,主要功能是负责氢离子转运,是维持V-ATPase活性及功能的重要蛋白。而V-ATPase活性与肿瘤侵袭、转移密切相关[11],V-ATPase c 高活性可上调 MMP-2 分泌,增强肿瘤细胞的浸润能力;同时V-ATPase活性增加,导致肿瘤微环境酸化,是结缔组织胶原纤维降解的重要机制之一,促进了肿瘤的侵袭与转移。
本实验通过复因素法建立脾虚小鼠模型,接种Lewis肺癌,以加味黄芪建中汤治疗。可知脾虚证肺癌小鼠的HIF-1α、V-ATPase c mRNA的表达上调,肺转移结节数增多,提示脾虚证加重了小鼠的肺癌微环境中的乏氧及酸性情况,促进肺癌的转移。予加味黄芪建中汤后,HIF-1α的阳性表达明显下降,且优于肺癌对照组,说明加味黄芪建中汤能改善肿瘤微环境中的乏氧状态,与李恒楠等[12]通过健脾法治疗脾虚证肺癌小鼠下调HIF-1α mRNA表达相符合;健脾抗癌治疗后,肺转移结节数明显下降,与艾叶盛等[13]运用黄芪建中汤抑制脾虚证肺癌小鼠肿瘤转移相符合。V-ATPase c mRNA在脾虚肺癌组和脾虚肺癌治疗组中表达无差异,考虑有以下几种可能:①加味黄芪建中汤不能下调V-ATPase c mRNA的表达及改善酸性微环境。②脾虚证肿瘤微环境及加味黄芪建中汤对肿瘤的影响,是与多种基因的表达及分子通路改变有关,可能有其他基因表达或通路改变影响了V-ATPase c mRNA的表达。③当VATPase c的活性受到抑制时,肿瘤细胞内的H+蓄积过多,pH值下降,反射性地诱导V-ATPase c mRNA的表达上调[14]。④加味黄芪建中汤的作用与V-ATPase c mRNA的表达存在一定的时间差,基因表达具有时间特异性和空间特异性。⑤V-ATPase的各级结构及蛋白间作用复杂,受多种因素调节。其具体原因,有待进一步实验研究。
诊治上采用辨证辨病相统一,针对脾虚证型,以黄芪建中汤健脾补虚;针对肺癌疾病特点,加浙贝母软坚散结,白花蛇舌草解毒抑瘤,辅以仙鹤草补虚抗癌,全方健脾解毒扶正抗癌,抑制肿瘤转移,其机制可能与改善因脾虚证而加重的乏氧微环境状态有关。
[1]赫捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:28-31.
[2]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):134.
[3]Finger E C,Giaccia A J.Hypoxia,inflammation,and the tumor microenvironment in metastatic disease[J].Cancer Metastasis Rev,2010,29(2):285-293.
[4]Lunt S J,Chaudary N,Hill R P.The tumor microenvironment and metastatic disease[J].Clin Exp Metastasis,2009,26(1):19-34.
[5]Estrella V,Chen T,Lloyd M,et al.Acidity generated by the tumor microenvironment drives local invasion[J].Cancer Res,2013,73(5):1524-1535.
[6]Quail D F,Joyce J A.Microenvironmental regulation of tumor progression and metastasis[J].Nat Med,2013,19(11):1423-1437.
[7]Chowdhury R,Candela-Lena J I,Chan M C,et al.Selective small molecule probes for the hypoxia inducible factor(HIF)prolyl hydroxylases[J].ACS Chem Biol,2013,8(7):1488-1496.
[8]赵航,刘东屏.HIF-1α 与实体性肿瘤发生及临床关系的研究进展[J].现代肿瘤医学,2013,21(9):2134-2137.
[9]孙国贵,胡万宁,王雅棣,等.HIF-1α 蛋白在非小细胞肺癌中表达的 Meta分析[J].临床肿瘤学杂志,2012,17(10):894-898.
[10]Tirtom N E,Okuno D,Nakano M,et al.Mechanical modulation of ATP-binding affinity of V1-ATPase[J].J Biol Chem,2013,288(1):619-623.
[11]Pérez-Sayáns M,Somoza-Martín J M,Barros-Angueira F,et al.V-ATPase inhibitors and implication in cancer treatment[J].Cancer Treat Rev,2009,35(8):707-713.
[12]李恒楠,包素珍.加味四君子汤对lewis肺癌小鼠缺氧诱导因子-1α基因,CXC型趋化因子受体4基因及D-木糖的影响[J].长春中医药大学学报,2013,29(6):955-957.
[13]艾叶盛,包素珍.黄芪建中汤抑制脾气虚证肺癌小鼠肿瘤转移的实验研究[J].山西中医学院学报,2013,14(2):16-18.
[14]Parks S K,Chiche J,Pouysségur J.Disrupting proton dynamics and energy metabolism for cancer therapy[J].Nat Rev Cancer,2013,13(9):611-623.
