miR-122在骨髓间充质干细胞治疗大鼠急性肝损伤中的作用
2015-09-05赵民学李柏文王德盛
赵民学,李柏文,王德盛,曹 宏
(1.吉林医药学院附属医院普外科,吉林 吉林132013;2.第四军医大学西京医院肝胆外科,陕西 西安710032;3.吉林大学中日联谊医院普外3科,吉林 长春130033)
miR-122在骨髓间充质干细胞治疗大鼠急性肝损伤中的作用
赵民学1,李柏文1,王德盛2,曹宏3
(1.吉林医药学院附属医院普外科,吉林 吉林132013;2.第四军医大学西京医院肝胆外科,陕西 西安710032;3.吉林大学中日联谊医院普外3科,吉林 长春130033)
目的:探讨miR-122在骨髓间充质干细胞(BMSCs)治疗大鼠急性肝损伤中的作用,阐明相关作用机制。方法:密度梯度离心法分离收集雄性大鼠的BMSCs,分为转染组和对照组,其中转染组BMSCs采用脂质体介导转染miR-122 mimics,对照组BMSCs未接受转染。将60只四氯化碳(CCl4) 诱导的急性肝损伤大鼠随机分为肝损伤对照组(静脉注射生理盐水)、普通治疗组(静脉移植普通BMSCs)和实验治疗组(静脉移植转染miR-122的BMSCs)(n=20)。移植细胞后1、7和14 d检测大鼠肝功能,肝组织行HE染色观察其病理学改变。结果:转染miR-122 mimics后 7 d,BMSCs中白蛋白(ALB)表达水平明显上调,而甲胎蛋白(AFP)的表达水平则明显下调。移植细胞后1 d,与普通治疗组比较,实验治疗组血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)活性差异无统计学意义(P>0.05);移植细胞后7和14 d时,实验治疗组大鼠血清ALT和AST活性均低于普通治疗组(P<0.05);HE染色,实验治疗组大鼠肝脏充血、细胞质内空泡变性及肝细胞坏死情况明显好于普通治疗组。结论:上调BMSCs中miR-122表达水平能够促进其分化为肝样细胞,并可明显改善CCl4所致大鼠肝脏损伤。
骨髓间充质干细胞;miR-122;细胞移植;肝损伤
目前,对于长期肝损伤引起的肝纤维化及各种终末期肝病尚无十分便捷有效的治疗手段[1]。肝移植效果确切,但是存在诸如器官来源短缺、费用昂贵、需长期服用抗排斥药物等不足[2]。干细胞再生医学研究[3]显示:具有多向分化潜能的间充质干细胞在肝损伤修复中发挥重要作用。miR-122为成熟肝细胞特异性高表达的小RNA。研究[4]显示:miR-122在肝细胞生长、成熟、分化以及肝细胞表型的维持等多个生物学过程中起重要的调控作用。本研究通过分离收集骨髓间充质干细胞(bone marrow derived stem cells, BMSCs),转染miR-122 mimics,上调BMSCs中miR-122表达水平,观察miR-122在BMSCs治疗大鼠急性肝损伤中的作用,为终末期肝病的治疗提供新策略。
1 材料与方法
1.1实验动物、主要试剂和仪器健康雄性SD大鼠,体质量(250±20)g,购于上海国家啮齿类实验动物种子中心,动物合格证号:医动字第 19-020号。四氯化碳(CCl4)购于国药集团化学试剂有限公司;miR-122 mimics购自上海吉玛制药技术有限公司,miR-122 mimics序列:上游引物,5′-UGGAGUGUGACAAUGGUGUUUG-3′, 下游引物,5′-AACACCAUUGUCACACUCCAUU-3′;L-DMEM培养基、胎牛血清购于美国Gibco公司;TaqMan MicroRNA Assay、Isolation Kit和mirVanaTMmiRNA Isolation Kit购自美国Ambion公司;miR-122及U6引物序列购于上海捷瑞生物工程有限公司。微量高速离心机(德国Eppendorf公司),COBAS INTEGRA 400 Plus全自动生化分析仪(瑞士Roche公司),ABI PRISM 7900 实时荧光定量PCR仪(美国ABI公司)。
1.2大鼠BMSCs的分离和培养所有SD大鼠均在室温、相对湿度65%~75%条件下饲养,自由进食水,喂养7 d后用于实验。于无菌条件下抽取实验大鼠股骨中骨髓1 mL,立即置于装有肝素的离心管中,2 000 r·min-1(离心半径为11.3 cm)离心10 min后弃上清。3 mL L-DMEM培养液重悬后缓慢加入6 mL大鼠淋巴细胞分离液,2 000 r·min-1离心25 min。吸取第2层悬液(含单个核细胞),所得细胞洗涤2次。用加有10%胎牛血清、100 U·mL-1青霉素、100 U·mL-1链霉素的L-DMEM重悬,调整细胞密度为1×107mL-1。
1.3细胞转染将大鼠BMSCs接种于6孔板中,培养24 h待细胞融合度约达60%后,进行BMSCs转染miR-122 mimics实验,转染按脂质体Lipofectamine 2000说明书操作。转染48 h后采用实时荧光定量PCR(RT-PCR)检测细胞miR-122表达水平。
1.4RT-PCR转染48 h后进行细胞总RNA和miRNA的提取。构建10 μL逆转录反应体系: 1×mirVanaRT Primer 1 μL,mirVana5×RT Buffer 2 μL,Arrayseript Enzme Mix 0.4 μL,25 ng RNA,加无RNA酶水至总体积10 μL。构建20 μL扩增体系:TaqMan MicroRNA Assay(20×) 1 μL,RT reaction产物 1.33 μL,TaqMan 2×Universal PCR Master Mix 10 μL,加无RNA酶水至总体积20 μL。反应条件:95℃、10 min,95℃、15 s,60℃、30 s,70℃、30 s, 共40个PCR循环。结果采用2-ΔΔCT法进行分析(CT值定义为每个反应管内的荧光信号到达设定阈值时所经历的循环数)。
1.5急性肝损伤模型构建和移植细胞植入采用0.1%CCl4蓖麻油,5 mL·kg-1腹腔内注射法制备急性肝损伤大鼠模型,每24 h重复1次。80只SD大鼠随机分为正常组、肝损伤对照组、普通治疗组和实验治疗组,每组20只。正常组:用于与各实验组肝功能等对照比较;肝损伤对照组:诱导造模48 h后,腹腔注射生理盐水;普通治疗组:诱导造模48 h后,尾静脉注射植入普通BMSCs, 每只1×106个细胞,0.2 mL;实验治疗组:诱导造模48 h后,尾静脉注射植入转染miR-122的BMSCs,每只1×106个细胞,0.2 mL。
1.6肝功能检测取每个实验组各时间点大鼠血清约1 mL,经全自动生化分析仪检测血清中丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST)活性。

2 结 果
2.1大鼠BMSCs鉴定分离、培养的细胞呈贴壁生长,细胞呈梭形,核仁明显,核浆比例大;流式细胞术检测结果:BMSCs标志物CD29和CD90为阳性表达,CD34 和CD45表达阴性,符合BMSCs细胞表型特点[5]。
2.2转染后BMSCs中miR-122表达情况RT-PCR检测结果:转染miR-122 mimics前,BMSCs中miR-122表达水平较低,为0.17 ±0.04;转染miR-122 mimics后,BMSCs中miR-122表达值为1.24 ±0.59。转染后较转染前显著升高(P<0.05)。
2.3转染miR-122后BMSCs中肝细胞标志物表达情况转染前BMSCs中AFP和ALB相对表达值分别为1.15 ±0.29和0.22 ±0.04;转染miR-122后BMSCs中AFP相对表达值为0.59 ±0.19,较转染前明显下调(P<0.05);转染miR-122后BMSCs中ALB相对表达值为0.51 ±0.22,较转染前明显上调(P<0.05)。
2.4大鼠急性肝损伤动物模型构建实验大鼠在腹腔注射0.1%CCl4蓖麻油后出现食欲和体质量下降,皮毛杂乱无光泽。造模后,肉眼观察可见肝脏充血肿胀,颜色呈暗红色,血清ALT和AST活性较造模前明显升高(P<0.01),显示大鼠急性肝损伤动物模型建立成功。
2.5各组大鼠ALT和AST活性CCl4损伤后大鼠血清ALT和AST活性明显升高。普通治疗组和实验治疗组干预后7和14 d大鼠血清ALT和AST活性均明显降低,实验治疗组大鼠血清ALT和AST活性均低于普通治疗组 (P<0.05)。见表1。
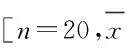
表1 各组大鼠不同时间肝功能检测结果
*P<0.05 compared with normal treatment group.
2.6各组大鼠肝组织病理学改变CCl4损伤后光镜下可见大鼠肝脏出现严重的肝血窦充血,肝细胞索排列紊乱,细胞质内空泡形成,大片实质性肝细胞坏死。与普通治疗组,实验治疗组大鼠肝脏充血、细胞质内空泡变性以及肝细胞坏死情况明显减轻。见图1(插页三)。
3 讨 论
BMSCs是一类存在于骨髓中的具有高度自我更新和多向分化能力的干细胞群体。在适合的条件刺激下,BMSCs能够分化为脂肪细胞、软骨细胞、骨骼肌细胞、神经元细胞、心肌细胞和肝细胞等成体细胞[6-7]。目前,随着对BMSCs研究的不断深入,BMSCs在组织工程和细胞移植等医学领域展现出广阔的应用前景[8]。
在我国,由于终末期肝病导致肝脏功能衰竭而死亡的患者人数居高不下。目前肝移植是挽救终末期肝病患者生命唯一有效的治疗手段。但是供肝缺乏、治疗费用昂贵,以及长期服用抗排斥药物等严重限制了肝移植的广泛应用。因此,寻找一种安全、高效、经济的治疗终末期肝病的治疗措施是目前医务工作者努力的方向。因BMSCs具有干细胞特性,目前临床上已经通过移植BMSCs治疗心肌梗死、神经系统损伤以及严重肝病,并取得一定的临床疗效[9-10]。但是,BMSCs移植入体内后,尚无法高效地分化成肝细胞并定植于肝脏,且其具体的分化、迁移和定植的相关机制目前也尚不明确。
miR-122是成熟肝细胞中特异性高表达的一种miRNA。研究[11-12]显示:miR-122在调控肝细胞发育分化、调节细胞代谢和参与肝细胞应急应答等生物学过程中发挥重要作用。最新研究[13]表明:在肝脏干细胞以及肝癌细胞等分化不成熟的细胞中,miR-122表达呈明显低水平表达;诱导这些细胞分化成熟后,miR-122表达则显著升高。因此,miR-122在正常干细胞向成熟肝细胞转化过程中起着重要的调控作用[14-15]。本研究RT-PCR结果显示:从大鼠骨髓分选出的BMSCs中miR-122呈显著低水平表达。通过人工合成miR-122 mimics并成功转染BMSCs后能导致BMSCs中miR-122表达显著升高。进一步检测显示:转染miR-122后BMSCs中ALB表达水平明显上调,而AFP表达水平则显著下调。上述结果提示通过上调BMSCs中miR-122的表达可以促进BMSCs向成熟肝细胞转化。
本研究采用CCl4诱导建立急性肝损伤大鼠模型,通过分离大鼠BMSCs并上调其miR-122的表达水平,评估移植后大鼠肝功能改善情况。本研究结果显示:同移植普通BMSCs比较,移植转染miR-122的BMSCs后大鼠肝功能改善情况更好,且肝脏组织病理切片也同肝功能检测结果一致。本文作者认为:可能是由于上调BMSCs中miR-122表达能够促进其向成熟干细胞转化,因而移植入急性肝损伤大鼠体内能够更快地发挥肝细胞的功能效应。但是,其具体的调控机制尚待进一步研究。
综上所述,上调BMSCs中miR-122表达水平能够有效提高其对急性肝损伤的治疗作用。通过进一步探讨miR-122在BMSCs治疗急性肝损伤中的分子机制,可为急性肝损伤的治疗提供新思路。
[1]Thapar M, Russo MW, Bonkovsky HL. Statins and liver injury[J]. Gastroenterol Hepatol (NY), 2013, 9(9):605-606.[2]Yazigi NA. Long term outcomes after pediatric liver transplantation[J]. Pediatr Gastroenterol Hepatol Nutr,2013,16(4):207-218.
[3]张媛,朱英. 干细胞在肝损伤中的机制研究[J]. 中国医药科学,2015, 5(4):20-23.
[4]Bandiera S, Pfeffer S, Baumert TF, et al. miR-122—a key factor and therapeutic target in liver disease[J]. J Hepatol,2015,62(2):448-457.
[5]Wang Y, Wang J, Bai D, et al. Cell proliferation is promoted by compressive stress during early stage of chondrogenic differentiation of rat BMSCs[J]. J Cell Physiol,2013,228(9):1935-1942.
[6]Gade NE, Pratheesh MD, Nath A, et al. Molecular and cellular characterization of buffalo bone marrow-derived mesenchymal stem cells[J]. Reprod Domest Anim,2013,48(3):358-367.
[7]Hang HL, Xia Q. Role of BMSCs in liver regeneration and metastasis after hepatectomy[J]. World J Gastroenterol,2014,20(1):126-132.
[8]Liu X, Wang Z, Wang R, et al. Direct comparison of the potency of human mesenchymal stem cells derived from amnion tissue, bone marrow and adipose tissue at inducing dermal fibroblast responses to cutaneous wounds[J]. Int J Mol Med,2013,31(2):407-415.
[9]Chiba Y, Kuroda S, Osanai T, et al. Impact of ageing on biological features of bone marrow stromal cells (BMSC) in cell transplantation therapy for CNS disorders: functional enhancement by granulocyte-colony stimulating factor (G-CSF)[J]. Neuropathology,2012,32(2):139-148.
[10]Kuroda S. Transplantation of autologous bone marrow stromal cells (BMSC) for CNS disorders —Strategy and tactics for clinical application[J]. J Stem Cells Regen Med,2010,6(3):167-170.
[11]Roderburg C, Benz F, Vargas CD, et al. Elevated miR-122 serum levels are an independent marker of liver injury in inflammatory diseases[J]. Liver Int,2015,35(4):1172-1184.
[12]Starckx S, Batheja A, Verheyen GR, et al. Evaluation of miR-122 and other biomarkers in distinct acute liver injury in rats[J]. Toxicol Pathol,2013,41(5):795-804.
[13]Zeisel MB, Pfeffer S, Baumert TF. miR-122 acts as a tumor suppressor in hepatocarcinogenesisinvivo[J]. J Hepatol,2013,58(4):821-823.
[14]Hu J, Xu Y, Hao J, et al. MiR-122 in hepatic function and liver diseases[J]. Protein Cell, 2012,3(5):364-371.
[15]Wen J, Friedman JR. miR-122 regulates hepatic lipid metabolism and tumor suppression[J]. J Clin Invest,2012,122(8):2773-2776.
Role of miR-122 in bone marrow derived stem cell therapy for acute liver injury in rats
ZHAO Minxue1, LI Bowen1, WANG Desheng2, CAO Hong3
(1.Department of General Surgery, Affiliated Hospital, Jilin Medical College, Jilin 132013, China; 2.Department of Hepatobiliary Surgery, Xijing Hospital, Fourth Military Medical University, Xi’an 710032, China; 3. Department of General Surgery, China-Japan Union Hospital, Jilin University, Changchun 130033, China)
ObjectiveTo investigatet the effects of miR-122 in the therapy of bone marrow derived stem cells (BMSCs) for acute liver injury in the rats, and to clarify the mechanism. MethodsThe BMSCs were isolated from the bone marrow of male rats by density gradient centrifugation. The BMSCs were divided into transfection group and control group. The BMSCs in transfection group were transfected with miR-122 mimics by liposome, while the BMSCs in control group were not. 60 SD rats with acute liver injury induced by 10%CCl4were randomly divided into control group (the saline was injected through mainline), normal treatment group (the normal BMSCs were injected through mainline) and experimental therapy group (the BMSCs transfected with miR-122 mimics by liposome were injected through mainline) (n=20).The liver function and tissue pathology were examined at 1 d, 7 d and 14 d after transplantation. Results The expression level of ALB in BMSCs was up-regulated, while the AFP expression level was down-regulated after the transfection of miR-122 mimics. At 1 d after transfection of BMSCs, the serum alanine aminotransferase(ALT) and aspartate aminotransferase(AST) activities had no significant difference between normal treatment group and experimental therapy group. At 7 d and 14 d after transfection of BMSCs, the serum ALT and AST activities in experimental therapy group were obviously lower than those in normal treatment group (P<0.05). The liver congestion,cytoplasm degeneration and liver cell necrosis in experimental therapy group were improved compared with normal treatment group. ConclusionThe up-regulation of miR-122 expression in BMSCs would promote its differentiation into hepatocyte like cells, which plays a role in promoting the recovery of liver injury.
bone marrow derived stem cells; miR-122; cell transplantation; liver injury
1671-587Ⅹ(2015)06-1150-04
10.13481/j.1671-587x.20150610
2015-08-18
国家自然科学基金资助课题(30872480)
赵民学(1981-),男,吉林省吉林市人,主治医师,医学硕士,主要从事普通外科疾病基础及临床治疗方面的研究。
王德盛,主任医师,博士研究生导师(Tel:029-84775259,E-mail:wangdesh@163.com);
曹宏,主任医师,硕士研究生导师(Tel:0431-84997753,E-mail:caohong1967@163.com)
R657.3
A
