全人源抗人肿瘤坏死因子α 单克隆抗体注射液对食蟹猴的长期毒性试验
2015-08-31张雅婷詹珊珊潘勇兵武汉生物制品研究所有限责任公司抗体研究室湖北武汉430207
张 囡,王 炯,张雅婷,宋 刚,詹珊珊,潘勇兵(武汉生物制品研究所有限责任公司抗体研究室,湖北武汉 430207)
全人源抗人肿瘤坏死因子α 单克隆抗体注射液对食蟹猴的长期毒性试验
张 囡,王 炯,张雅婷,宋 刚,詹珊珊,潘勇兵
(武汉生物制品研究所有限责任公司抗体研究室,湖北武汉 430207)
目的 评价全人源抗人肿瘤坏死因子α单克隆抗体(抗-hTNF-α FHMA)注射液对食蟹猴的长期毒性。方法将40只食蟹猴随机分成5组,分别为阴性对照组、阿达木单抗10 mg·kg-1对照组和抗-hTNF-α FHMA 2,10和50 mg·kg-1组,经皮下注射每周给药1次,连续给药5次,停药后恢复期4周。实验期间进行临床观察、体质量、体温、心电图、血细胞计数、凝血功能、血液生化、尿液、眼科、免疫指标、脏器及组织病理观察,同时进行血药浓度检测,分析毒代动力学参数。结果 实验期间各组食蟹猴的观察、体质量、体温、心电图参数、眼科检查、血细胞计数、凝血功能、血生化、尿液分析、淋巴细胞亚群、细胞因子、血清免疫球蛋白和血清补体等指标均未见与给药相关的具有毒理意义的改变;抗-hTNF-α FHMA和阿达木单抗均可引起食蟹猴体内产生抗药抗体,且具有中和活性。抗-hTNF-α FHMA在体内基本呈线性动力学特征。相同剂量下与阿达木单抗呈现相似的免疫原性和代谢动力学特征。结论 抗-hTNF-α FHMA未观察到不良反应的剂量为50 mg·kg-1,相当于临床拟用剂量(0.67 mg·kg-1)的75倍,表明抗-hTNF-α FHMA临床应用安全性较好。
单克隆抗体;肿瘤坏死因子α;阿达木单抗;成束猴;毒性试验
DOl:10.3867/j.issn.1000-3002.2015.06.011
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节滑膜慢性炎症为特征的全身性自身免疫病,具有明显的致残性。肿瘤坏死因子α(tumor necrosis factor α,TNF-α)是炎症通路中重要的细胞因子,在RA患者关节腔滑膜液中,TNF-α的浓度明显增高,促进炎症反应、滑膜细胞异常增殖和凋亡、血管翳生成及软骨与骨的破坏,促进RA炎症反应持续性进展[1-2]。因此,TNF-α成为治疗RA的一个有效靶点。在RA的临床治疗中,TNF抑制剂如阿达木单抗(adalimumab,Humira®)、依那西普(etanercept)和英昔单抗(infliximab)均表现出了良好的疗效,能显著减轻临床症状及体征,改善关节功能[3-7]。
本室进行了阿达木单抗的生物类似药开发,所研制的全人源抗人TNF-α单克隆抗体(fully humanized anti-hTNF-α monoclonal antibody,hTNF-α FHMA)采用重组CHO哺乳动物细胞表达系统表达、经化学成分明确的无血清培养基在生物反应器中进行流加培养(Fed-batch)、纯化及病毒灭活等工艺进行制备,拟皮下注射用于RA等自身免疫性疾病的治疗。抗-hTNF-α FHMA以2,10和50 mg·kg-1每周1次皮下注射,连续给予食蟹猴4周后,观察可能出现的毒性反应、末次给药后4周毒性反应的恢复情况及可能出现的延迟毒性反应[8-10],同时与原研药阿达木单抗注射液进行比较,为抗-hTNF-α FHMA的临床研究提供动物实验资料。
1 材料与方法
1.1 动物、试剂和仪器
普通级食蟹猴40只,雌雄各半,购自广西雄森灵长类实验动物养殖开发有限公司,实验动物生产许可证号:SCXK(桂)2011-0002,实验动物质量合格证编号:0002815和0002816。ADVIA 2120全自动血球分析仪购自德国Bayer公司;CA-500全自动血凝分析仪购自日本SYSMEX公司;TBA-120FR全自动生化分析仪购自日本东芝公司;EasyLyte电解质分析仪购自美国Medica公司;Clinitek AdvantusTM尿液分析仪购自德国西门子公司;BD FACSCalibur流式细胞仪和Cytometric Bead Array(CBA)试剂盒购自美国BD公司;ELISA IgG试剂盒、ELISA IgM试剂盒和ELISA IgA试剂盒均购自美国ADI公司;ELISA C3试剂盒和C4试剂盒均购自上海瓦兰生物科技有限公司。
1.2 药品和对照品
抗-hTNF-α FHMA注射液由武汉生物制品研究所有限责任公司生产,批号20130402;原研药对照品阿达木单抗注射液由雅培公司生产,批号17293LX02;阴性对照品0.9%氯化钠注射液购自江苏亚邦生缘药业有限公司,批号12120302。
1.3 动物分组和给药
从储备动物中选取40只体质量相近的健康食蟹猴,随机分成5组,每组8只,雌雄各半。阴性对照组给予0.9%氯化钠注射液,原研药对照组给予阿达木单抗注射液10 mg·kg-1,实验组分别给予抗-hTNF-α FHMA 2,10和50 mg·kg-1,各组每周sc给药1次,连续给药4周,共给药5次。每组中雌雄食蟹猴的前2只于末次给药后次日解剖,后2只于4周恢复期结束后解剖。
1.4 临床观察
观察食蟹猴的精神状态、行为活动、进食情况、粪便性状、皮毛、眼、耳、口、鼻、腹部、外生殖器、肛门、四肢、足和呼吸等。给药前及给药后次日观察注射局部是否出现红斑、肿胀、溃疡和硬结等改变。
1.5 体质量和体温检测
给药前、给药后每周1次及安乐死前称量食蟹猴体质量;测量体温时间为首次给药前、药后2~4 h(第1天)、药后次日(第2天)、第3次药后2~4 h(第15天)、末次药后2~4 h(第29天)、末次药后次日(第30天)和恢复期结束。
1.6 心电图检测
测定肢体Ⅱ导联心电图,观察心率、P-R间期、Q-T间期和QRS时限,检测时间同体温测定。
1.7 眼科检查
实验前、末次给药前3 d(第26天)和恢复期结束前3 d(第54天)进行眼科检查,包括眼睑、巩膜、角膜、结膜、虹膜、瞳孔、晶状体、玻璃体和眼底。
1.8 血液学指标检测
于首次给药前、首次药后次日(第2天)、第3次药后次日(第16天)、末次药后次日(第30天)和恢复期结束(第57天)采集全血进行血细胞计数;首次给药前、第3次药后次日(第16天)、末次药后次日(第30天)和恢复期结束(第57天)检测凝血功能。
1.9 血液生化指标
于首次给药前、第3次药后次日(第16天)、末次药后次日(第30天)和恢复期结束(第57天)检测肝功能、肾功能、血糖、血脂及血电解质等指标。
1.10 尿液分析
于实验前、末次给药前3天(第26天)、恢复期结束前3天(第54天)进行尿常规检测。
1.11 免疫指标检测
1.1 1.1淋巴细胞亚群
血细胞计数的同时取血样,流式细胞仪检测CD3+淋巴细胞百分率,计算CD4+和CD8+淋巴细胞占CD3+淋巴细胞中的百分率,计算CD4+/CD8+比值,检测CD2+,CD14+,CD16+,CD20+,CD21+和CD45RA+淋巴细胞的百分率。
1.1 1.2抗药抗体检测
每次给药前、末次药后2周(第43天)和恢复期结束(第57天)采集全血分离血清,采用桥联ELISA法检测特异性IgG抗体。将抗-hTNF-α FHMA/阿达木单抗稀释至5 g·L-1后包被96孔酶标板,待检血清系列稀释作为一抗,抗人TNF-α单抗用辣根过氧化物酶标记后作为二抗,显色后在波长450 nm处测吸光度(A450 nm)值。以ELISA检测自身给药前1∶100稀释血清得的A450 nm值乘以1.5作为cut-off值(阳性/阴性判定值),如给药组动物血清的A450 nm值≥cut-off值,判定为抗体阳性,否则为阴性。
1.1 1.3抗药抗体中和活性检测
部分食蟹猴产生抗药抗体,取抗体滴度较高的5只食蟹猴,将其首次给药前(第1天)及末次给药前(第28天)血清进行抗体中和活性检测。取生长状态良好的L929细胞,0.25%胰酶消后,以1.5× 108L-1细胞密度平铺96孔细胞培养板,培养24 h;将待测血清用1 mg·L-1阿达木单抗溶液进行系列稀释,稀释后的溶液与4 μg·L-1rhTNF-α溶液等体积混合,加入L929细胞,培养24 h后甲紫染色,酶标仪测定A570 nm值,抗药抗体中和活性与A570 nm值呈负相关。
1.1 1.4细胞因子检测
首次给药前、末次药后次日(第30天)和恢复期结束(第57天)采集静脉血,分离血清。采用CBA试剂盒进行血清中白细胞介素(interleukin-2,IL-2),IL-4,IL-5,IL-6,TNF-α和干扰素γ(interferon-γ,IFN-γ)含量的检测分析。
1.1 1.5血清免疫球蛋白检测
首次给药前、末次药后次日(第30天)和恢复期结束(第57天)采集静脉血,分离血清。采用市售ELISA IgG,IgM和IgA试剂盒检测血清IgG,IgM和IgA含量。
1.1 1.6血清补体检测
首次药前、末次药后次日(第30天)和恢复期结束(第57天)采集静脉血,分离血清。采用市售ELISA C3和C4试剂盒检测血清中C3和C4补体含量。
1.12 系统解剖和组织病理观察
每组每性别的前2只食蟹猴于末次药后次日(第30天)实施安乐死,每组每性别其余2只食蟹猴经4周恢复期观察后在第57天实施安乐死。所有安乐死食蟹猴进行大体解剖观察,主要脏器称重,计算脏器系数,并对40余种组织器官进行组织病理检查。
1.13 毒代动力学分析
阴性对照组食蟹猴于首次和第4次给药前及药后4 h采血。其余4组食蟹猴分别于首次给药前、药后4,24,48,72,96,120,144和168 h采血;第3次给药前、药后96 h(第19天)采血;第4次给药前、药后4,24,48,72,96,120,144和168 h采血及末次给药后2周(第43天)和恢复期结束(第57天)采血。抗凝血分离血浆,ELISA法检测血药浓度。rhTNF-α稀释至0.5 mg·L-1包被96孔酶标板,稀释的血浆样品作为一抗,加入工作浓度辣根过氧化物酶-羊抗人IgG作为二抗,底物显色后酶标仪测定A450/620 nm值,使用代谢动力学数据分析软件WinNonlin (V6.2)采用非房室模型法(NCA)对血药浓度数据进行分析,计算AUC,cmax和Tmax等参数。
1.14 统计学分析
2 结果
2.1 临床观察结果
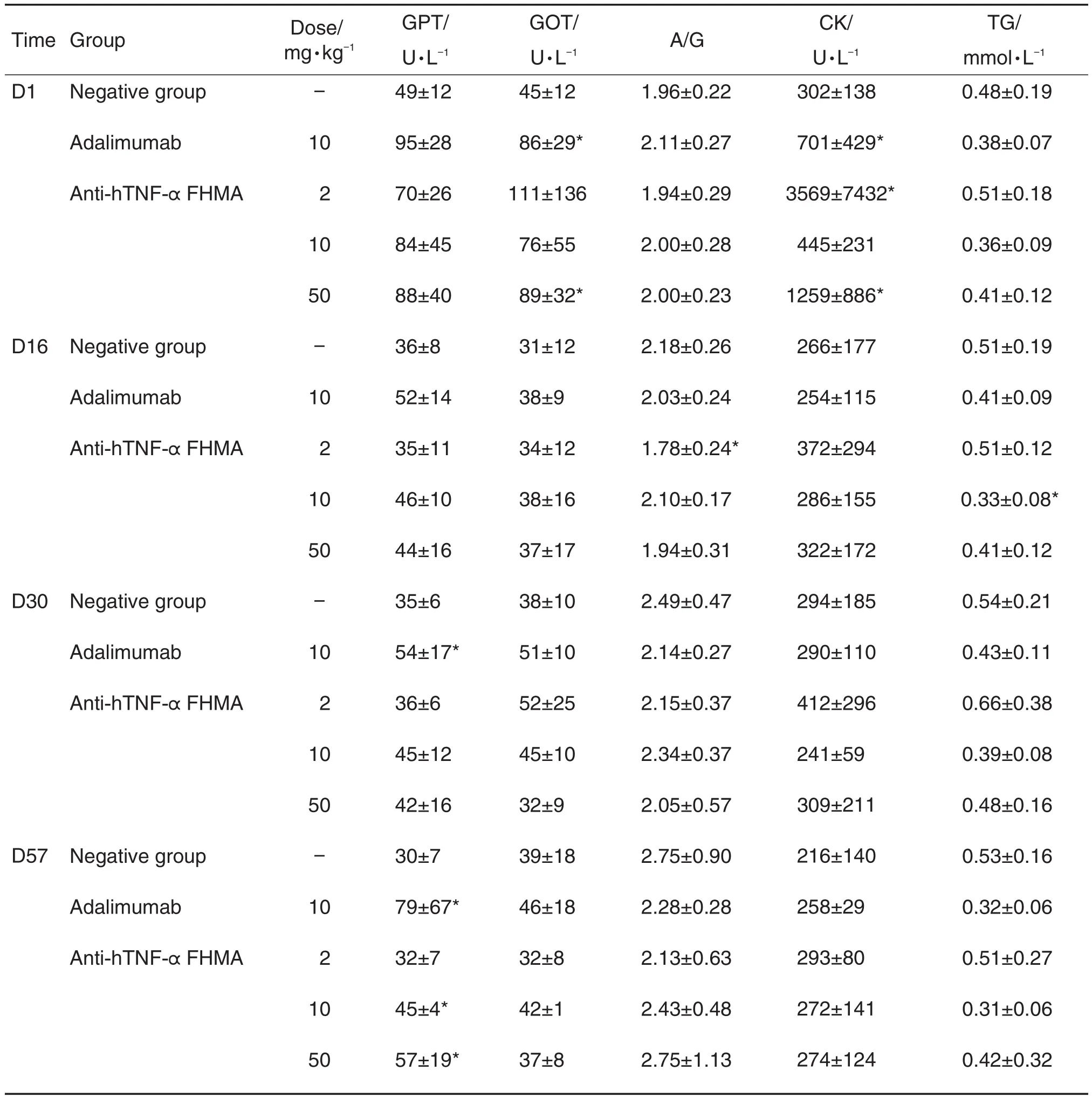
实验期间,各组食蟹猴精神状态良好,活动正常,未出现死亡或濒死现象。给药期间,阴性对照组和抗-hTNF-α FHMA 2,10和50 mg·kg-1组各有2/8,3/8,1/8和4/8食蟹猴给药局部可见红斑,认为可能是机械性刺激所致,与药物不相关。与同期阴性对照组相比,各组食蟹猴体质量均无统计学意义的差异。阿达木单抗对照组、抗-hTNF-α FHMA 2 和10 mg·kg-1组食蟹猴第2天体温分别为38.75± 0.27,38.85±0.31和(38.98±0.62)℃,与同期阴性对照组(38.03±0.38)℃相比轻微升高(P<0.05),抗-hTNF-α FHMA 50 mg·kg-1组食蟹猴第15天体温(39.30±0.32)℃与同期阴性对照组(38.63± 0.60)℃相比轻微升高(P<0.05),但这些改变轻微或在正常值范围内,不具有毒理学意义。与同期阴性对照组比较,各组食蟹猴心电图参数均未见统计学意义的差异,心电图波形未见与给药相关的明显异常改变。实验期间,各组食蟹猴的眼睑、巩膜、角膜、结膜、虹膜、瞳孔、晶状体、玻璃体和眼底均未见异常。
2.2 血液学指标检测结果
各组食蟹猴血细胞计数未见有毒理学意义的改变。尽管与阴性对照相比,抗-hTNF-α FHMA存在一些轻微但有统计学意义的改变:第30天2 mg·kg-1组单核细胞(0.51±0.15)×109L-1升高,10 mg·kg-1组红细胞容积(39.61±2.47)%降低;第57天2 mg·kg-1组平均红细胞血红蛋白浓度(MCHC)(292.5± 3.9)g·L-1降低、中性粒细胞升高(41.48±3.74)%,50 mg·kg-1组MCHC(296.8±7.3)g·L-1降低。但这些改变仍在正常值范围内,且未见明确的与给药剂量或给药时间的相关性,故认为不具有毒理学意义。与同期阴性对照组相比,各组食蟹猴凝血功能指标均未见统计学意义的差异。
2.3 血液生化指标
与同期阴性对照组相比,第30天和第57天阿达木单抗对照组谷丙转氨酶升高;第16天抗-hTNF-α FHMA 2 mg·kg-1组白蛋白/球蛋白比值降低,10 mg·kg-1组甘油三酯降低,第57天10和50 mg·kg-1组谷丙转氨酶升高(P<0.05)。甘油三酯降低幅度小且未见明确的与给药剂量或给药时间的相关性;不同时间点各给药组虽有谷丙转氨酶升高或白蛋白/球蛋白比值的降低,但未见明显的规律性改变;与肝相关的其他指标如谷草转氨酶、碱性磷酸酶、γ-谷氨酰基转移酶、总蛋白、总胆红素及肝组织病理学检查均未见明显异常改变,因此认为以上改变不具有毒理学意义。上述异常结果归纳见表1,其余指标与同期阴性对照相比均无统计学差异。
2.4 尿液分析
与同期阴性对照组和同组药前值相比,各给药组食蟹猴在末次药前和恢复期结束时的尿液指标检查未见明显异常的规律性变化。
2.5 免疫学指标
2.5.1 淋巴细胞亚群
与阴性对照组相比,抗-hTNF-α FHMA10和50 mg·kg-1组CD14+百分率于第16天降低〔(1.29±0.98)%和(1.13±1.12)%vs(2.35±0.80)%〕(P<0.05),但未见明确的与给药剂量或给药时间的相关性,且与CD14+生物学意义相关的CD16+未见明显异常改变,故认为不具有毒理学意义。
Tab.1 Effect of fully humanized anti-hTNF-α monoclonal antibody(anti-hTNF-α FHMA)on cynomolgus monkey′s partial biochemical indexes
2.5.2 抗药抗体检测
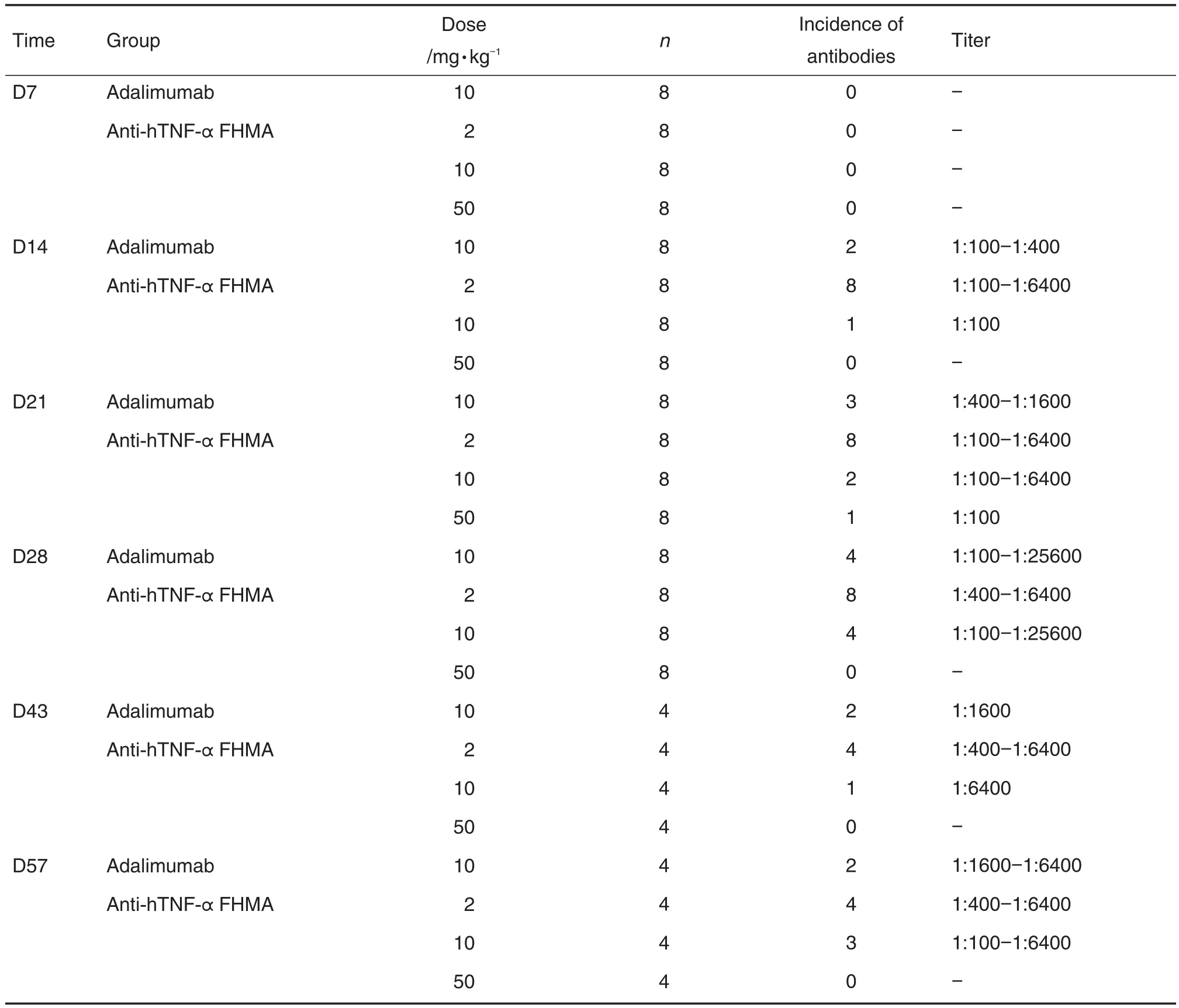
表2显示,第2次给药前(第7天),各组食蟹猴均未检测到抗药抗体;第3次给药前(第14天),阿达木单抗对照组、抗-hTNF-α FHMA 2和10 mg·kg-1组各有2/8,8/8和1/8的食蟹猴检测到抗药抗体,抗体最高滴度为1∶6400;随着给药次数的增加,检测到抗药抗体的食蟹猴数和抗体滴度有所增加,至第5次给药前(第28天),阿达木单抗对照组、抗-hTNF-α FHMA 2和10 mg·kg-1组各有4/8,8/8 和4/8的食蟹猴检测到抗药抗体,抗体最高滴度为1∶25 600;至恢复期结束时,各给药组检测到抗药抗体的动物数和抗体滴度均有所降低。抗-hTNF-αFHMA 50 mg·kg-1组仅1只食蟹猴于第4次给药前(第21天)产生低滴度抗药抗体(1∶100)。同等剂量下,阿达木单抗对照组和抗-hTNF-α FHMA组的抗药抗体产生情况基本一致。
Tab.2 Serum anti-drug antibody titers in cynomolgus monkeys of each group after anti-hTNF-α FHMA sc injection
2.5.3 抗体中和活性检测
阿达木单抗对照组食蟹猴(编号13-3600和13-3606),抗-hTNF-α FHMA 2 mg·kg-1组食蟹猴(编号13-3609和13-3614),10 mg·kg-1组食蟹猴(编号13-3617)在首次给药前血清中均无中和抗体,末次给药前血清中存在中和抗体,其中阿达木单抗组13-3600号抗药抗体于1∶1600稀释时即可完全中和阿达木单抗,13-3606号抗药抗体于1:800稀释度时开始产生中和作用;抗-hTNF-α FHMA 2 mg·kg-1组2只食蟹猴产生的抗药抗体均从1∶800稀释度开始可完全中和阿达木单抗,10 mg·kg-1组13-3617号抗药抗体于1∶1600稀释度开始出现中和作用,1∶800即可到达完全中和。图1表明食蟹猴体内产生的抗药抗体具有中和活性。
2.5.4 细胞因子检测
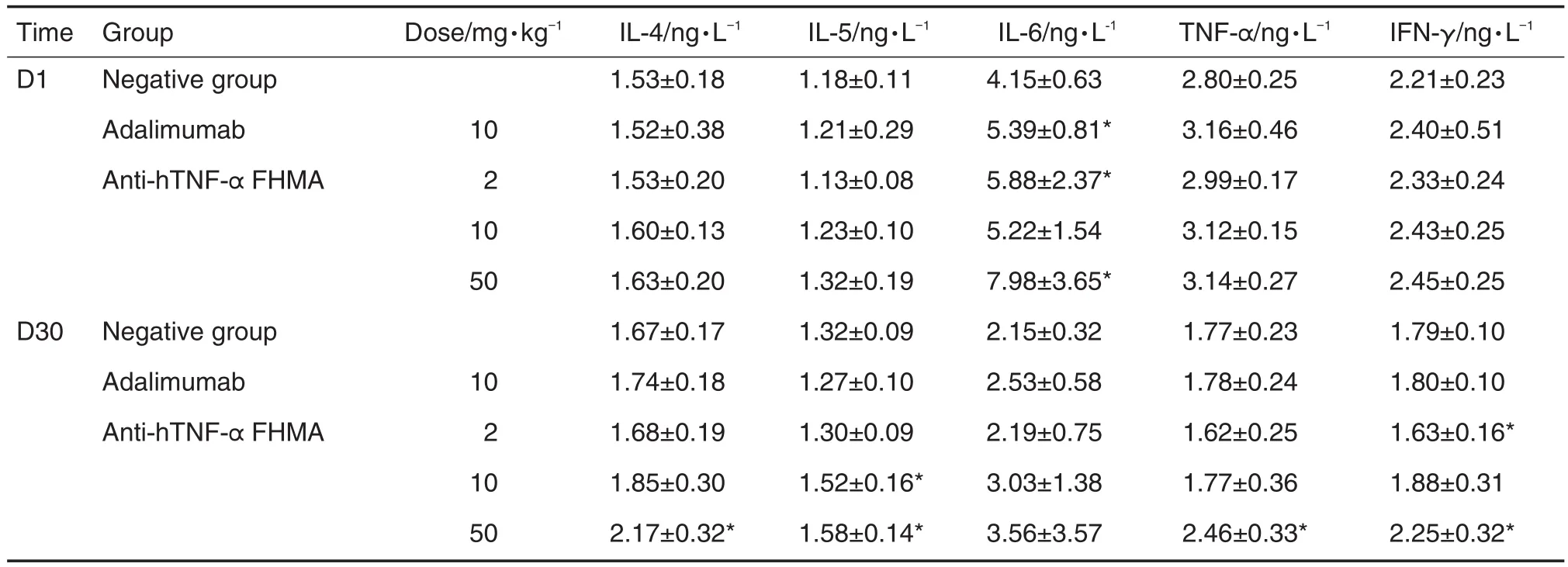
与同期阴性对照组相比,第30天抗-hTNF-α FHMA 2 mg·kg-1组IFN-γ降低,10 mg·kg-1组IL-5升高,50 mg·kg-1组IL-4,IL-5,TNF-α和IFN-γ升高(P<0.05)(表3)。但细胞因子的改变幅度小且未见明显规律性,故认为不具有毒理学意义。
2.5.5 血清免疫球蛋白检测
与同期阴性对照组相比,各组食蟹猴的IgM和IgA均未见有统计学意义的差异。抗-hTNF-α FHMA各剂量组的IgG于第30天升高(P<0.05)。由于注射的单抗为IgG1,此IgG的升高可能与本实验所给予的单克隆抗体相关。
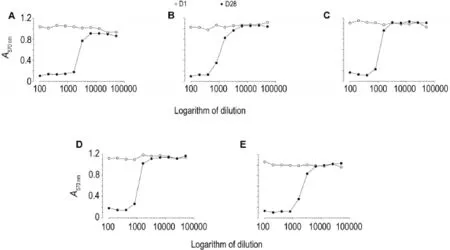
Fig.1 Neutralizing activity detection of high titer anti-drug antibody in cynomolgus monkeys.Five cynomolgus monkeys in which anti-drug antibody titers were higher were taken.A and B:animal number in adalimumab group,13-3600 and 13-3606;B,C and D:animal number in anti-hTNF-α FHMA 2 mg·kg-1group 13-3609,13-3614 and 10 mg·kg-1group 13-3617.Serum neutralizing antibodies were detected before the first sc injection(D1)and before the last sc injection(D28).
2.5.6 血清补体检测
首次给药前、末次药后次日和恢复期结束,包括阴性对照组在内的各组中均有个别食蟹猴的C3高于检测限,其余多数食蟹猴均低于检测限。各个检测时间点C4均高于检测限,但与同期阴性对照组比较均未见统计学意义的差异。
2.6 系统解剖及组织病理学观察
与同期阴性对照组相比,各组食蟹猴的脏器重量(绝对脏器重量和相对脏器重量)未见统计学意义的差异;给药4周和恢复期4周结束,大体解剖观察和显微镜观察均未见药品相关性病理改变;给药4周(第30天)仅抗-hTNF-α FHMA 2 mg·kg-1组2只食蟹猴的注射局部可见与机械刺激性相关的皮下出血伴单个核细胞浸润,其余食蟹猴均未见异常改变。停药4周后(第57天),食蟹猴注射局部均未见异常改变。
2.7 毒代动力学
如图2所示,首次给药后各组食蟹猴血浆药物浓度变化基本一致,且与给药剂量呈正相关。第4次给药后抗-hTNF-α FHMA2 mg·kg-1组血浆药物浓度明显低于首次给药,50 mg·kg-1组血浆药物浓度略高于首次给药。毒代动力学参数计算结果见表4。
Tab.3 Effect of anti-hTNF-α FHMA on cynomolgus monkeys′partial cytokines detection
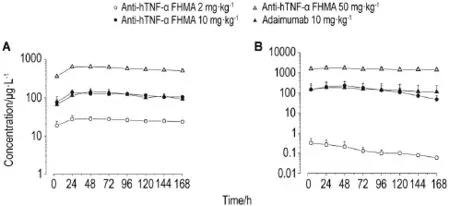
Fig.2 Average plasma drug concentration-time curves of cynomolgus monkeys after injection of anti-hTNF-α FHMA.See Tab.1 for the treatment.Plasma drug concentration detected before the first and fourth sc injection,4 h after the first and fourth sc injection in negative control group.In adalimumab 10 mg·kg-1group,and anti-hTNF-α FHMA 2,10 and 50 mg·kg-1groups,plasma drug concentration detected before and 4,24,48,72,96,120,144 and 168 h after the first sc injection,before and 96 h after the third sc injction,before and 4,24,48,72,96,120,144 and 168 h after the fourth sc injection,two weeks after the last sc injection and the end of the recovery period.A:average plasma drug concentration-time curves of each group after the first sc injection;B:average plasma drug concentration-time curves of each group after the fourth sc injection.±s,n=8.

Tab.4 Comparision of toxicokinetics parameters of adalimumab and anti-hTNF-α FHMA
3 讨论
长期毒性实验是非临床安全性评价的重要内容,可以预测药物可能引起的临床不良反应,判断受试物重复给药的毒性靶器官或靶组织,确定未观察到临床不良反应的剂量水平(NOAEL),推测临床试验的起始剂量,为后续临床试验提供安全剂量范围以及为临床不良反应监测及防治提供参考[10]。抗-hTNF-α FHMA是阿达木单抗的生物类似药,故本实验设立阿达木单抗对照组,对其进行毒性、毒代及免疫原性的对比实验研究。
一般毒理指标如观察、体质量、体温、心电图、血细胞计数、凝血功能、血液生化、尿液和眼科检查等指标均未见与抗-hTNF-α FHMA相关的异常改变。一般药理指标如动物精神状态、行为活动、体温、呼吸和心电图等均未见异常,故认为抗-hTNF-α FHMA对食蟹猴的神经系统、心血管系统和呼吸系统均无明显影响。
免疫毒性指标白细胞绝对计数及分类计数、补体、免疫球蛋白水平及白蛋白/球蛋白比值,淋巴器官/组织的大体解剖观察,胸腺、脾脏器系数,以及胸腺、脾、淋巴结、骨髓等脏器的组织学检查均未见给药相关的异常改变。淋巴细胞亚群分布以及作为Th1及Th2类细胞因子代表的IL-2,IFN-γ,IL-4,IL-5,IL-6和TNF-α检测,均未见与给药相关的规律性改变。
抗-hTNF-α FHMA和阿达木单抗在食蟹猴体内都能引起抗药抗体的产生,且产生的抗药抗体具有中和活性。抗药抗体从第3次药前(第14天)开始检测到,抗-hTNF-α FHMA 2 mg·kg-1组所有8只食蟹猴均产生抗药抗体;阿达木单抗对照组和抗-hTNF-α FHMA 10 mg·kg-1组分别有2/8和1/8食蟹猴检测到抗药抗体,抗体最高滴度分别为1∶400和1∶100,至末次药前(第28天),两组均有4/8食蟹猴检测到ADA,最高滴度均为1∶25 600,表明在10 mg·kg-1时,抗-hTNF-α FHMA和阿达木单抗注射液对食蟹猴的免疫原性相似;而50 mg·kg-1组仅1只食蟹猴于第4次给药前(第21天)产生低滴度抗药抗体(1∶100)。对于2 mg·kg-1组全部产生抗药抗体,10 mg·kg-1组和阿达木单抗对照组均半数食蟹猴产生抗药抗体,而50 mg·kg-1组仅1只食蟹猴产生抗药抗体的原因,认为可能与给药剂量有关,给药剂量越大血药浓度越高,可能干扰抗体检测结果。
同样,抗药抗体的产生也会影响血药浓度的检测结果。抗-hTNF-α FHMA首次给药后各组食蟹猴血浆药物浓度变化基本一致,且与给药剂量呈正相关。第4次给药后2 mg·kg-1组所有食蟹猴均有抗药抗体产生,血浆药物浓度明显低于首次给药;10 mg·kg-1组和阿达木单抗对照组虽然平均血药浓度变化不大,但产生抗药抗体的食蟹猴血浆药物浓度明显低于同组其他食蟹猴。抗-hTNF-α FHMA 2,10和50 mg·kg-1组给药剂量比为1∶5∶25,首次药后cmax和AUClast比分别为1∶4.79∶22.87和1∶4.61∶22.52,在体内基本呈线性动力学特征。相同剂量下(10 mg·kg-1),抗-hTNF-αFHMA 10 mg·kg-1组和阿达木单抗对照组比较毒代动力学参数无显著差异。第4次给药后由于受到抗药抗体的影响,Tmax,cmax和AUClast数值仅供参考,无法提供蓄积因子。
综上,在本实验条件下,抗-hTNF-α FHMA各剂量组食蟹猴未见明显全身毒性反应,NOAEL为50 mg·kg-1,相当与临床拟用剂量(0.67 mg·kg-1)的75倍;在2~50 mg·kg-1剂量范围内,抗-hTNF-α FHMA在体内AUC随给药剂量呈正比增加,基本呈线性动力学特征;在相同给药剂量下,抗-hTNF-α FHMA与阿达木单抗具有相似的药物代谢特征和免疫原性。
[1]Li YS,Jiang LD.The role of TNF-α and its receptors in rheumatoid arthritis[J].Fudan Univ J Med Sci〔复旦学报(医学版)〕,2010,37(2):245-249.
[2]Tracey D,Klareskog L,Sasso EH,Salfeld JG,Tak PP.Tumor necrosis factor antagonist mechanisms of action:a comprehensive review[J].Pharmacol Ther,2008,117(2):244-279.
[3]Huang F,Yang CH.The present situation of the biological inhibitor treatment of rheumatic diseases [J].Clin Med J(临床药物治疗杂志),2005,3(1):1-8.
[4]Liang LQ,Zhan ZP,Fu D,Ye YJ,Xu HS,Yang XY. Efficacy of etanercept in the treatment of r efractory rheumatoid arthritis[J].J Pract Med(实用医学杂志),2008,24(18):3229-3231.
[5]Zhang W,Shi Q,Wu DH,Bao CD,Yang NP,Li ZG,et al.Efficacy and safety of infliximab in patients with rheumatoid arthritis[J].Natl Med J China(中华医学杂志),2009,89(27):1876-1880.
[6]Breedveld FC,Weisman MH,Kavanaugh AF,Cohen SB,Pavelka K,van Vollenhoven R,et al. The PREMIER study:a multicenter,randomized,double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early,aggressive rheumatoid arthritis who had not had previous methotrexate treatment[J].Arthritis Rheum,2006,54(1):26-37.
[7]BurmesterGR, MarietteX, MontecuccoC,Monteagudo-Sáez I,Malaise M,Tzioufas AG,et al. Adalimumab alone and in combination with diseasemodifying antirheumatic drugs for the treatment of rheumatoid arthritis in clinical practice:the Research in Active Rheumatoid Arthritis(ReAct)trial[J]. Ann Rheum Dis,2007,66(6):732-739.
[8]CFDA.General Principles of Non-Clinical Safety Technical Evaluation about Biological Products for Treatment[S].GPT1-1.2007-01.http://www. cde.org.cn/zdyz.do?method=largePage&id=100
[9]Wang HX,Peng J,Zhang RM,Wang QL.Consideration in non-clinical safety evaluation of monoclonal antibody products[J].Chin J New Drugs(中国新药杂志),2009,18(3):199-201,205.
[10]CFDA.Guideline on Drug Toxicity Test by Repeat Administration[S].[2014-05-13].http://www.cde. org.cn/zdyz.do?method=largePage&id=192
(本文编辑:齐春会)
Long-term toxicity of fully humanized anti-human tumor necrosis factor-α monoclonal antibody for injection in cynomolgus monkeys
ZHANG Nan,WANG Jiong,ZHANG Ya-ting,SONG Gang,ZHAN Shan-shan,PAN Yong-bing
(Department of Antibody Research,Wuhan Institute of Biological Products Co.,Ltd.,Wuhan 430207,China)
OBJECTlVE To evaluate the long-term toxicity of fully human anti-human tumor necrosis factor-α monoclonal antibody(anti-hTNF-α FHMA)for injection in cynomolgus monkeys.METHODS Forty cynomolgus monkeys were randomly divided into 5 groups(4 males and 4 females in each group):negative control group,adalimumab 10 mg·kg-1group,anti-hTNF-α FHMA 2,10 and 50 mg·kg-1groups.Cynomolgus monkeys in each group were injected sc once a week for 5 consecutive times,followed by 4 weeks of recovery.During the test,general clinical observation,body mass,body temperature,electrocardiogram(ECG),hematology,coagulation function,blood biochemistry,urine,ophthalmology,immune index,and pathological changes in organs and tissues were observed.At the same time,plasma drug concentrations were detected and the toxicokinetics parameters were analyzed. RESULTSNo significant toxicological changes related to drugs were observed in general clinical observation,body mass,body temperature,ECG,ophthalmic examination,blood cell counts,coagulation function,blood biochemistry,urine analysis,lymphocyte subsets,cytokines,serum immunoglobulin,serum complement.Neutralizing anti-drug antibody(ADA)could be detected in adalimumab group and anti-hTNF-α FHMA groups.Anti-hTNF-α FHMA showed linear dynamic characteristics in cynomolgus monkeys.At the same dose(10 mg·kg-1),anti-hTNF-α FHMA had similar immunogenicity and kinetics characteristics to adalimumab.CONCLUSlON The level of anti-hTNF-α FHMA at which no adverse effect was observed was 50 mg·kg-1,which is equivalent to 75 times clinical dosage of quasi (0.67 mg·kg-1),which suggests that anti-hTNF-α FHMA be safe in clinical use.
monoclonal antibodies;tumor necrosis factor-α;adalimumab;Macaca fascicularis;toxicity tests
The project supported by National Science and Technology Major Project(2011ZX09506-005)
PAN Yong-bing,E-mail:yongbingpan@163.com
R965.3
A
1000-3002(2015)06-0945-09
国家科技重大专项(2011ZX09506-005)
张 囡,女,副研究员,主要从事治疗性单克隆抗体研发工作,E-mail:zhnan1122@163.com
潘勇兵,E-mail:yongbingpan@163.com
(2015-03-20 接受日期:2015-11-16)
