Wnt信号通路在绵羊不同大小卵泡中的表达
2015-08-25赵妙妙姜晓龙陈建伟姚晓磊李鹏飞吕丽华
赵妙妙,姜晓龙,陈建伟,黄 洋,姚晓磊,曹 霞,李鹏飞,吕丽华*
(1.山西农业大学动物科技学院,山西太谷030801;2.山西农业大学生命科学学院,山西太谷030801)
Wnt信号通路在绵羊不同大小卵泡中的表达
赵妙妙1,姜晓龙1,陈建伟1,黄洋1,姚晓磊1,曹霞1,李鹏飞2,吕丽华1*
(1.山西农业大学动物科技学院,山西太谷030801;2.山西农业大学生命科学学院,山西太谷030801)
为研究Wnt信号通路在绵羊不同大小卵泡中的表达情况,本试验选取了Wnt信号通路中的4个关键基因,利用荧光定量PCR技术检测其在绵羊大、中、小卵泡中的相对表达量。结果显示,CTNNB1、FZD6基因在大卵泡中表达相对较多,DVL1在不同大小卵泡中的表达量无明显差异,AXIN2在中、小卵泡中表达量相对较多。随着绵羊卵泡的增大,Wnt信号通路在卵泡中的表达也呈现出递增趋势,因此Wnt信号通路能够促进绵羊卵泡的发育,并且可能与雌激素的分泌有关。
绵羊;卵泡;Wnt信号通路
卵泡是哺乳动物卵巢上的基本单位。目前人们根据卵泡成腔与否,把卵泡分为无腔卵泡和有腔卵泡。无腔卵泡包括原始卵泡、初级卵泡和没有成腔的次级卵泡。有腔卵泡由四个不同部分构成:壁层细胞、颗粒细胞、卵丘细胞和卵母细胞[1]。自Wnt被发现以来,Wnt信号通路逐渐受到了人们的广泛关注。目前已知的Wnt信号通路[2~6]主要有3条:(1)经典的Wnt/β-catenin(CTNNB1)信号通路;(2)平面的细胞极性通路(planar cell polarity pathway);(3)Wnt/Ca2+通路。其中,人们对Wnt/β-catenin信号通路了解最为深刻。当细胞未受到刺激时,轴蛋白(AXIN2)结合到CTNNB1/糖原合酶激酶(CSK3)/结肠癌抑制因子(APC)复合体当中,导致CTNNB1迅速降解,信号传导通路关闭;而当经典Wnt/β-catenin信号通路被激活时,Wnt配体与受体卷取蛋白(Frizzled,FZD)以及LDL受体相关蛋白(LRP)结合形成三聚体,从而激活蓬乱蛋白(Dishevelled1,Dsh1/DVL1),使DVL1与AXIN2相结合,导致AXIN2/CSK3/APC/CTNNB1的复合体被破坏,CTNNB1无法被降解。因此,CTNNB1可以进入细胞核内,对基因的转录进行调控[7]。目前已有大量研究证明,Wnt信号通路与哺乳动物的繁殖存在密切的联系。Vainio S[8]等发现,在LH峰后的4~12 h,Wnt信号通路受体Frizzled定位于排卵卵泡的颗粒细胞上。本试验选取了Wnt信号通路中的4个关键基因,探究Wnt信号通路在绵羊不同大小卵泡中的表达情况,为Wnt信号通路功能的进一步研究奠定基础。
1 材料与方法
1.1试验动物及卵巢样品
本试验选用山西省清徐县绵羊屠宰场性成熟绵羊的健康卵巢。
1.2主要试剂
Trizol、DEPC(Invitrogen公司,美国)、固相RNase清除剂(Andybio公司,美国)、PrimeScript®RT reagent Kit With gDNA Eraser试剂盒、dNTP、DNA MarkerDL1000(Takara,大连)、SYBR®Premix Ex TaqTM II(Takara,大连)。
1.3卵泡及颗粒细胞的分离
将采集的健康卵巢放入灭菌的4℃杜氏磷酸缓冲液(DPBS)中,在2 h内送至实验室。在超净台内,用眼科剪认真分离大卵泡(卵泡直径>5 mm),中卵泡(3 mm<卵泡直径<5 mm)和小卵泡(卵泡直径<3 mm),用无菌的杜氏磷酸缓冲液(DPBS)漂洗两次。剪开卵泡并放入盛有生理盐水的小表面皿中,用刮刀轻轻刮动卵泡内壁。分别收集大、中、小卵泡的颗粒细胞,加入适量Trizol,-80℃储存,提取RNA备用。
1.4总RNA的提取及反转录
将前面-80℃的储存液从冰箱取出,用Trizol法分别提取大、中、小卵泡颗粒细胞的总RNA[10]。分别以上述提取出的RNA为模板,按照PrimeScript®RT reagent Kit With gDNA Eraser试剂盒说明,加入1 μL gDNA Eraser,2 μL 5×gDNA Eraser Buffer,2 μL RNA,RNase Free定容到10 μL。反应条件设为42℃2 min,4℃∞。之后再加入1 μL RT Primer Mix,4 μL 5×PrimeScript®Buffer 2,1 μL PrimeScript®RT Enzyme Mix I,RNase Free定容到20 μL。反应条件设为37℃15 min,85℃5 s,4℃∞。反应结束后,检测产物纯度及浓度。
1.5引物设计与合成
根据NCBI上绵羊的各目的基因的已有序列或预测序列,利用Primer 3和Oligo 6软件设计目的基因的引物;以绵羊β-Actin基因作为内参基因,引物由生工生物工程(上海)股份有限公司合成,序列信息见表1。
1.6qRT-PCR反应
以绵羊大、中、小卵泡颗粒细胞的cDNA为模板,构建20 μL qRT-PCR反应体系:SYBR®Premix Ex TaqTM II(2×)10 μL,Rox Reference Dye(50×)0.4 μL,PCR Forward/Reverse Primer(10 μmol·L-1)0.8μL,cDNA模板2.0μL,ddH2O 6 μL,反应条件为:95℃变性30 s,95℃5 s,60℃25 s,45个循环。扩增后利用其CT值分析结果。
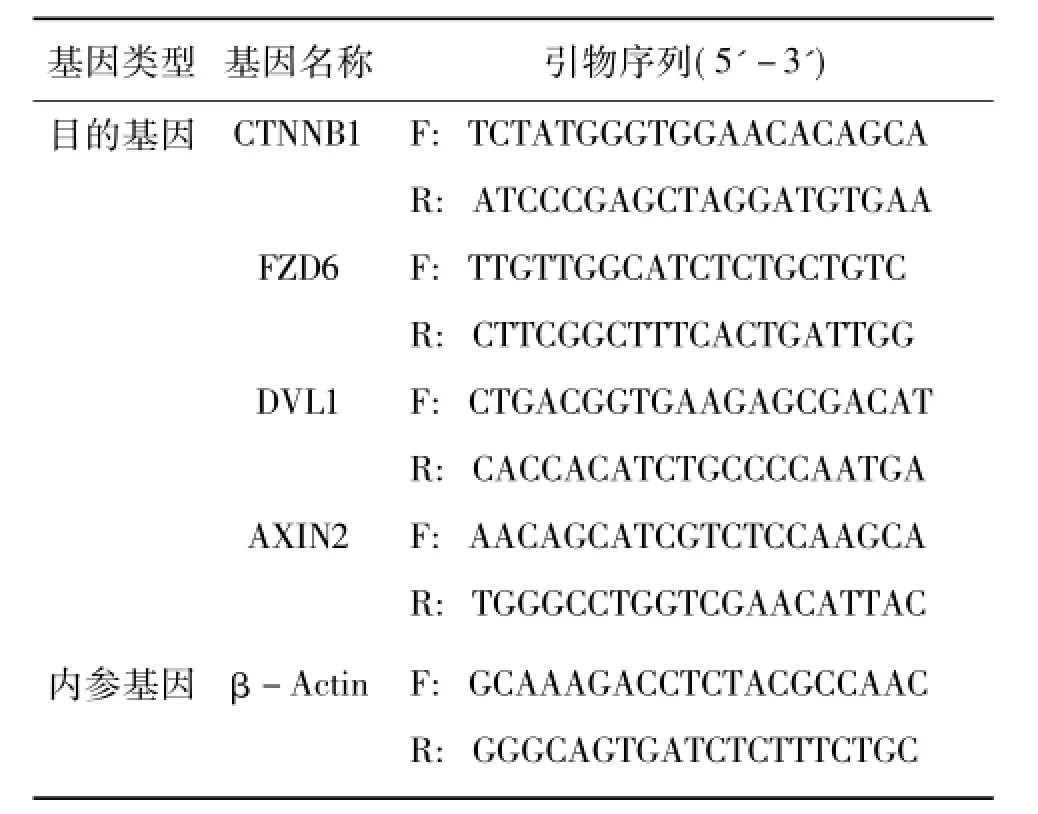
表1 R荧光定量PCR引物序列
1.7统计分析
试验数据用SPSS 18.0进行分析,采用单因素方差分析和显著性检验的方法。qRT-PCR相对表达量结果用平均值±标准差来表示,采用△△CT的计算方法,相对表达量=2-△△CT。各基因表达量均经内参β-Actin校正。
2 结果
2.1内参β-Actin及通路基因CTNNB1、FZD6、DVL1、AXIN2的扩增曲线和熔解曲线
图1为内参β-Actin及Wnt信号通路中4个关键基因CTNNB1、FZD6、DVL1、AXIN2的扩增曲线和熔解曲线。由图1中可见,各扩增曲线拐点清晰,曲线平滑,基线期及平台期较平稳,每个基因各样品的CT值都很接近,说明该试验系统误差小。各熔解曲线为单峰,即产物单一,说明该荧光定量试验可信度较高。
2.2CTNNB1、FZD6、DVL1、AXIN2在不同大小卵泡中的表达差异
利用△△CT法对CTNNB1、FZD6、DVL1、AXIN2在绵羊大、中、小卵泡颗粒细胞中的表达量进行分析,统计结果见图2。由图2可以看出CTNNB1基因在大卵泡中的表达量显著高于中卵泡和小卵泡;FZD6基因在大卵泡和中卵泡中的表达量显著高于小卵泡;DVL1基因在大、中、小卵泡中没有表现出明显差异;AXIN2基因在中卵泡和小卵泡中的表达量显著高于大卵泡。

图1 Rβ-Actin、CTNNB1、FZD6、DVL1、AXIN2基因的扩增曲线和熔解曲线

图2 RCTNNB1、FZD6、DVL1、AXIN2在不同大小卵泡中的表达差异
3 讨论
卵泡的生长机制相当复杂,众多激素和生长因子通过内分泌、自分泌及旁分泌途径调节其生长发育。Wnt信号通路可调控多种发生过程,如细胞程序性死亡、增殖、分化和凋亡等[11],目前已有大量研究证明,其在哺乳动物繁殖也存在重要作用。本试验结果显示,在Wnt信号通路中的4个关键基因中,CTNNB1和FZD6基因在大卵泡中表达相对较多,在小卵泡中表达相对较少。在Wnt信号通路中,AXIN2越多,蛋白复合体降解的CTNNB1就越多,通路发挥的作用越小。因此AXIN2在大卵泡中表达量显著少于中卵泡和小卵泡,说明通路在大卵泡中的表达高于中小卵泡。DVL1基因在大中小卵泡中的表达虽没有表现出显著地差异,但也存在逐渐下降的趋势。综上所述,随着绵羊卵泡的不断增大,Wnt信号通路在卵泡中的表达量逐渐升高,这与Gupta[12]对于Wnt信号通路在不同时期的牛卵泡发育过程中的表达研究结果一致。此外,目前已有研究证实,随着卵泡的增大,雌激素浓度在不断增加[13]。因此Wnt信号通路在绵羊大、中、小卵泡中的表达与雌激素浓度正相关,所以Wnt信号通路可能对卵泡中雌激素的分泌有影响。结论,Wnt信号通路可以促进绵羊卵泡的生长,并且可能与卵泡中雌激素的分泌有关。
[1]陈华.猪去卵丘卵母细胞体外发育能力的研究[D].合肥:安徽农业大学.2007.
[2]Wodarz A,Nusse R.Mechanisms of Wnt signaling in development[J].Annu Rev Cell Dev Biol,1998,(14):59-88.
[3]Kikuchi A,Yamamoto H,Kishida S.Multiplicity of the interactions of Wnt proteins and their receptors[J].Cell Signal,2007(19):659-671.
[4]尹定子,宋海云.Wnt信号通路调控机理和生物学意义[J].中国细胞生物学学报,2011,33(2):103-111.
[5]刘烜,王海生,刘淑萍.Wnt信号转导通路与细胞凋亡[J].内蒙古医学杂志,2011,43(1):50-53.
[6]Willert K,Brown JD,Danenberg E,et al.Wnt proteins are lipid-modified and can act as stem cell growth factors[J].Nature,2003,423:448-452.
[7]Boyer A,Goff AK,Boerboom D.WNT signaling in ovarian follicle biology and tumorigenesis[J].Trends Endocrinol Metab,2010,21:25-32.
[8]Vainio S,Heikkila M,Kispert A,et al.Female development in mammals is regulated by WNT4 signalling.Nature,1999,397:405-409.
[9]Boerboom D,Paquet M,Hsieh M,et al.Misregulated Wnt/beta-catenin signaling leads to ovarian granulosa cell tumor development[J].Cancer Res,2005,65:9206-9215.
[10]黄洋,孙晋艳,李鹏飞,等.绵羊卵泡颗粒细胞体外培养条件的优化[J].山西农业科学.2012(02).
[11]Segditsas S,Tomlinson I.Colorectal cancer and genetic alterations in the Wnt pathway[J].Oncogene,2006,25:7531-7537.
[12]Gupta P S P,Joseph K,Folger,et al.Regulation and Regulatory Role of WNT Signaling in Potentiating FSH Action during Bovine Dominant Follicle Selection[J].PLoS ONE 9(6):e100201.
[13]黄洋.绵羊卵泡颗粒细胞CART mRNA的表达及体外培养体系的优化[D].山西农业大学.2007.
S814;S826.3
A
1005-2739(2015)05-0003-04
2015-07-10
国家自然科学基金(31172211);山西省回国留学人员科研资助项目(2014-重点5);山西农业大学科研管理费资助重大项目和标志性成果培育项目(71060003)
赵妙妙(1989-),女,山西大同人,硕士研究生,研究方向:动物遗传育种与繁殖。E-mail:1203418618@qq.com
吕丽华,E-mail:sxaullh@yahoo.com.cn
