大鼠骨髓间充质干细胞的分离鉴定及免疫调节性能初探
2015-08-24张志强刘义李克秋李光
张志强,刘义,李克秋,李光
大鼠骨髓间充质干细胞的分离鉴定及免疫调节性能初探
张志强,刘义,李克秋,李光△
目的 分离培养大鼠骨髓间充质干细胞(BMSCs),鉴定其向脂肪细胞和软骨细胞的分化潜能,并探讨其免疫调节性能。方法 无菌条件下摘取Sprague-Dawley(SD)大鼠股骨和胫骨,全骨髓贴壁法培养BMSCs,胰酶消化传代培养。待培养至第3代时进行流式鉴定,检测分离的BMSCs分化为脂肪细胞的潜能。与Wistar大鼠脾脏来源T细胞进行共培养,分为直接接触组和Transwell共培养组,探讨其对T细胞亚群的影响,并研究其相关机制。结果BMSCs呈梭形生长,生长至第3代的细胞经检测发现几乎不表达CD34和CD45,高表达CD29、CD44和CD90,且经诱导后细胞可分化为脂肪细胞和软骨细胞。与脾脏来源T细胞共培养可有效降低CD8+的效应T细胞(Teffs)的比例,并且增加CD4+CD25+双阳性的调节性T细胞(Tregs)数量,具有一定的免疫调节性能。与T细胞共培养后BMSCs 的IL-10和TGF-β1基因表达显著增强,其中与T细胞直接接触组效果更为明显。结论 BMSCs可能通过直接接触以及分泌细胞因子来发挥免疫调节功能。
骨髓;间质干细胞;细胞分化;神经免疫调节;大鼠,Sprague-Dawley;大鼠,Wistar
骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)为一群来自骨髓的多潜能干细胞,具有良好的再生和分化能力[1]。BMSCs起源于中胚层间质,具有多向分化的能力[2]。利用其贴壁生长特性可方便地进行体外培养和扩增,体外培养的BMSCs呈梭形,可聚集成均匀的集落[3]。有研究指出,BMSCs还具有良好的免疫调节性能,可通过细胞因子分泌和(或)细胞-细胞直接接触等对机体免疫系统的T细胞[4]、树突状细胞[5]、自然杀伤细胞[6]等产生影响,在免疫学研究领域具有广泛的应用前景。本研究用全骨髓贴壁法分离培养SD大鼠的BMSCs,通过流式检测和诱导分化方法鉴定,并且与异基因的Wistar大鼠脾脏来源的T细胞进行共培养,研究BMSCs对T细胞重要亚群的影响,并明确其作用机制,初步探讨BMSCs的免疫调节特性。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康SPF级成年雄性SD和Wistar大鼠,8~9周龄,体质量200~220 g,各3只,购于北京军事医学科学院实验动物中心。
1.1.2 材料和试剂 胎牛血清(FBS)、胰酶购自以色列Bioind公司;αMEM培养基、RPMI 1640培养基购自美国Corning公司;4%多聚甲醛、红细胞裂解液购自北京索莱宝科技有限公司;间充质干细胞成脂、成软骨诱导培养基、TRIzol、cDNA第一链合成试剂盒购自美国Invitrogen公司;油红O和甲苯胺蓝购自美国Sigma-Aldrich公司;Transwell小室购自美国Millipore公司;流式标记荧光抗体购自美国eBioscience公司;PCR检测引物合成于北京奥科生物技术有限责任公司;荧光实时定量PCR试剂盒购自瑞士Roche公司。
1.2 实验方法
1.2.1 骨髓细胞的分离 无菌条件下分离SD大鼠的胫骨和股骨,剔除干净肌肉,用注射器吸取含20%FBS的αMEM培养基冲出骨髓腔中的细胞,收集细胞并于室温1 200 r/min离心5 min,弃掉上清,用无菌磷酸盐缓冲液(PBS)洗涤1次,再次离心5 min后以1×106个/mL密度接种于培养皿中,于37℃、5%CO2环境的培养箱中培养,每3 d换液1次。
1.2.2 BMSCs的培养 用胰酶消化法进行BMSCs的常规传代培养。分离的骨髓细胞在培养至6~7 d时达到约80%融合,吸弃培养基并用无菌PBS清洗1次,加入1 mL 0.025%胰酶,37℃消化5 min后以1∶2比例进行传代,此为第1代BMSCs,随后约3 d传代1次,待培养至第3代时进行后续实验。
1.2.3 流式细胞仪检测BMSCs表面分子 培养至第3代的BMSCs由胰酶消化成单细胞,按每管5×105个细胞分成6组样品,PBS清洗1次,以异硫氰酸荧光素(FITC)标记的抗大鼠CD34、CD44、CD45、CD90和枣红蛋白(PE)标记的抗大鼠CD29抗体,分别标记5组细胞,4℃避光孵育30 min后用PBS清洗2次,用流式细胞仪进行检测,未标记的BMSCs作为流式检测设门对照。
1.2.4 BMSCs体外诱导分化 将培养至第3代的BMSCs以每孔1×105个细胞接种于12孔板的3个孔中,待细胞生长至80%融合时弃去培养基,其中一孔加入成脂诱导培养基,另一孔加入成软骨诱导培养基,剩余一孔作为正常培养对照。每3 d换液1次,约14 d时成脂诱导的细胞内出现明显的脂滴,成软骨诱导的细胞融合成小球形状。弃掉培养基,以4%多聚甲醛室温固定15 min,PBS清洗后分别加入油红O和甲苯胺蓝染液,室温染色20 min,PBS清洗后于光学显微镜下观察染色情况。
1.2.5 Wistar大鼠脾脏T细胞分离 无菌条件下摘取Wistar大鼠脾脏,用眼科剪剪成1 mm3的小块,置于40 μm孔径的筛网上,玻璃注射器内芯轻轻碾磨组织,并用无菌PBS冲洗收集细胞悬液,室温1 500 r/min离心5 min后弃去上清,用1 mL PBS重悬细胞,随后加入3 mL红细胞裂解液混匀,4℃孵育15 min后加入30 mL PBS室温离心5 min,弃去上清,再用PBS清洗后将细胞以(5~10)×105个/mL密度接种于培养皿,用含10%FBS的RPMI1640培养基进行悬浮培养。
1.2.6 BMSCs与T细胞共培养 将培养至第3代的BMSCs与新鲜提取的脾脏T细胞以1∶2比例进行共培养,分两种模式:一种为直接接触型,即BMSCs与T细胞共同接种于培养板孔中;另一种以Transwell小室(8 μm孔径)隔开BMSCs(小室中)和T细胞(培养板中),在RPMI 1640培养基中共培养48 h,BMSCs和T细胞单独培养作为对照组,分别收集BMSCs和T细胞用于后续检测。
1.2.7 流式细胞仪检测与BMSCs共培养后T细胞分型的变化 将经过两种共培养方式处理的T细胞各分为2组,一组加入PE标记的抗大鼠CD8抗体,另外一组加入FITC标记的抗大鼠CD4抗体和PE标记的抗大鼠CD25抗体,4℃避光孵育30 min后用PBS清洗2次,用流式细胞仪进行检测,未标记的新鲜T细胞作为流式检测设门对照。
1.2.8 与 T细胞共培养前后BMSCs基因表达检测 用TRIzol提取单独培养及与T细胞混合培养的BMSCs的总RNA,经cDNA第一链合成试剂盒反转录为cDNA,利用Real-time PCR方法检测细胞的白细胞介素-10(IL-10)和转化生长因子-β1(TGF-β1)的表达水平,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)水平为基因表达内参,每个样品设3次重复。引物序列见表1。

Tab.1 The primers used in Real-time PCR examination in ex vivo study表1 体外实验中Real-time PCR检测所用的引物
1.3 统计学方法 采用SPSS 13.0软件进行数据分析,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 流式细胞仪检测BMSCs表面标志物 培养至第3代的BMSCs表面CD29、CD44和CD90表达均在80%以上,为高水平表达分子;CD34和CD45表达均低于2%,为低表达水平分子,见图1。
2.2 BMSCs体外诱导鉴定 (1)体外诱导BMSCs向脂肪细胞分化的过程中,细胞形态发生比较明显变化,由最初呈梭形生长(图2A)逐渐变圆。加入诱导培养液6 d时即可在光镜下看到细胞内出现脂滴,随着诱导时间延长,细胞内的脂滴逐渐增多,有的发生融合,形成较大的脂滴。待诱导到14 d时,BMSCs向脂肪细胞分化达到高峰,经油红O染色后可见细胞内出现很多圆形、大小不一的脂滴,证实向脂肪细胞的诱导分化成功,见图2B。(2)诱导BMSCs向软骨细胞分化过程中,BMSCs由原来的长梭形变为三角形或不规则形,随着诱导时间的延长,细胞间紧密接触并逐渐融合成球形,14 d时甲苯胺蓝染色显示细胞内蛋白聚糖阳性,证实向软骨细胞的诱导分化成功,见图2C。
2.3 BMSCs对脾脏T细胞分型的影响 BMSCs与异基因脾脏T细胞共培养后,BMSCs&T Transwell组脾脏Teffs细胞比例与BMSCs组相比降低14.27%,BMSCs&T直接接触组与 BMSCs组相比降低27.72%,见图3A;此外,BMSCs可显著增加Tregs细胞的数量,BMSCs&T Transwell组与BMSCs组相比增加180.92%,且这种效应在BMSCs&T直接接触组中更加明显,较BMSCs组增加231.30%,见图3B。

Fig.1 The surface markers of rat BMSCs detected by flow cytometry图1 流式细胞仪检测大鼠BMSCs表面标记
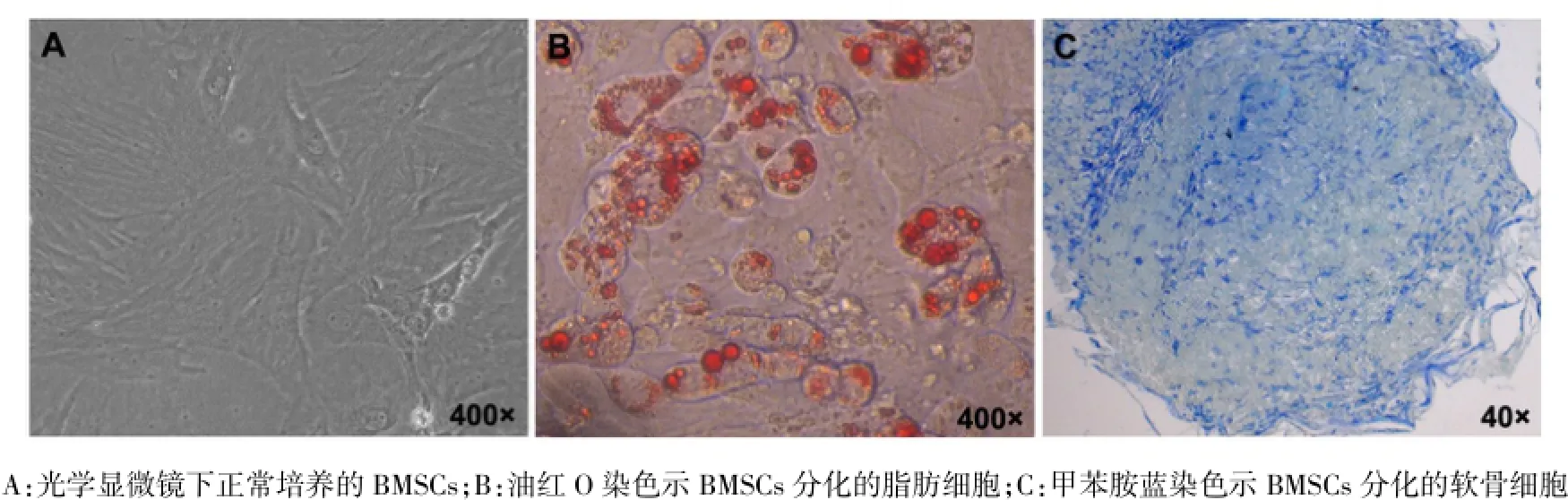
Fig.2 The adipocyte and cartilage differentiation capacity of BMSCs图2 BMSCs向脂肪和软骨细胞分化的鉴定
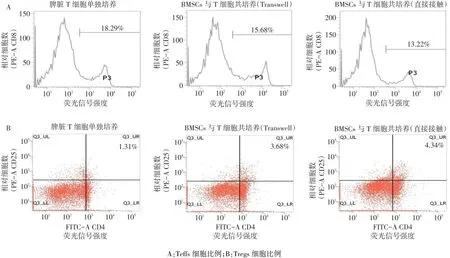
Fig.3 The surface markers of spleen T cells and it co-culture with BMSCs for 48 hours detected by flow cytometry图3 流式细胞仪检测与BMSCs共培养48 h后的脾脏T细胞表面标记
2.4 BMSCs与脾脏T细胞共培养前后细胞因子表达变化 单独培养的BMSCs表达一定水平的IL-10 和TGF-β1基因,与异基因脾脏T细胞共培养后可有效增强这2种细胞因子的水平,并且在BMSCs与T细胞直接接触组中效果更强,见表2。
Tab.2 The relative transcription levels of IL-10 and TGF-β1 in rat BMSCs examined by Real-time PCR表2 Real-time PCR检测大鼠BMSCs的IL-10和TGF-β1的相对表达量 (n=3,±s)

Tab.2 The relative transcription levels of IL-10 and TGF-β1 in rat BMSCs examined by Real-time PCR表2 Real-time PCR检测大鼠BMSCs的IL-10和TGF-β1的相对表达量 (n=3,±s)
*P<0.05,**P<0.01;a与BMSCs组比较,P<0.05
组别BMSCs组BMSCs&T Transwell组BMSCs&T直接接触组F TGF-β1 0.701±0.787 0.948±0.659 1.184±0.130a6.389*IL-10 0.791±0.716 1.340±0.896a1.617±1.753a12.057**
3 讨论
3.1 间充质干细胞的多潜能性 间充质干细胞(mesenchymal stem cells,MSCs)是一类多潜能干细胞,在体内各组织如骨髓、脂肪、骨骼肌等均有分布,尤其是骨髓来源的间充质干细胞(BMSCs)易于分离培养,增殖能力强,在体内外均能向多胚层来源的组织细胞分化[7],能分泌多种细胞因子,是一种非常有应用前景的种子细胞[8]。本实验成功分离得到SD大鼠的BMSCs,在体外培养中呈梭形生长,增殖快速,经流式细胞仪检测发现,培养至第3代的BMSCs高表达CD29、CD44和CD90分子,而几乎不表达造血系的CD34和CD45分子,证实所获得的BMSCs为典型的间充质干细胞。经诱导培养基处理,BMSCs在体外可高效地向脂肪细胞和软骨细胞分化,证实其具有良好的分化潜能。
3.2 间充质干细胞的免疫调节性能 除增殖和分化潜能外,研究发现BMSCs表面只表达主要组织相容性复合体(MHC)Ⅰ类分子,不表达或极少表达MHCⅡ类分子以及T细胞活化所需的共刺激分子B7-1、B7-2、CD40和CD40L等[9],因而具有低免疫原性,可大大减少同种异体的移植排斥反应,在干细胞移植和治疗领域是非常理想的干细胞来源[10]。此外,BMSCs还具有一定的免疫调节活性,据报道其可作用于免疫系统的多种细胞,包括树突状细胞(dendritic cell,DC)[11]、B细胞[12]、T细胞[13]、自然杀伤(NK)细胞等,并可通过分泌可溶性细胞因子如IL-10、TGF-β1、肝细胞生长因子(hepatocyte growth factor,HGF)等诱导免疫偏离,因而在免疫系统疾病的治疗以及器官移植等领域备受关注。本研究通过将BMSCs与异基因的脾脏T细胞共培养,观察BMSCs 对T细胞中重要的亚群,包括CD8+的Teffs细胞及CD4+CD25+双阳性的Tregs细胞的影响,并初步探讨其相关机制。结果发现,BMSCs与脾脏T细胞共培养后可明显降低Teffs细胞的数量并且增加Tregs细胞的比例,这种效应在BMSCs与T细胞直接接触组中更为显著,提示细胞与细胞的直接接触是BMSCs发挥免疫调节功能的一个重要前提。同时,Transwell共培养的方式隔开BMSCs与T细胞时,这种效果仍比较明显,提示BMSCs可能通过分泌一些可溶性细胞因子参与对T细胞亚群的调节。随后,笔者用Real-time PCR方法检测了BMSCs与T细胞共培养后的IL-10和TGF-β1细胞因子的基因表达,证实与T细胞共培养过程中BMSCs的两种细胞因子水平均得到明显提高,尤其直接接触组中最为显著。上述结果提示BMSCs可能是通过分泌细胞因子和细胞-细胞的直接接触作用来发挥免疫调节活性。
3.3 前景展望 本实验获得了可在体外大量培养扩增的大鼠BMSCs,且具有良好的分化潜能,此外,初步探讨了BMSCs的免疫调节性能,发现BMSCs可对异基因的脾脏T细胞一些亚群包括Teffs和Tregs产生影响,可有效降低Teffs细胞比例并且增加Tregs细胞数量,明确了这种影响产生的机制,不仅丰富了BMSCs免疫调节功能的研究,而且为BMSCs在免疫学研究领域的应用提供了进一步的支持。
[1]Bernardo ME,Pagliara D,Locatelli F.Mesenchymal stromal cell therapy:a revolution in Regenerative Medicine[J]?Bone Marrow Transplant,2012,47(2):164-171.doi:10.1038/bmt.2011.81.
[2]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411): 143-147.
[3]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8 (4):315-317.
[4]Chinnadurai R,Copland IB,Patel SR,et al.IDO-independent suppression of T cell effector function by IFN-gamma-licensed human mesenchymal stromal cells[J].J Immunol,2014,192(4):1491-1501.doi:10.4049/jimmunol.1301828.
[5]Liu WH,Liu JJ,Wu J,et al.Novel mechanism of inhibition of dendritic cells maturation by mesenchymal stem cells via interleukin-10 and the JAK1/STAT 3 signaling pathway[J].PLoS One,2013,8 (1):e55487.doi:10.1371/journal.p one.0055487.
[6]Casado JG,Tarazona R,Sanchez-Margallo FM.NK and MSCs crosstalk:the sense of immunomodulation and their sensitivity[J].Stem Cell Rev,2013,9(2):184-189.doi:10.1007/s12015-013-9430-y.
[7]Miao ZC,Gao H.Effect of transplantation of BMP-2-induced bone marrow mesenchymal stem cells on myocardial infarction of rats after reperfusion[J].Med J Chin PLA,2014,39(8):601-608.[苗忠澄,高航.BMP-2预诱导骨髓间充质干细胞移植治疗大鼠再灌注后心肌梗死的实验研究[J].解放军医学杂志,2014,39(8):601-608].
[8]Pileggi A,Xu X,Tan J,et al.Mesenchymal stromal(stem)cells to improve solid organ transplant outcome:lessons from the initial clinical trials[J].Curr Opin Orqan Transplant,2013,18(6):672-681.doi:10.1097/MOT.0000000000000029.
[9]Klyushnenkova E,Mosca JD,Zernetkina V,et al.T cell responses to allogeneic human mesenchymal stem cells:immunogenicity,tolerance,and suppression[J].J Biomed Sci,2005,12(1):47-57.
[10]Shi M,Liu ZW,Zhang Z,et al.Progress and challenge in the treatment of end-stage liver disease with stem cells[J].Med J Chin PLA,2013,38(8):685-692.[施明,刘振文,张政,等.干细胞治疗终末期肝病的进展与挑战[J].解放军医学杂志,2013,38(8):685-692].
[11]Aldinucci A,Rizzetto L,Pieri L,et al.Inhibition of immune synapse by altered dendritic cell actin distribution:a new pathway of mesenchymal stem cell immune regulation[J].J Immunol,2010,185(9):5102-5110.doi:10.404 9/jimmunol.1001332.
[12]Peng Y,Chen X,Liu Q,et al.Mesenchymal stromal cells infusions improve refractory chronic graft versus host disease through an increase of CD5+regulatory B cells producing interleukin 10[J].Leukemia,2015,29(3):636-646.
[13]Nazarov C,Lo Surdo J,Bauer SR,et al.Assessment of immunosuppressive activity of human mesenchymal stem cells using murine antigen specific CD4 and CD8 T cells in vitro[J].Stem Cell Res Ther,2013,4(5):128.doi:10.118 6/scrt339.
(2014-10-08收稿 2014-11-28修回)
(本文编辑 李鹏)
Isolation of rat bone marrow-derived mesenchymal stem cells and explore its role in immunomodulation
ZHANG Zhiqiang,LIU Yi,LI Keqiu,LI Guang△
Department of Biology,Basic Medical College,Tianjin Medical University,Tianjin 300070,China
△Corresponding Author E-mail:lig@tijmu.edu.cn
Objective To explore the immunomodulation property of bone marrow-derived mesenchymal stem cells (BMSCs)from Sprague-Dawley(SD)rats after they are isolated,cultured and identified by surface marker and differentiation potential examination.Methods BMSCs were isolated from femur and tibia of SD rats and passaged by trypsinization.The surface markers of the 3rdpassage BMSCs were detected by flow cytometry and the capacity of their adipocyte and cartilage differentiation were examined.In order to explore the immunomodulation property of BMSCs,allogeneic spleen T cells of Wistar rats were co-cultured with BMSCs through either cell-to-cell contact or transwell,then its effect on the T cell subsets and related mechanism was also examined.Results BMSCs were mainly spindle-shaped in culture.Surface marker detection showed that BMSCs expressed high levels of CD29,CD44 and CD90 but no CD34 nor CD45 at the third generation.Under specific condition,BMSCs could differentiate into adipocytes and chondrocytes.The CD8+effector T cells(Teffs)decreases effectively and the CD4+CD25+regulatory T cells(Tregs)increased remarkably when BMSCs were co-cultured with allogeneic spleen T cells for 48 hours.The expressions of IL-10 and TGF-β1 of BMSCs significantly increased after co-culture with T cells,and this effect was more obvious in cell-to-cell contact group.Conclusion The immunomodulation property of BMSCs were presumably function through cell-to-cell contacts and cytokine secretion.
bone marrow;mesenchymal stem cells;cell differentiation;neuroimmunomodulation;rats,Sprague-Dawley;rats,Wistar
R349.5
A DOI:10.11958/j.issn.0253-9896.2015.06.009
国家高技术研究发展计划(863计划)资助项目(2012AA021003);国家自然科学基金资助项目(21177091);天津市科技支撑计划资助项目(12ZCZDSY03400)
天津医科大学基础医学院生物学教研室(邮编300070)
张志强(1988),男,硕士在读,主要从事免疫耐受方面研究
△E-mail:lig@tijmu.edu.cn
