右美托咪啶预处理对下肢缺血再灌注性肺损伤及一氧化氮/内皮素-1失衡的影响
2015-08-24于健李睿王琦
于健,李睿,王琦
药物临床观察
右美托咪啶预处理对下肢缺血再灌注性肺损伤及一氧化氮/内皮素-1失衡的影响
于健,李睿,王琦∆
目的 观察右美托咪啶预处理对止血带引起的肢体缺血/再灌注(LIR)致肺损伤的保护作用和对一氧化氮(NO)/内皮素(ET)-1失衡的影响。方法 选取60例ASA评分Ⅰ~Ⅱ级拟行单侧下肢手术的患者。随机分为对照组(R组,n=30)和右美托咪啶预处理组(PD组,n=30)。所有患者均在神经刺激仪引导下行腰丛-坐骨神经阻滞麻醉后手术。PD组于使用止血带前10 min静脉泵注右美托咪啶0.125 mL/kg(4 mg/L);R组在相应时间点给予等量生理盐水0.125 mL/kg。分别于使用止血带前10 min(T0)和松止血带后15 min(T1)、2 h(T2)、6 h(T3)及24 h(T4)行动脉血气分析,计算呼吸指数(RI)和氧和指数(OI),测定NO、ET-1、白细胞介素(IL)-8、丙二醛(MDA)水平。结果 与T0比较,R组T3时RI升高,T2~T4时OI降低(P<0.01),PD组各时点RI、OI值比较差异无统计学意义;R组和PD组在松止血带后ET-1、IL-8、MDA浓度升高,NO浓度、NO/ET-1比值显著降低(P<0.05)。与R组比较,PD组在T3时RI降低、OI升高(P<0.01);PD组在松止血带后ET-1、IL-8、MDA、NO浓度和NO/ET-1比值与R组比较差异有统计学意义(P<0.05)。R组患者血浆ET-1、IL-8水平与RI值呈正相关,与OI值呈负相关(P<0.01);血浆NO水平、NO/ ET-1比值与RI值呈负相关,与OI值呈正相关(P<0.01)。结论 右美托咪啶预处理通过保护内皮细胞和减轻脂质过氧化损伤,改善患者使用止血带造成的LIR致肺换气功能的障碍。
右美托咪啶;再灌注损伤;肺换气;一氧化氮;内皮缩血管肽1
肢体手术为减少术中出血常会使用止血带,可能引起局部骨骼肌缺血/再灌注(IR),造成进一步损伤,已成为临床上较为棘手的并发症。研究表明,肢体缺血/再灌注(LIR)可导致远隔器官肺的损伤,究其机制,显示与一氧化氮(NO)/内皮素(ET)-1失衡有关[1]。目前,药物预处理对肺功能的影响愈来愈受到人们的关注。有研究表明,右美托咪啶对缺血再灌注致肺损伤有一定的保护作用[2]。而右美托咪啶预处理对LIR致肺损伤的保护作用尚鲜见报道。本研究拟观察右美托咪啶预处理对下肢手术时止血带导致LIR致肺损伤的保护作用及对NO/ET-1平衡的影响,旨在为临床提供参考。
1 资料与方法
1.1 一般资料 本研究经我院伦理委员会审核批准,患者及其家属知情同意并签字。遴选我院2014年1月—7月在腰丛-坐骨神经阻滞下行单侧下肢手术、需要使用止血带的患者共60例,包括跟腱断裂修补术24例,踝关节骨折、胫腓骨骨折切开复位内固定术各11例,胫骨髁间骨折、髌骨骨折切开复位内固定术各7例;美国麻醉师协会(ASA)分级Ⅰ~Ⅱ级。排除标准:术中失血血红蛋白(Hb)<70 g/L;术中出现严重低血压,需要药物维持者;下肢深静脉血栓或肺栓塞病史;窦性心动过缓或房室传导阻滞;神经阻滞部位感染;严重心、肺、肾功能障碍;糖尿病;术前1周内使用氧化剂或抗氧化剂类药物。本组患者中男36例,女24例,年龄58~73岁,体质量61~83 kg。采用随机数字表法将患者分为对照组(R组)和右美托咪啶预处理组(PD组)。
1.2 方法
1.2.1 麻醉方法 2组患者术前均未用药,入手术室开放外周静脉后,输注乳酸钠林格氏液6~8 mL/kg,持续面罩吸氧,常规监测心电图(ECG)、无创血压(NIBP)、心率(HR)、血氧饱和度(SpO2)。腰丛阻滞注射0.4%罗哌卡因(批号:NADZ AstraZeneca公司,瑞典)30 mL,坐骨神经阻滞注射0.4%罗哌卡因20 mL[3]。
麻醉完毕后,患侧股静脉和股动脉用留置针穿刺开放通路,肝素封管留针备用。患肢在大腿中上1/3处上止血带,驱血加压设置为术前收缩压加100 mmHg(1 mmHg=0.133 kPa),设定时间为60~90 min。PD组于上止血带前10 min泵注右美托咪啶注射液(批号:13111032江苏恒瑞医药)0.125 mL/kg(4 mg/L)[4],在10 min内阻断开始前输注完毕;R组则在同一时间内静脉泵注生理盐水0.125 mL/kg。药液由不参与本研究的医师配制。
1.2.2 标本采集及指标测定 分别于上止血带前10 min (T0),松止血带后15 min(T1)、2 h(T2)、6 h(T3)、24 h(T4)5个时间点抽取术侧股静脉血4 mL,室温下以3 000 r/min离心10 min,取上清液装于Eppendorf小管中密封,低温(-40℃)保存,同时经股动脉留置针内抽取股动脉血2 mL,行血气分析,计算呼吸指数(RI)和氧合指数(OI)。采用硝酸还原酶法测定NO浓度,硫代巴比妥酸法检测血清丙二醛(Malondialdehyde,MDA)浓度(试剂盒均购于南京建成生物研究所),酶联免疫吸附法(ELISA法)检测ET-1、白细胞介素(IL)-8浓度(ET-1试剂盒购于上海西唐生物技术有限公司;IL-8试剂盒购于深圳晶美生物有限公司)。
1.2.3 RI、OI计算公式 RI=PA-aDO2/p(O2)=[(PB-PH2O)× FiO2-p(O2)-p(CO2)/RQ]/p(O2)。OI=p(O2)/FiO2。PB为大气压,为760 mmHg;PH2O为37℃饱和水蒸气压,为47 mmHg;RQ为呼吸商,为0.8;呼吸空气时的FiO2取统一值为0.21。
1.3 统计学方法 采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组内比较采用重复测量设计的方差分析,组间比较采用t检验,计数资料比较采用χ2检验,NO、ET-1、NO/ET-1和IL-8与血气指标相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者一般资料比较 2组患者的年龄、性别、体质量、身高、止血带时间差异无统计学意义(均P>0.05),见表1。
Tab.1 Comparison of general data between two groups表1 2组患者一般资料比较 (n=30,±s)
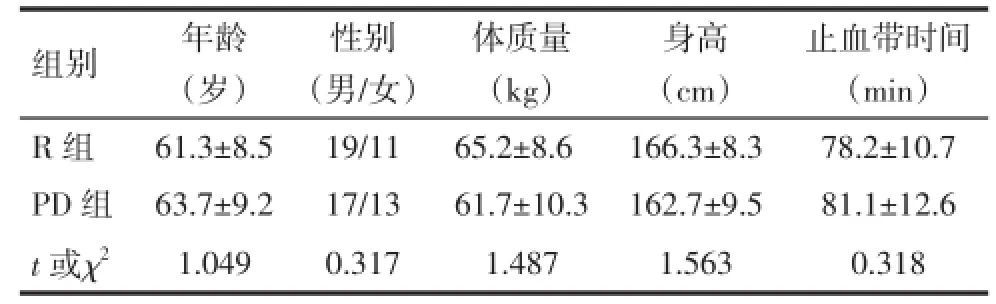
Tab.1 Comparison of general data between two groups表1 2组患者一般资料比较 (n=30,±s)
均P>0.05
组别 年龄 性别 体质量 身高 止血带时间(岁) (男/女) (kg) (cm) (min)R组61.3±8.519/1165.2±8.6166.3±8.378.2±10.7 PD组63.7±9.217/1361.7±10.3162.7±9.581.1±12.6 t或χ21.0490.3171.4871.5630.318
2.2 2组患者血气指标比较
2.2.1 2组患者不同时点RI比较 PD组不同时点RI差异无统计学意义(P>0.05);R组差异有统计学意义(P<0.01),R组在T3时RI值升高。PD组在T3时RI值低于R组(P<0.01),见表2。
2.2.2 2组患者不同时点OI比较 PD组不同时点OI差异无统计学意义(P>0.05);R组在T2~T4时与T0相比OI值降低。PD组在T3时OI值高于R组(P<0.01),见表3。
2.3 2组患者血液指标比较
2.3.1 2组患者不同时点NO浓度比较 组内比较2组NO浓度均在T2~T3时降低。组间比较PD组在T2、T3时NO浓度值高于R组(P<0.01),见表4。
Tab.2 Comparison of respiratory index at different time points between two groups表2 2组患者不同时点RI比较 (n=30,±s)
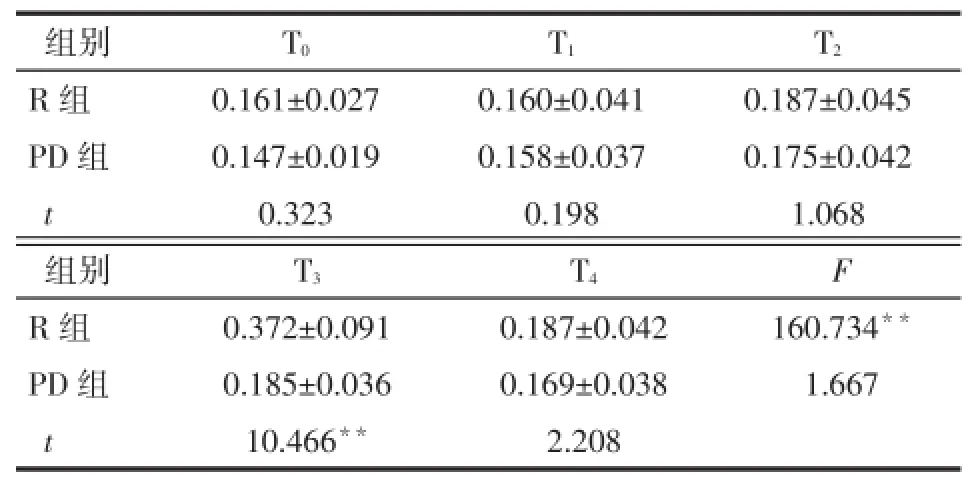
Tab.2 Comparison of respiratory index at different time points between two groups表2 2组患者不同时点RI比较 (n=30,±s)
*P<0.05,**P<0.01,表3~7同;F组间=10.614,F时间=28.315,F交互=6.783,均P<0.01
T1 T0 T2组别R组PD组t 0.161±0.027 0.147±0.019 0.323 0.160±0.041 0.158±0.037 0.198 0.187±0.045 0.175±0.042 1.068 T4 T3 F组别R组PD组t 0.372±0.091 0.185±0.036 10.466**0.187±0.042 0.169±0.038 2.208 160.734**1.667
Tab.3 Comparison of oxygenation index at different time points between two groups表3 2组患者不同时点OI比较(n=30,mmHg,±s)
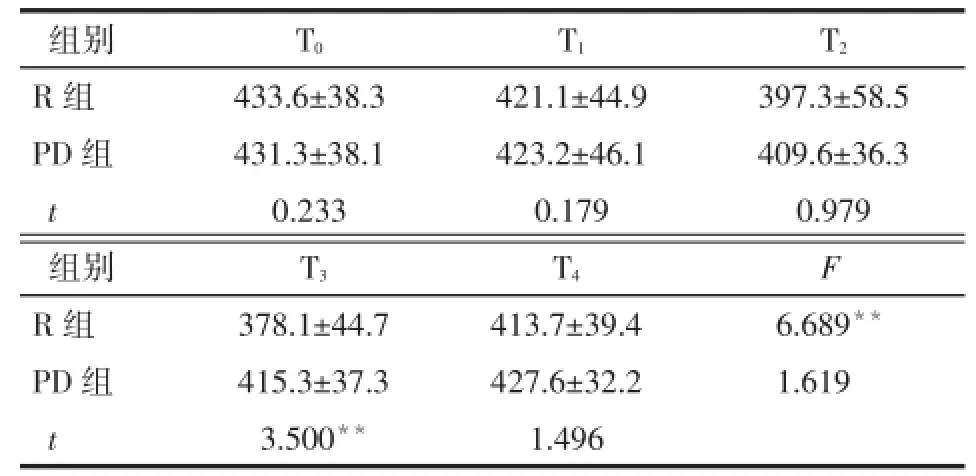
Tab.3 Comparison of oxygenation index at different time points between two groups表3 2组患者不同时点OI比较(n=30,mmHg,±s)
F组间=2.777,F时间=7.416,F交互=3.921,均P<0.01
T1 T0 T2组别R组PD组t 433.6±38.3 431.3±38.1 0.233 421.1±44.9 423.2±46.1 0.179 397.3±58.5 409.6±36.3 0.979 T4 T3 F组别R组PD组t 378.1±44.7 415.3±37.3 3.500**413.7±39.4 427.6±32.2 1.496 6.689**1.619
Tab.4 Comparison of nitric oxide concentration at different time points between two groups表42 组患者不同时点NO浓度比较(n=30,mmol/L,±s)
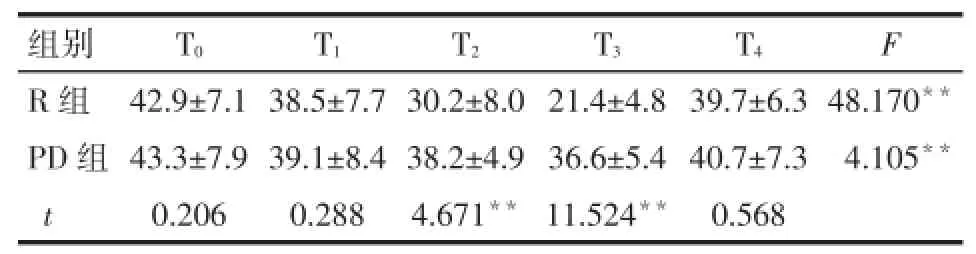
Tab.4 Comparison of nitric oxide concentration at different time points between two groups表42 组患者不同时点NO浓度比较(n=30,mmol/L,±s)
F组间=6.287,F时间=39.987,F交互=7.324,均P<0.01
组别R组PD组t T0 T1 T2 T3 T4 F 42.9±7.1 43.3±7.9 0.206 38.5±7.7 39.1±8.4 0.288 30.2±8.0 38.2±4.9 4.671**21.4±4.8 36.6±5.4 11.524**39.7±6.3 40.7±7.3 0.568 48.170**4.105**
2.3.2 2组患者不同时点ET-1浓度比较 组内比较,R组T2~T4时、PD组T3时与T0相比ET-1浓度升高。组间比较,PD组在T2、T3时ET-1浓度值低于R组(P<0.05或P<0.01),见表5。
2.3.3 2组患者不同时点NO/ET-1值比较 组内比较2组NO/ET-1值均在T2、T3时降低。组间比较,PD组在T2、T3时NO/ET-1值高于R组(P<0.01),见表6。
2.3.4 2组患者不同时点IL-8浓度比较 组内比较,IL-8浓度R组在T2~T4、PD组在T2~T3时升高。组间比较PD组在T2~T4时IL-8浓度低于R组(P<0.01),见表7。
Tab.5 Comparison of endothelin-1 concentration at different time points between two groups表52 组患者不同时点ET-1浓度比较(n=30,ng/L,±s)
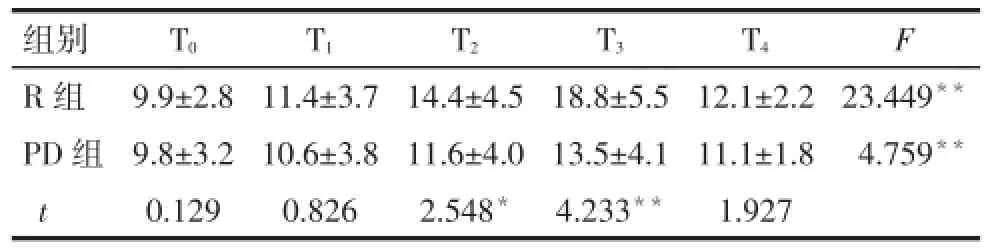
Tab.5 Comparison of endothelin-1 concentration at different time points between two groups表52 组患者不同时点ET-1浓度比较(n=30,ng/L,±s)
F组间=4.741,F时间=18.869,F交互=5.763,均P<0.01
组别R组PD组t T0 T1 T2 T3 T4 F 9.9±2.8 9.8±3.2 0.129 11.4±3.7 10.6±3.8 0.826 14.4±4.5 11.6±4.0 2.548*18.8±5.5 13.5±4.1 4.233**12.1±2.2 11.1±1.8 1.927 23.449**4.759**
Tab.6 Comparison of nitric oxide/endothelin-1 at different time points between two groups表62 组患者不同时点NO/ET-1比较(n=30,mol/mg,±s)
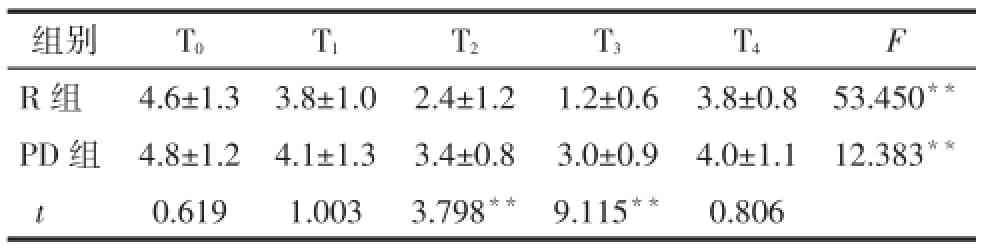
Tab.6 Comparison of nitric oxide/endothelin-1 at different time points between two groups表62 组患者不同时点NO/ET-1比较(n=30,mol/mg,±s)
F组间=6.034,F时间=58.440,F交互=7.439,均P<0.01
?
Tab.7 Comparison of interleukin-8 concentration at different time points between two groups表7 2组患者不同时点IL-8浓度比较(n=30,ng/L,±s)
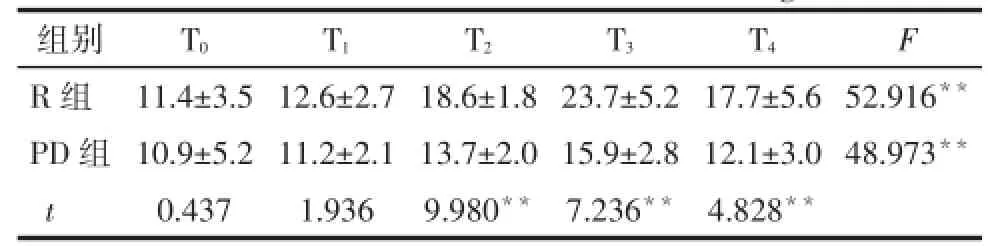
Tab.7 Comparison of interleukin-8 concentration at different time points between two groups表7 2组患者不同时点IL-8浓度比较(n=30,ng/L,±s)
F组间=29.172,F时间=32.783,F交互=5.613,均P<0.01
?
2.3.52 组患者不同时点MDA浓度比较 R组MDA浓度在T1~T3时升高。组间比较PD组在T1~T3时MDA浓度低于R组(P<0.05或P<0.01),见表8。
Tab.8 Comparison of malondialdehyde concentration at different time points between two groups表82 组患者不同时点MDA浓度比较(n=30,μmol/L,±s)
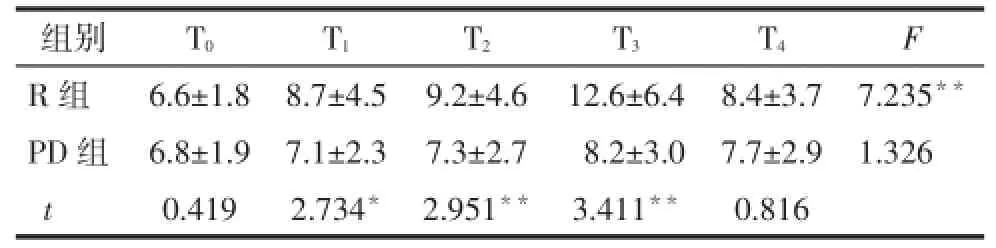
Tab.8 Comparison of malondialdehyde concentration at different time points between two groups表82 组患者不同时点MDA浓度比较(n=30,μmol/L,±s)
F组间=4.166,F时间=8.884,F交互=4.132,均P<0.01
组别R组PD组t T0 T1 T2 T3 T4 F 6.6±1.8 6.8±1.9 0.419 8.7±4.5 7.1±2.3 2.734*9.2±4.6 7.3±2.7 2.951**12.6±6.4 8.2±3.0 3.411**8.4±3.7 7.7±2.9 0.816 7.235**1.326
2.4 ET-1、IL-8、NO、NO/ET-1与RI、OI的相关性分析 R组患者血浆ET-1、IL-8水平与RI值呈正相关,与OI值呈负相关(P<0.01);血浆NO浓度、NO/ET-1比值与OI值呈正相关,与RI值呈负相关(P<0.01),见表9。
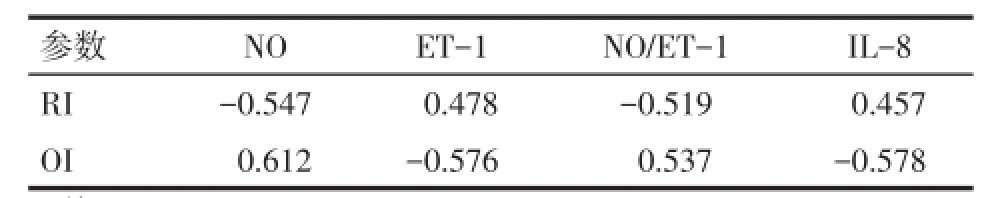
Tab.9 The correlation between NO,ET-1,IL-8 and NO/ET-1 with RI and OI in R group表9 R组患者NO、ET-1、IL-8水平和NO/ET-1比值与RI、OI的相关性 (n=30,r)
3 讨论
近年来研究发现,局部器官的IR可通过炎症反应及氧化应激等引起远隔脏器损伤[5],如心、肺、肝等器官功能障碍。研究发现,右美托咪啶预处理后可以保护肺功能,减轻肺损伤症状[6]。故预防LIR致远隔器官损伤的研究具有重要意义。
本研究参考文献[7],采用RI血气指标来反映肺换气功能,RI愈大,说明LIR后致肺换气功能愈差。而OI则反映病情连续趋势变化,了解病情进展。如RI明显升高,而同时OI明显降低,提示发生了肺损伤[8]。本研究显示,R组患者T3时RI明显升高,而OI在T2~T4明显降低,PD组T3时刻RI、OI与R组比较差异有统计学意义,显示PD组肺功能障碍较R组轻,提示右美托咪啶预处理对LIR致肺换气功能损伤起到一定的保护作用。研究表明,LIR导致的远隔肺损伤与NO/ET-1失衡有关[1]。本研究通过NO、ET-1水平和NO/ET-1比值与血气指标相关性统计分析,亦证实如此。Wang等[9]研究表明,血浆ET-1浓度可作为一种反映肺功能损伤的敏感性指标。ET-1使肺血管、支气管强烈收缩,可以导致通气/血流比值失调,加重肺组织损伤。而NO作为重要的舒血管因子,可维持肺血管灌注、抗中性粒细胞聚集黏附血管内皮[10]。本研究显示,R组LIR后血ET-1浓度较术前增加,而NO浓度则降低;而PD组与R组比较,LIR后,ET-1、NO浓度差异具有统计学意义,说明右美托咪啶预处理有效协调了NO/ ET-1的失衡,促进NO的释放,抑制中性粒细胞黏附、聚集,降低肺血管通透性,改善肺氧合,使LIR过程中肺组织微循环障碍得到改善。
Kim等[11]证实,ET-1参与了机体炎症反应,呈浓度依赖式促进IL-8的释放。IL-8是中性粒细胞主要的趋化和活化因子[12],使中性粒细胞向组织浸润,从而导致肺脏微血管通透性增加,使实质细胞受损,造成肺功能障碍。本研究显示,R组T2~T4时刻血浆ET-1水平、IL-8浓度升高;PD组较R组血浆ET-1水平、IL-8浓度下降,推测通过降低ET-1水平,减少IL-8释放,从而抑制中性粒细胞黏附与激活,对LIR后肺损伤起到早期保护作用。此外,ET-1通过花生四烯酸途径产生大量的氧自由基,通过攻击细胞膜的多价不饱和脂肪酸,其最终产物为MDA,造成血管内皮细胞内水肿,组织功能障碍[13]。此外,本研究显示,与T0时比,R组患者T1~T4时MDA含量明显升高,而PD组在T1~T3时点MDA含量显著低于对照组,这说明右美托咪啶预处理可能激动α2肾上腺素受体,降低机体儿茶酚胺水平,降低机体氧化应激反应,减少LIR过程中氧自由基的爆发性释放,减轻肺损伤。
综上所述,右美托咪啶预处理可以改善患者LIR致肺换气功能的障碍,其机制可能与其保护内皮细胞和减轻脂质过氧化损伤有关。
[1]Wang BQ,Kan YF,Yang QH.The protective effect of the limb ischemia preconditioning on the hepatic injury related to NO/ET-1 system in rats [J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2010,26(3):376-379.
[2]Gu J,Chen J,Xia P,et al.Dexmedetomidine attenuates remote lung injury induced by renal ischemia-reperfusion in mice[J].Acta Anaesthesiol Scand,2011,55(10):1272-1278.doi:10.1111/j.1399-6576.2011.02526.x.
[3]Chen YJ,Xia Y,Hu HQ,et al.Clinical study of news stimulator guided peripheral nerve block compared with spinal anesthesia in lower limb surgery[J].J Clin Anesthesiol,2013,29(8):749-751.[陈云俊,夏艳,胡海青,等.神经刺激仪引导下外周神经阻滞与蛛网膜下腔阻滞用于下肢手术的比较[J].临床麻醉学杂志,2013,29(8):749-751].
[4]Basar H,Akpinar S,Doganci N,et al.The effects of preanesthetic,single-dose dexmedetomidine on induction,hemodynamic and cardiovascular parameters[J].J Clin Anesth,2008,20(6):431-436.
[5]Eltzschig HK,Eckle T.Ischemia and reperfusion--from mechanism to translation[J].Nat Med,2011,17(11):1391-401.doi:10.1038/ nm.2507.
[6]Ge DJ,Qi B,Li JY.The protective effect of dexmedetomidie preconditioning on acute lung injury in rats[J].Chong Qing Medicine,2013,42(28):3405-3407.[葛东建,祁宾,李金玉.右美托咪啶预处理对急性肺损伤大鼠的保护作用[J].重庆医学,2013,42(28): 3405-3407].doi:10.3969/j.issn.1671-8348.2013.28.028.
[7]Zhou W,Zeng D,Chen R,et al.Limb ischemic preconditioning reduces heart and lung injury after an open heart operation in infants[J].Pediatr Cardiol,2010,31(1):22-29.doi:10.1007/s00246-009-9536-9.
[8]Zhang H,Li P,Dou XJ,et al.Effects of ultrafiltration on blood rheology in patients undergoing valve replacement with cardiopulmonary bypass[J].J Clin Anesthesiol,2014,30(2):146-149.[张红,李佩,窦雪娇,等.超滤对心肺转流瓣膜置换术患者血液流变学的影响[J].临床麻醉学杂志,2014,30(2):146-149].
[9]Wang JY,Wang XY,Sun HY.Study on the correlation between the pulmonary injury and the ET-1 serum level in ulcerative colitis patients[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2012,32(4):455-459.
[10]Park B,Hoffman A,Yang Y,et al.Endothelial nitric oxide synthase affects both early and late collateral arterial adaptation and bloodflow recovery after induction of hind limb ischemia in mice[J].J Vasc Surg,2010,51(1):165-173.doi:10.1016/j.jvs.2009.08.045.
[11]Kim YH,Lee SM.Role of Kupffer cells in the vasoregulatory gene expression during hepatic ischemia/reperfusion[J].Arch Pharm Res,2004,27(1):111-117.
[12]Zhang JX,Zhao LJ,Shi H,et al.Effects of Poly(I:C),LPS and PGN stimulation on the innate immune function of human bronchial epithelium[J].Med J Chin PLA,2013,38(7):552-556.[张景熙,赵立军,石荟,等.聚肌胞苷酸、脂多糖及肽聚糖对人气道黏膜天然免疫功能影响的实验研究[J].解放军医学杂志,2013,38(7):552-556].
[13]Xu B,Gao X,Xu J,et al.Ischemic postconditioning attenuates lung reperfusion injury and reduces systemic proinflammatory cytokine release via heme oxygenase 1[J].J Surg Res,2011,166(2):157-164.doi:10.1016/j.jss.2010.11.902.
(2014-09-22收稿 2014-12-10修回)
(本文编辑 李鹏)
Effects of dexmedetomidine preconditioning on imbalance of nitric oxide/endothelin-1 and remote lung injury in patients with lower limb ischemia-reperfusion
YU Jian,LI Rui,WANG Qi∆
Department of Anesthesiology,Central Hospital of Cangzhou,Hebei 061001,China
∆Corrsponding Author E-mail:viviyjyy@sina.com
Objective To investigate the effects of dexmedetomidine preconditioning on nitric oxide(NO)/endothelin (ET)-1 imbalance and remote lung injury induced by lower limb ischemia-reperfusion(LIR).Methods Sixty patients who scheduled for unilateral lower extremity surgery matched American Society of Anesthesiologists(ASA)Ⅰ-Ⅱ,were randomized into two groups:control group(R group,n=30)and dexmedetomidine preconditioning group(PD group,n=30).Lumbar plexus combined with sciatic nerve block was performed guided by a nerve stimulator in both groups.In group PD,dexmedetomidine intravenous infusion was started at a dose of 0.125 mL/kg(4 mg/L)for 10 minutes before using tourniquet,whereas group R received an equivalent volume of normal saline.Artery blood gas analysis,respiratory index and oxygenation index were measured,and NO,ET-1,interleukin-8(IL-8)and malondialdehyde(MDA)concentrations were determined from plasma samples 10 minutes before tourniquet inflation(T0),15 minutes(T1),2 h(T2),6 h(T3)and 24 h(T4)after tourniquet deflation.Results Compared with T0,RI was higher at T3in group R and OI was lower at T2-4(P<0.01).There were no significant differences in RI and OI of group PD between different time points(P>0.05).In R and PD groups,ET-1,IL-8 and MDA concentrations were increased,while NO level and NO/ET-1 ratio were significantly decreased after tourniquet deflation(P<0.05).Compared with group R,RI was lower and OI was higher at T3in group PD(P<0.01).The levels of ET-1,IL-8,MDA,NO and NO/ET-1 ratio were significantly different after tourniquet deflation between group PD and group R (P<0.05).In group R,there was positive correlation between ET-1 and IL-8 levels with RI,and negative correlation between ET-1 and IL-8 levels with OI(P<0.01).There was positive correlation between NO level,NO/ET-1 ratio and RI lev-el(P<0.01).Conclusion Lung function impairment induced by tourniquet application could be attenuated by dexmedetomidine preconditioning based on protecting endothelial cells and inhibiting lipid peroxidation.
dexmedetomidine;reperfusion injury;pulmonary gas exchange;nitric oxide;endothelin-1
R363
A DOI:10.11958/j.issn.0253-9896.2015.05.024
河北省沧州市中心医院麻醉一科(邮编061001)
于健(1981),男,主治医师,硕士,主要从事骨科麻醉方面研究
∆E-mail:viviyjyy@sina.com
