载纳米银二氧化钛纳米管抑菌能力研究
2015-08-24苗静雯张旭张文怡孙迎春马士卿高平
苗静雯,张旭,张文怡,孙迎春,马士卿,高平
载纳米银二氧化钛纳米管抑菌能力研究
苗静雯,张旭,张文怡,孙迎春,马士卿,高平△
目的 检测载纳米银二氧化钛(TiO2)纳米管对于金黄色葡萄球菌的抑菌作用,为种植体局部给药提供理论基础。方法 利用阳极氧化法分别在10 V和18 V恒定电压下制作不同管径的排列有序的TiO2纳米管,将纳米银进行原位置换导入。扫描电镜以及透射电镜检测纳米银、TiO2纳米管及载纳米银TiO2纳米管的表面形貌,计算纳米银的最小抑菌浓度,于载纳米银TiO2纳米管表面培养金黄色葡萄球菌1、3、5 d后,测试对周围浮游菌的抑菌性,通过扫描电镜测试抑制细菌的黏附性能。结果 紫外线照射后的载纳米银TiO2纳米管形成更加疏水的材料表面,18 V电压下制备出均匀有序直径为80~120 nm的TiO2纳米管,加载直径为20 nm纳米银,能有效抑制金黄色葡萄球菌的黏附与增殖。结论 18 V电压下制作出的TiO2纳米管载入浓度为100 mmol/L的纳米银溶液能在3 d内有效抑制金黄色葡萄球菌的黏附与增殖,减少种植体周围炎的发生。
纳米管;钛;银;纳米结构;微生物敏感性试验;细菌黏附
种植修复为牙列缺损以及牙列缺失较重要的修复方法,具有咀嚼效力高、舒适感强以及不损伤邻牙等优点,但是在长期的随访观察中仍有2%~3%的失败率[1],而种植体周围炎为造成种植失败的主要原因。如果进行广谱抗菌药物全身给药容易形成耐药菌从而导致种植时间延长等不良后果,因此局部给抑菌药物并且减少耐药菌的形成成为近期研究重点。本文以二氧化钛(TiO2)纳米管为载体,以纳米银作为抑菌剂改变种植体的表面性能,测试其对金黄色葡萄球菌的抑菌性能,以期为进一步研发具有良好抑菌性的种植体材料提供理论基础。
1 材料与方法
1.1 材料
1.1.1 材料试剂 TA2纯钛(陕西宝鸡钛业有限公司),氢氟酸(天津市赢达稀贵化学试剂厂),硝酸银、L-抗坏血酸、LB培养基、PBS、戊二醛(上海生工生物工程有限公司),金黄色葡萄球菌(ATCC6538)。
1.1.2 设备和仪器 DW-P401-40ACEO型高压直流电源(天津市东文高压电源厂),SH-2型磁力加热搅拌器(天津泰斯特仪器有限公司)。NANO SEM 430型扫描电子显微镜-X射线光电子能谱分析(美国FEI公司),JC2000D1型接触角测量仪(厦门迈凯伦精瑞科仪有限公司),JEM-2100F透射电镜(日本电子株式会社)。
1.2 方法
1.2.1 纯钛试件的处理及载纳米银TiO2纳米管的制备 纯钛板在氩气下切割成直径15 mm×15 mm×0.5 mm的试件。试件表面分别经100目、240目、400目、600目、800目、1 000目、1 200目SiC砂纸打磨后,依次用丙酮、乙醇和蒸馏水超声清洗10 min,室温下干燥。利用阳极氧化原理对试件进行处理,未经阳极氧化的钛片标记为光滑钛。以0.5%HF为电解液,钛片为阳极,铂片为阴极制作电解池,分别在10 V和18 V电压下常温磁力搅拌阳极氧化1 h,分别标记为10 V TiO2和18 V TiO2。阳极氧化结束后用去离子水冲洗后超声清洗10 s,室温干燥。将1、10、100 mmol/L硝酸银溶液,以0.1%聚乙烯醇(PVA)作为保护剂,在加热近沸点的条件下,逐滴滴加10 mmol/L抗坏血酸溶液持续搅拌15 min至逐渐变为金黄色,继续搅拌15 min至溶液稳定,制备出浓度分别为1、10、100 mmol/L的纳米银溶液,可在4℃冰箱内保持数月。将制备好的18 V TiO2置入15 mL 1、10、100 mmol/L纳米银溶液中,加入30 mL无水乙醇,超声震荡45 min后将纳米银原位置换载入TiO2纳米管中,获得试样分别标记为18 V-Ag1、18 V-Ag10、18 V-Ag100,将10 V TiO2置入15 mL 100 mmol/L纳米银溶液中,加入30 mL无水乙醇超声震荡45 min获得试样标记为10 V-Ag100。
1.2.2 测样表征 场发射扫描电镜(field emission scanning electron microscope,FE-SEM)测试光滑钛,5、18、20 V TiO2纳米管的表面形貌,使用透射电镜(transmission electron microscope,TEM)测试纳米银形貌以及剥脱制取的载纳米银TiO2的形貌。使用X射线光电子能谱分析(X-ray photoelectron spectroscopy,XPS)测试18 V-Ag100和10 V-Ag100试样表面成分。使用接触角测量仪座滴法测量试样在紫外灯照射前以及照射30 min后的10 V、18 V、光滑钛、18 V-Ag1、18 V-Ag10、10 V-Ag100、18 V-Ag100蒸馏水在试样材料表面接触角。
1.2.3 最小抑菌浓度的测定 在第1列中放入160 μL LB培养基,分别加入100、10、1、0.1 mmol/L纳米银溶液40 μL,其余每行加入100 μL培养基采用二倍稀释法依次稀释,将每孔中加入100 μL 1×108CFU金黄色葡萄球菌,放入37℃恒温培养箱内培养1 d后观察,选取肉眼下浑浊的液体前一浓度至每行第1列依次涂平板,将平板内菌落数小于5个作为抑菌标志,经计算得出最小抑菌浓度。
1.2.4 抑菌试验 将18 V-Ag1、18 V-Ag10、10 V-Ag100、18 V-Ag100作为实验组,光滑钛和18 V TiO2作为对照组,紫外光照射30 min后,放入12孔板中,依次加入1 mL 1×105CFU金黄色葡萄球菌菌液,放入37℃恒温培养箱中进行培养,每24 h对样品进行漂洗并更换菌液及培养基,培养1、3、5 d后,取培养基进行平板计数法测试周围浮游菌的数目。浮游菌的抗菌性能以及抑菌黏附性能用以下公式计算:种植体周围浮游细菌抗菌率=(光滑钛周围培养基中的细菌数-试样周围培养基的细菌数)/光滑钛周围培养基中的细菌数。
1.2.5 试样表面细菌培养扫描电镜 试样消毒后如上述步骤每日更换菌液培养,培养1、3 d后用2%戊二醛表面细菌固定,依次用30%、50%、70%、95%乙醇,无水乙醇梯度脱水各15 min,冷冻干燥后喷金扫描电镜观测样品表面形貌。
1.3 统计学方法 采用SPSS 17.0统计软件,2组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同电压下 TiO2纳米管 FE-SEM下的形态 TiO2纳米管管径随电压的升高而变大,5 V制作的表面呈凸起柱状,18 V制作的表面为均匀分布的管状平面直径为80~120 nm,20 V制作出的样品表面凹凸不平不光滑,管壁出现溶解破裂,见图1。

Fig.1 FE-SEM observation of smooth titanium(×100)and titanium nanotubes(×100 000)图1 FE-SEM观察光滑钛(×100)及钛纳米管(×100 000)
2.2 不同浓度纳米银直径及载纳米银TiO2纳米管形态及表面元素含量 不同浓度的纳米银直径均为20 nm,但保护剂内的纳米银粒子数量随浓度增高而增多,见图2。剥脱的TiO2内有直径约20 nm的阻射黑色点状物,考虑为纳米银颗粒,见图3。扫描电镜下样品表面有颗粒状物质,为纳米银沉积,见图4。表面能谱分析表明有银离子波峰存在,波峰高低指示银元素在材料表面含量多少,见图5、6。
2.3 接触角测试 载纳米银的TiO2纳米管紫外线照射30 min后接触角均有不同程度的减小,形成更加亲水的表面涂层,而未载纳米银TiO2纳米管紫外线照射30 min后接触角上升,形成疏水表面。紫外线照射前后样本接触角差异有统计学意义,见表1。

Fig.2 TEM observation of concentrations of nanosilver solution图2 TEM观测不同浓度纳米银溶液(×20 000)
Fig.3 TEM detection of peeling silver nanoparticals loaded titanium nanotubes图3 TEM测试剥脱载纳米银TiO2纳米管(×15 000)

Fig.4 The surface morphology of silver nanoparticals loaded titanium nanotubes detected by FE-SEM图4 FE-SEM测试载纳米银TiO2纳米管表面形貌
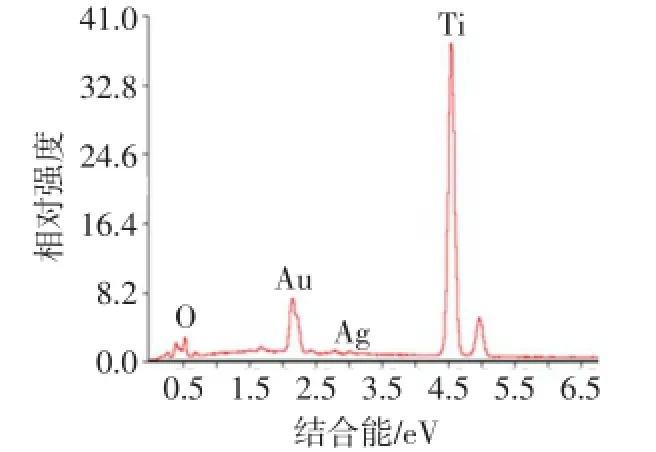
Fig.5 The surface 10V-Ag100 content detected by XPS testing图5 XPS测试10V-Ag100表面元素含量
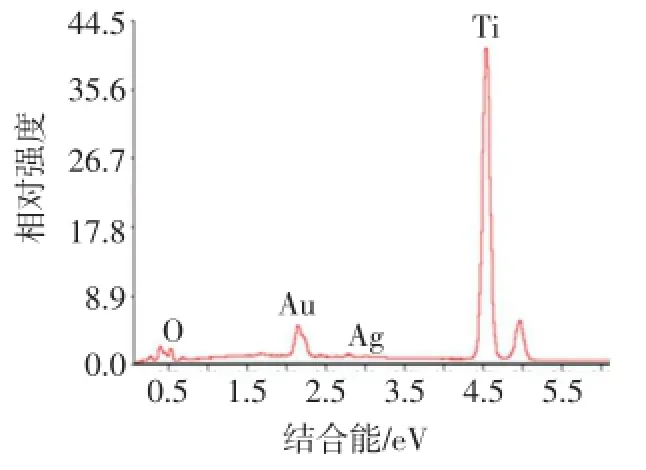
Fig.6 The surface18V-Ag100 content detected by XPS testing图6 XPS测试18V-Ag100表面元素含量
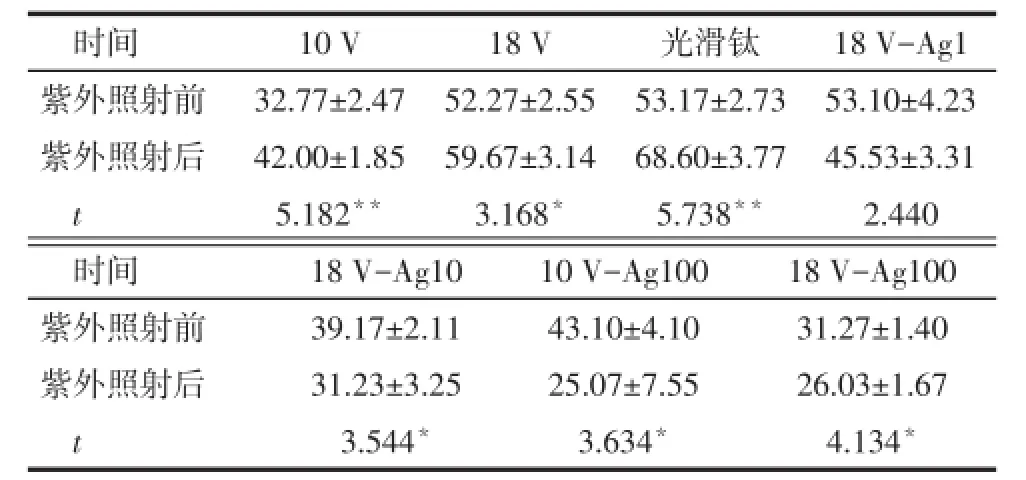
Tab.1 Comparison of contact angles before and after ultraviolet irradiation表1 紫外线照射前后接触角比较(n=6,°,x±s)
2.4 抑菌能力测定 经计算测得最小抑菌浓度为0.125~0.156 mmol/L。培养后平板计数法测出周围浮游菌菌落数目,光滑钛和紫外线照射后的TiO2纳米管组细菌菌落铺满平板,无法计数,与细菌原菌液涂平板效果相仿,基本无抑菌性,种植体周围浮游细菌抗菌率为零。载纳米银的TiO2在第1天均有较好的抑菌性,10 V-Ag100与18 V-Ag100抑菌率达100%,18 V-Ag1、18 V-Ag10平板计数有个别细菌存在,抑菌率分别为(99.59±0.085)%和(99.93± 0.058)%。第3天只有18 V-Ag100有较好的抑菌性(96.33±1.19)%,10 V-Ag100也有一定的抑菌性(84.44±1.93)%,但有少数细菌铺展。在第5天各组均不能有效抑菌。样品表面细菌培养第1天18 VAg100和10 V-Ag100基本无细菌黏附,且载纳米银的样品细菌黏附明显小于未载药18 V TiO2及光滑钛,见图7。培养3 d后各组黏附细菌均高于第1天,18 V-Ag100较少细菌黏附,10 V-Ag100略有细菌黏附,数目明显小于其余各试样,见图8。
3 讨论
在种植体植入最初6 h[2]为细菌与细胞竞争种植体表面的决定性时间[3],当细菌优先吸附于种植体表面时会形成生物膜,从而保护细菌不被宿主防御系统以及抗菌药物清除[4],形成种植体周围的慢性炎症,目前最常见的抗炎方式是服用广谱抗菌药物,不仅到达靶位置的药物浓度很低,而且长期使用抗菌药物还会造成机体内耐药菌的形成[5]。因此在种植后短期内抑制种植体周围细菌黏附种植体表面以及局部给予抑菌药物成为研究热点。TiO2纳米管由于其高度有序的表面形貌能够促进成骨细胞的增殖与分化[6-7],并可以作为良好的局部给药的载体[8-9],抑制种植体周围炎的形成。银作为一种广谱抑菌药物常被应用于种植体周围炎局部给药,其抑菌作用通常是依靠银离子的释放进入细菌内与细菌体中酶蛋白的巯基结合来完成。以往的制备银涂层主要是应用物理吸附法、电喷涂及溅射沉积法[10-12],但这些方法具有载银粒子尺寸较大,且与纳米管结合不佳等缺点,本实验采用纳米银原位置换的方法将体积较小的纳米银粒子导入纳米管中。不但方法更加简便,而且纳米银依靠其特有的物理及化学性能,较高的体积比等优点,不仅拥有更强的抑制细菌甚至抗病毒的性能[13-14],而且细胞毒性较小[15]。
本实验研究结果表明纳米管的管径随着阳极氧化的电压升高而增大,18 V制作出的管径为80~120 nm的高度有序排列的TiO2纳米管,纳米银的直径约为20 nm,在剥脱的载纳米银TiO2纳米管TEM图像中可见直径约20 nm的阻射高密度影,可以考虑纳米银已成功原位载入TiO2纳米管中。表面能谱分析相同数目纳米银原位置换载入后,18 V TiO2表面的银含量低于10 V TiO2表面,虑为纳米银导入纳米管中而不单是吸附于表面,使其表面有更少的银含量,对于组织具有更小的细胞毒性。紫外线消毒灭菌后载纳米银TiO2能够有更小的接触角,证明形成更加亲水的表面。Lim等[16]实验研究证明亲水表面有利于成骨细胞的黏附、增殖、分化,还有实验研究证实经过紫外线照射灭菌后的有序的TiO2纳米管能够抑制变形链球菌的黏附[17]。
金黄色葡萄球菌为常见的引起种植体周围炎的细菌[18]。18 V-Ag100样品在第1天有效抑制金黄色葡萄球菌生长,至第3天仍有良好的抑菌的作用,周围浮游细菌抑菌率>95%。FE-SEM显示18 VAg100样品抑制细菌黏附的能力明显高于10 VAg100,证明18 V-Ag100能在种植体植入后最初6 h即细胞细菌竞争种植体表面的关键时刻释放纳米银抑制细菌的黏附,且3 d内持续抑菌,抑菌能力强于10 V-Ag100。为制作种植体周围炎发生率低的种植体材料提供理论依据。
(图7、8见插页)
[1]Hellmann M,Mehta SD,Bishai DM,et al.The estimated magnitude and direct hospital costs of prosthetic joint infections in the United States,1997 to 2004[J].Arthroplasty,2010,25(5):766-771.doi: 10.1016/j.arth.2009.05.025.
[2]Hetrick EM,Schoenfisch MH.Reducing implant-related infections: active release strategies[J].Chem Soc Rev,2006,35(9):780-789.doi:10.1039/B515219B.
[3]Gristina AG.Biomaterial-centered infection:microbial adhesion versus tissue integration[J].Science,1987,237(4822):1588-1595.doi:10.1126/science.3629258.
[4]Bjarnsholt T.The role of bacterial biofilms in chronic infections[J].APMIS Suppl,2013,121(136):1-58.doi:10.1111/apm.12099.
[5]Rams TE,Degener JE,van Winkelhoff AJ.Antibiotic resistance in human peri-implantitis microbiota[J].Clin Oral Implants,2014,25 (1):82-90.doi:10.1111/clr.12160.
[6]Lai M,Cai K,Zhao L,et al.Surface functionalization of TiO2 nanotubes with bone morphogenetic protein 2 and its synergistic effect on the differentiation of mesenchymal stem cells[J].Biomacromolecules,2011,12(4):1097-1105.doi:10.1021/bm1014365.
[7]Zhao L,Mei S,Wang W,et al.Suppressed primary osteoblast functions on nanoporous titania surface[J].J Biomed Mater Res A,2011,96(7):100-107.doi:10.1002/jbm.a.32918.
[8]Gulati K,Ramakrishnan S,Aw MS,et al.Biocompatible polymer coating of titania nanotube arrays for improved drug elution and osteoblast adhesion[J].Acta Biomaterialia,2012,8(1):449-456.doi: 10.1016/j.actbio.2011.09.004.
[9]Hu Y,Cai K,Luo Z,et al.TiO2nanotubes as drug nanoreservoirs for the regulation of mobility and differentiation of mesenchymal stem cells[J].Acta Biomaterialia,2012,8(1):439-448.doi:10.1016/j.actbio.2011.10.021.
[10]Zhao L,Wang H,Huo K,et al.Antibacterial nano-structured titania coating incorporated with silver nanoparticles[J].Biomaterials,2011,32(24):5706-5716.doi:10.1016/j.biomaterials.2011.04.040.
[11]Lan MY,Liu CP,Huang HH,et al.Both enhanced biocompatibility and antibacterial activity in Ag-decorated TiO2nanotubes[J].PLoS One,2013,8(10):e75364.doi:10.1371/journal.pone.0075364.
[12]Roguska A,Pisarek M,Andrzejczuk M,et al.Surface charaterization of Ca-p/Ag/TiO2nanotube composite layers on Ti intended for biomedical applications[J].Biomed Mater Res A,2012,100(8):1954-1962.doi:10.1002/jbm.a.34044.
[13]Mukha Iu P,Eremenko AM,Smirnova NP,et al.Antimicrobial activity of stable silver nanoparticles of a certain size[J].Prikl Biokhim Mikrobiol,2013,49(2):215-223.doi:10.1134/S0003683813020117.
[14]Galdiero S,Falanga A,Vitiello M,et al.Silver nanoparticles as potential antiviral agents[J].Molecules,2011,16(10):8894-8918.doi: 10.3390/molecules16108894.
[15]Panda KK,Achary VM,Krishnaveni R,et al.In vitro biosynthesis and genotoxicity bioassay of silver nanoparticles using plants[J].Toxicol In Vitro,2011,25(5):1097-1105.doi:10.1016/j.tiv.2011.03.008.
[16]Lim JY,Shaughnessy MC,Zhou Z,et al.Surface energy effects on osteoblast spatial growth and mineralization[J].Biomaterials,2008,29(12):1776-1784.doi:10.1016/j.biomaterials.2007.12.026.
[17]Cui CX,Gao X,Qi YM,et al.Microstructure and antibacterial property of in situ TiO2 nanotube layers/titanium biocomposites[J].Journal of the Mechanical Behavior of Biomedical Materials,2012,8: 178-183.doi:10.1016/j.jmbbm.2012.01.004.
[18]Furst MM,Salvi GE,Lang NP,et al.Bacterial colonization immediately after installation on oral titanium implants[J].Clin Oral Implants Res,2007,18(4):501-508.doi:10.1111/j.1600-0501.2007.01381.x.
(2014-06-27收稿 2014-12-27修回)
(本文编辑 魏杰)
Study on antibacterial ability of silver nanoparticles loaded titanium nanotubes
MIAO Jingwen,ZHANG Xu,ZHANG Wenyi,SUN Yingchun,MA Shiqing,GAO Ping△
Stomatological Hospital of Tianjin Medical University,Tianjin 300070,China
△Corresponding Author E-mail:gptj@sina.com
Objective To detect the inhibitory effect of siliver nanoparticles loaded titanium nanotubes on staphylococcus aureus,and provide a theoretical basis for implant local application.Methods Orderly arrangement of titania nanotubes produced by anodic oxidation,loaded silver nanoparticals by situ replacement.Scanning electron microscopy(SEM)and transmission electron microscopy(TEM)were used to detect the morphology topology of silver nanoparticals,titanium nanotubes and siliver particals loaded titanium nanotubes.The minimum inhibitory concentration of silver nanoparticles was calculated.The antibacterial of planktonic bacteria was detected 1 day,3 days and 5 days after culturing staphylococcus aureus on siliver particals loaded titanium nanotubes.The inhibitory bacterial adhesion properties were detected by scanning electron microscopy.Results The uniform and orderly diameter of 80~120 nm TiO2 nanotubes were prepared under 18 V voltage,loaded diameter of 20 nm silver nanoparticals,which effectively inhibited adhesion and proliferation of staphylococcus aureus.Conclusion Titanium nanotubes produced by 18 V have a stronger drug loading capacity.The 100 mmol/L silver nanopartical solution loaded nanotubes can effectively inhibit staphylococcus aureus adhesion and proliferation within three days.
nanotubes;titanium;silver;nanostructures;microbial sensitivity tests;bacterial adhesion
R783.1
A DOI:10.11958/j.issn.0253-9896.2015.05.020
国家科技支撑项目基金(2012BAI07B00);天津市应用基础与前沿技术研究计划项目(14JCYBJC29600);天津市应用基础及前沿技术研究计划青年项目(12JCQNJC09200);全国大学生创新创业计划训练项目(201310062005)
天津医科大学口腔医院(邮编300070)
苗静雯(1989),女,硕士在读,主要从事种植体材料表面改性研究
△E-mail:gptj@sina.com
