碱性成纤维细胞生长因子对人牙龈成纤维细胞成骨分化与增殖的影响
2015-08-24甄珍蒋少云陶玉飞严志敏邓嘉胤
甄珍,蒋少云,陶玉飞,严志敏,邓嘉胤
碱性成纤维细胞生长因子对人牙龈成纤维细胞成骨分化与增殖的影响
甄珍,蒋少云,陶玉飞,严志敏,邓嘉胤△
目的 观察碱性成纤维细胞生长因子(bFGF)对体外培养的人牙龈成纤维细胞(HGFs)成骨分化能力与细胞增殖的影响,探索bFGF在HGFs体外诱导成骨分化过程中的作用。方法 采用组织块贴壁法体外培养HGFs,取第3代细胞进行如下分组培养。1组为普通培养基组,2组为普通培养基+10 μg/L bFGF组,3组为成骨诱导组,4组为成骨诱导+10 μg/L bFGF组。应用四甲基偶氮唑蓝比色法检测HGFs增殖状况;用碱性磷酸酶染色法及茜素红染色法检测HGFs的成骨分化能力。结果 在普通培养基和成骨诱导培养基中,10 μg/L的bFGF均能促进HGFs的增殖(P<0.01);在成骨诱导培养基中HGFs具有骨向分化能力,形成钙结节;而10 μg/L的bFGF对HGFs的碱性磷酸酶活性与矿化结节形成能力均无明显影响。结论 10 μg/L的bFGF能促进HGFs的增殖能力,而对其骨向分化无明显影响。
成纤维细胞生长因子2;成纤维细胞;牙龈;骨生成;细胞分化;细胞增殖
牙周炎作为一种炎症破坏性疾病,不仅表现为牙龈的炎症,而且会引起牙周膜、牙槽骨等牙周支持性组织的破坏吸收,最终导致牙齿松动脱落。如何获得牙周再生是近年来研究的热点。作为牙周组织工程中种子细胞的牙周膜韧带细胞,因为其有限的来源而限制了它的应用。口腔牙龈组织来源丰富,人牙龈成纤维细胞(human gingival fibroblasts,HGFs)可以在体外诱导矿化[1],这为牙周再生中种子细胞的来源提供了一种潜在的可能性。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是一种可促进细胞有丝分裂的多肽生长因子,同时还具有促进血管形成的作用[2],常被局部应用促进创伤的愈合。本实验旨在观察bFGF对HGFs成骨分化能力与细胞增殖的影响,探索bFGF在HGFs体外诱导成骨分化过程中的作用。
1 材料与方法
1.1 材料 L-DMEM细胞培养液、胎牛血清(FBS)、0.25%胰蛋白酶(Gibco,美国),bFGF(Invitrogen,美国),地塞米松、β-甘油磷酸钠、抗坏血酸、茜素红(Sigma,美国),L-谷氨酰胺(Sigma,北京),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Solarbio,北京),5-溴-4-氯-3-吲哚基-磷酸盐/四唑硝基蓝(5-Bromo-4-Chloro-3-Indolyl Phosphate,BCIP/nitroblue tetrazolium,NBT)碱性磷酸酯酶显色试剂盒(华兴博创,北京),氯代十六烷基吡啶(光复精细化工研究所,天津)。
1.2 方法
1.2.1 HGFs体外分离与培养 取就诊于天津医科大学口腔医院颌面外科年轻志愿者因阻生智齿(无龋病或牙周病)拔除术中分离的少量新鲜健康牙龈组织,用含100 U双抗的PBS液充分冲洗,去除表面的血凝块及可能残留的口腔微生物,常规组织块法进行原代培养,于倒置显微镜下严密观察细胞生长状况,待长满瓶底70%~80%时用0.25%胰酶按1∶2传代,取第3代细胞用于实验。
1.2.2 实验分组 1组:普通培养基组(L-DMEM和3% FBS);2组:普通培养基+10 μg/L bFGF组;3组:成骨诱导组(L-DMEM、3%FBS、1×10-7mol/L地塞米松、2×10-3mol/L L-谷氨酰胺、1×10-3mol/L β-甘油磷酸钠和5 mg/L抗坏血酸);4组:成骨诱导+10 μg/L bFGF组。
1.2.3 MTT法检测细胞增殖 取第3代HGFs以3×103/孔密度接种于96孔板中,每孔液量100 μL。贴壁后更换上述分组培养基,每个处理组设置5个复孔,每孔100 μL;调零孔不接种细胞,仅加入相应组别的培养基100 μL。将96孔板放入37℃、5%CO2条件下培养,分别于培养第1、3、5、7、9、11天的同一时刻,每孔加入MTT(5 g/L)20 μL,37℃孵育4 h后吸去孔内培养液,每孔加入150 μL二甲基亚砜,振荡15 min使结晶物充分溶解,选取490 nm波长在紫外分光光度仪上测各孔吸光度(A)值。
1.2.4 碱性磷酸酶(ALP)染色 取第3代HGFs以2×104/孔密度接种于6孔板中。贴壁后更换分组培养基培养细胞,每3 d换液1次,培养至第7天,弃培养基后使用PBS冲洗,4%多聚甲醛固定30 min后再次用PBS洗涤3次,每次5~10 min。使用ALP活性染色试剂盒避光染色15~30 min,在显色对比最明显时弃染色剂终止反应,于倒置显微镜下观察并拍照。
1.2.5 茜素红染色及半定量检测 取第3代HGFs以2× 104/孔密度接种于6孔板中。贴壁后更换分组培养基,每3 d换液1次,第21天终止培养后,4%多聚甲醛固定30 min后进行0.5%茜素红(pH=8.8)室温染色1 h,并在倒置显微镜下观察、拍照。后弃去上清,PBS洗3遍后加入100 mmol/L氯代十六烷基吡啶室温孵育1 h,紫外分光光度仪测562 nm波长处样本的A值,用氯代十六烷基溶液调零,并同时测定一组未加茜素红的单纯细胞上清A值,每个样本重复3次。样本测定A值=样本A值-单纯细胞组A值。
1.3 统计学方法 使用SAS V8统计分析软件对所得数据进行分析,计量资料数据采用均数±标准差(±s)表示,MTT结果采用两独立样本t检验,其余多组间比较采用方差分析,多重比较采用SNK-q法。检验水准为双侧α=0.05。
2 结果
2.1 HGFs原代培养 在组织块贴壁后3~7 d有单个细胞从组织块中爬出,绝大多数呈饱满的长梭形,并呈放射状排列,随培养时间的延长细胞数目增多而向外移行,见图1。传代后细胞呈长梭形,生长迅速,排列密集后呈漩涡状,方向性明显,见图2。

Fig.1 Primary culture of HGFs(×100)图1 原代培养的HGFs(×100)

Fig.2 First passage of HGFs(×100)图2 第1代HGFs(×100)
2.2 bFGF对成骨诱导分化中HGFs增殖的影响 在培养第3天起,增殖情况出现明显差别(P<0.01)。无论在普通培养基中还是在成骨诱导培养基中,bFGF均促进HGFs的细胞增殖,在第7天时达到最强,见表1。
Tab.1 Effect of bFGF on HGFs proliferation during osteogenic differentiation表1 bFGF对成骨诱导分化中HGFs增殖的影响(n=5,±s)
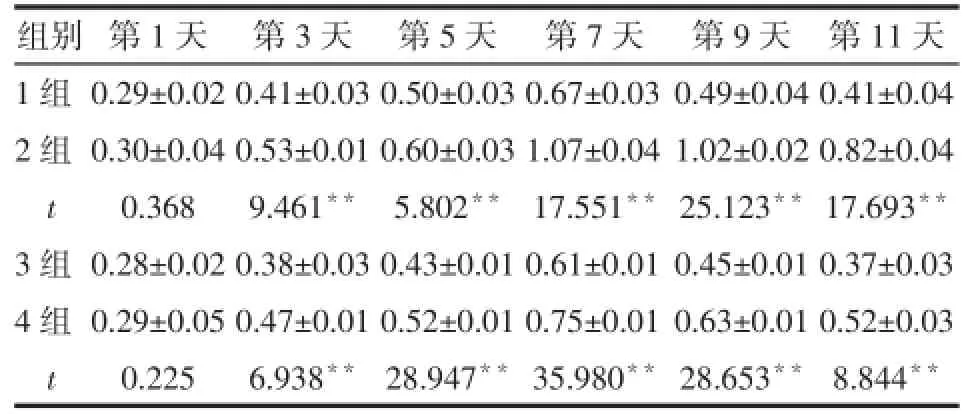
Tab.1 Effect of bFGF on HGFs proliferation during osteogenic differentiation表1 bFGF对成骨诱导分化中HGFs增殖的影响(n=5,±s)
**P<0.01
组别1组2组t 3组4组t 第1天0.29±0.02 0.30±0.04 0.368 0.28±0.02 0.29±0.05 0.225 第3天0.41±0.03 0.53±0.01 9.461**0.38±0.03 0.47±0.01 6.938**第5天0.50±0.03 0.60±0.03 5.802**0.43±0.01 0.52±0.01 28.947**第7天0.67±0.03 1.07±0.04 17.551**0.61±0.01 0.75±0.01 35.980**第9天0.49±0.04 1.02±0.02 25.123**0.45±0.01 0.63±0.01 28.653**第11天0.41±0.04 0.82±0.04 17.693**0.37±0.03 0.52±0.03 8.844**
2.3 bFGF对成骨诱导分化中HGFs ALP活性的影响 普通培养基(1组、2组)不论是否添加bFGF,均无明显着色区;单纯成骨诱导培养基(3组)与添加bFGF(4组)后ALP显色明显,但大体观无明显差别,见图3。光镜下,普通培养基(1组、2组)中的HGFs均无细胞着色,而成骨诱导组(3组)与成骨诱导+bFGF组(4组)均有大量细胞被染为蓝紫色,见图4。
2.4 bFGF对成骨诱导分化中HGFs矿化结节能力的影响 不同培养基培养21 d后,成骨诱导组(3组)与添加bFGF组(4组)均可见明显的钙结节形成;而普通培养基(1组)及添加bFGF组(2组)均无肉眼可见的钙结节着色区,见图5。镜下可见成骨诱导组(3组)与成骨诱导+bFGF组(4组)均有大量红色钙结节形成,普通培养基组(1组)与添加bFGF的普通培养基组(2组)中只有长梭形的成纤维细胞背景而无着色的钙结节,见图6。1~4组的A值分别为 0.032±0.002、0.043±0.002、0.217±0.007和0.207±0.010,差异有统计学意义(F=805.67,P<0.01)。成骨诱导组(3组)与成骨诱导+bFGF组(4组)的A值高于普通培养基组(1组)与普通培养基+ bFGF组(2组);而成骨诱导组(3组)与成骨诱导+ bFGF组(4组)差异无统计学意义。
3 讨论
成纤维细胞是结缔组织中含量最为丰富的细胞类型,HGFs除了具有一般的成纤维细胞特性外,还表现出更高的再生潜能,并且能够起到抗炎及免疫调节的作用[3]。bFGF是一种广谱的有丝分裂原,能促进来源于中胚层和神经外胚层多种细胞的增殖能力[4]。本实验中,无论在普通培养基还是成骨诱导培养基中,bFGF均能促进HGFs的增殖能力。bFGF这种明显促进细胞增殖的能力加之其具有的促血管生成能力,被广泛应用于软组织创伤的愈合与再生[5-6]。
碱性磷酸酶是广泛存在于人体骨骼、胎盘等经肝脏向胆外排出的一种同源二聚体蛋白。本实验所采用的BCIP/NBT是碱性磷酸酯酶的常见底物,在碱性磷酸酯酶的催化下,BCIP会被水解产生强反应性的产物,该产物会和NBT发生反应,形成不溶性的蓝紫色NBT斑,一般用于未分化的干细胞或细胞成骨向分化的检测。从实验结果可看出成骨诱导组与成骨诱导+bFGF组HGFs均表现出明显的ALP着色。既往研究中,不同实验者对bFGF与细胞ALP活性间的研究结果不同,究其原因可能为FGFs家族中不同FGF亚类间的结构和功能的差异,实验细胞种类及实验所选细胞株及其所处生命周期不同,或者所用bFGF含量不同等因素引起。现有研究表明,HGFs在基线水平即有成骨相关基因的表达[7],同时相比于牙周膜细胞中Ⅰ型与Ⅲ型胶原强阳性的表达而言,虽然HGFs这两种胶原的表达能力较弱,但它仍具有牙周膜细胞的一些特性,这都为本实验中HGFs在体外诱导矿化条件下能够增强向成骨细胞分化的趋势提供了一定的理论依据。
成骨细胞在成熟过程中主要经历细胞增殖、基质成熟及矿化形成三个阶段[8]。碱性磷酸酶、Ⅰ型胶原等主要在成骨分化的早期表达[9],而后期细胞与基质的矿化过程中必然有骨钙素的参与。本研究结果显示,在加入bFGF的普通培养基中并未见到矿化结节的形成,说明单纯的bFGF并不具有异位成骨的功能。本实验中,单纯成骨诱导组与加入了bFGF的成骨诱导组两者之间钙结节的半定量测定结果差异并无统计学意义,说明10 μg/L的bFGF对人牙龈成纤维细胞的成骨分化无明显作用。
Maegawa等[10]研究发现在bFGF后序列性使用骨形态发生蛋白-2(BMP-2)可以明显提高骨髓间充质干细胞骨钙素的表达与骨基质的分泌;Qu等[11]将骨髓间充质干细胞转染bFGF后,与纳米羟基磷灰石/聚酰胺66复合材料联用,可以模拟骨缺损部位的骨再生过程;Saito等[12]将bFGF与不同复合材料联合使用于根分叉病变的治疗中,明显提高了牙周结缔组织的附着能力、增加了牙周膜韧带与牙骨质的形成、牙槽骨的沉积;Oortqiesen等[13]在实验性大鼠牙周组织骨内缺损模型中,使用bFGF与磷酸盐接合剂显著提高了牙周膜韧带以及牙槽骨组织的愈合能力。虽然本实验表明10 μg/L的bFGF对HGFs在成骨分化过程中无影响,但是如果将bFGF与其他生长因子时序性作用于HGFs,再联合其他生物支架材料,一方面提高HGFs骨向分化的能力,另一方面利用bFGF自身促进细胞增殖、促进血管生成、与生物材料结合后促进软组织再生的能力,或许可以实现更易得的牙周再生。
(图3~6见插页)
[1]Chen S,Lyu LX,Huang NP,et al.Inducing the differentiation of hu⁃man gingival fibroblasts into osteoblasts in vitro[J].J Med Postgra,2013,26(9):925-927.[陈嵩,吕兰欣,黄宁平,等.人牙龈成纤维细胞体外诱导成骨分化的实验研究[J].医学研究生学报,2013,26(9):925-927].doi:10.3969/j.issn.1008-8199.2013.09.007.
[2]Matsumoto S,Tanaka R,Okada K,et al.The effect of control-re⁃leased basic fibroblast growth factor in wound healing:histological analyses and clinical application[J].Plast Reconstr Surg Glob Open,2013,1(6):e44.doi:10.1097/GOX.0b013e3182a88787.
[3]Zhang QZ,Nquyen AL,Yu WH,et al.Human oral mucosa and gin⁃giva:a unique reservoir for mesenchymal stem cells[J].J Dent Res,2012,91(11):1011-1018.doi:10.1177/0022034512461016.
[4]Bhang SH,Sun AY,Yang HS,et al.Skin regeneration with fibroblast growth factor 2 released from heparin-conjugated fibrin[J].Biotech⁃nol Lett,2011,33(4):845-851.doi:10.1007/s10529-010-0492-5.
[5]Kinoshita N,Tsuda M,Hamuy R,et al.The usefulness of basic fi⁃ broblast growth factor for radiation-exposed tissue[J].Wound Re⁃pair Regen,2012,20(1):91- 102.doi: 10.1111/j.1524-475X.2011.00758.x.
[6]Mutsuzaki H,Ito A,Sogo Y,et al.Enhanced wound healing associat⁃ed with Sharpey's fiber-like tissue formation around FGF-2-apa⁃tite composite layers on percutaneous titanium screws in rabbits[J].Arch Orthop Trauma Surg,2012,132(1):113-121.doi:10.1007/ s00402-011-1381-7.
[7]Zhou Y,Hutmacher DW,Sae-Lim V,et al.Osteogenetic and adipo⁃genic induction potential of human periodontal cells[J].J Periodon⁃tol,2008,79(3):525-534.doi:10.1902/jop.2008.070373.
[8]Cotter EJ,Ip HS,Powderly WG,et al.Mechanism of HIV protein in⁃duced modulation of mesenchymal stem cell osteogenic differentia⁃tion[J].BMC Musculoskelet Disord,2008,13(9):33.doi:10.1186/ 1471-2474-9-33.
[9]Du JJ,Luo ZJ,Hu YY,et al.Expression of collagen I、II and alka⁃line phosphatase in osteogenesis induced by rhBMP-2 enhanced by bFGF[J].Orthop J Chin,2002,9(1):39-42.[杜俊杰,罗卓荆,胡蕴玉,等.bFGF增强rhBMP-2诱导成骨中Ⅰ、Ⅱ型胶原及碱性磷酸酶的表达[J].中国矫形外科杂志,2002,9(1):39-42].
[10]Maegawa N,Kawamura K,Hirose M,et al.Enhancement of osteo⁃blastic differentiation of mesenchymal stromal cells cultured by se⁃lective combination of bone morphogenetic protein-2(BMP-2)and fibroblast growth factor-2(FGF-2)[J].J Tissue Eng Regen Med,2007,1(4):306-313.doi:10.1002/term.41.
[11]Qu D,Li J,Li Y,et al.Angiogenesis and osteogenesis enhanced by bFGF ex vivo gene therapy for bong tissue engineering in recon⁃struction of calvarial defects[J].J Biomed Mater Res A,2011,96(3): 543-515.doi:10.1002/jbm.a.33009.
[12]Saito A,Saito E,Kuboki Y,et al.Periodontal regeneration following application of basic fibroblast growth factor-2 in combination with beta tricalcium phosphate in class III furcation defects in dogs[J].Den Mater J,2013,32(2):256-262.doi:10.4012/dmj.2012-171.
[13]Oortqiesen DA,Walboomers XF,Bronckers AL,et al.Periodontal regeneration using an injectable bone cement combined with BMP-2 or FGF-2[J].J Tissue Eng Regen Med,2014,8(3):202-209.doi: 10.1002/term.1514.
(2014-07-31收稿 2014-12-12修回)
(本文编辑 魏杰)
Effect of basic fibroblast growth factor on osteogenic differentiation and cell proliferation of human gingival fibroblasts in vitro
ZHEN Zhen,JIANG Shaoyun,TAO Yufei,YAN Zhimin,DENG Jiayin△
Department of Periodontology,Stomatology Hospital of Tianjin Medical University,Tianjin 300070,China
△Corresponding Author E-mail:yazhou2991@126.com
Objective To observe the effects of basic fibroblast growth factor(bFGF)on osteogenic differentiation abili⁃ty and cell proliferation of human gingival fibroblasts(HGFs),and to explore the role of bFGF on the process of osteogenicdifferencitiaion in vitro.Methods HGFs were cultured in vitro until the 3rd passage when they were divided into four groups:normal medium as group 1,normal medium with 10 μg/L bFGF as group 2,osteogenic medium as group 3 and osteo⁃genic medium with 10 μg/L bFGF as group 4.MTT assay was used to evaluate the proliferation of HGFs.Alkaline phospha⁃tase(ALP)staining and Alizarin red staining were applied to investigate osteogenic potential of HGFs under different culture conditions.Results bFGF at concentration of 10 μg/L could increase HGFs proliferation in both normal and osteogenic medium(P<0.01).HGFs could be induced towards osteogenic differentiation and form mineralized nodule in osteogenic me⁃dium.However,10 μg/L bFGF had no effects on ALP activity and mineralized nodule formation of HGFs during osteogenic differentiation.Conclusion bFGF could promote the proliferation of HGFs but show no effects on osteogenic differentiation of HGFs at concentration of 10 μg/L.
fibroblast growth factor 2;fibroblasts;gingiva;osteogenesis;cell differentiation;cell proliferation
R781.4+2
A
10.11958/j.issn.0253-9896.2015.04.003
天津市应用基础及前沿技术研究计划(自然科学基金重点项目)(12JCZDJC22700)
天津医科大学口腔医院(邮编300070)
作者信息:甄珍(1989),女,硕士研究生在读,主要从事牙周组织工程的研究。
△E-mail:yazhou2991@126.com
