紫外可见光谱法研究EGCG的稳定性
2015-08-20李邦玉吴媛吴虹燕刘臣
李邦玉 吴媛 吴虹燕 刘臣

摘要:考察绿茶中表没食子儿茶素没食子酸酯在多种体系中的稳定性。通过柱色谱分离纯化绿茶中的表没食子儿茶素没食子酸酯(EGCG)产品;采用紫外可见分光光度法定性研究温度、时间、酸碱、紫外光、溶剂等对EGCG稳定性影响,以及EGCG分别与H2O2、DPPH·的反应。研究结果,温度、时间、酸碱、紫外光等都不同程度影响EGCG稳定性,紫外可见光谱跟踪到了H2O2、DPPH·与EGCG的反应。
关键词:表没食子儿茶素没食子酸酯(EGCG);稳定性;紫外可见分光光度法
中图分类号:TS201.2 文献标志码: A 文章编号:1002-1302(2015)07-0294-03
表没食子儿茶素没食子酸酯(EGCG)是绿茶所含儿茶素中含量最多的功能成分。因为含有多个酚羟基,EGCG具有很强的抗氧化活性,医药工业上应用于抗菌、抗癌、抗衰老等治疗,能够改善癌细胞对化疗的敏感性并减轻对心脏的毒性[1-3]。在食品工业中EGCG应用于抗氧化、保鲜、祛臭等产品,日化工业中作特殊功能添加剂等[4]。但是在含茶叶的食品、药品和饮料的加工和储藏过程中,EGCG易受到温度、金属离子、酶和pH值等因素的影响,极易发生化学变化,从而改变了其原先的结构和生物活性[5-7]。因此考察EGCG的稳定性很有必要。本试验采用紫外可见分光光度法,定性研究不同环境条件下EGCG的稳定性。
1 材料与方法
1.1 材料与仪器
EGCG对照品(南京广润生物制品,98%),DPPH·(Sigma 公司生产)、无水乙醇、30%过氧化氢、盐酸、氢氧化钠、己烷、乙酸乙酯、四氯化碳、三氯甲烷、甲醇,以上药品皆为国产分析纯试剂。绿茶为苏州东山碧螺春茶厂提供。
紫外可见分光光度计:型号UV-1801;十万分之一天平:CPA 225D;电热恒温水浴锅;三用紫外分析仪:WFH-203,上海精科实业有限公司;P230 型高效液相色谱仪:配有P230+紫外检测器;P230/P230p高压恒泵;EC2000 色谱工作站:大连依利特分析仪器有限公司生产;RUC-5200型超声波清洗机:上海睿祺公司生产。
1.2 试验方法
1.2.1 EGCG的分离提纯 取绿茶10 g,置于250 mL容量瓶中,加入95%乙醇150 mL,80 ℃超声提取30 min,提取2次,合并提取液,过滤、80 ℃减压回收乙醇,所得浓缩液上聚酰胺树脂,以乙醇-醋酸梯度洗脱,薄层层析跟踪检测,收集EGCG部位流分,脱色、浓缩、重结晶,得EGCG纯品,液相色谱法检测产品成分与纯度。
1.2.2 浓度对EGCG的影响 依次量取浓度为501.4 μg/mL EGCG储备液 0.10、0.20、0.32、0.49、0.64 mL于25 mL的比色管中,添加无水乙醇至10 mL,配制浓度分别为8、12、16、24、32 μg/mL的梯度溶液,用紫外-可见分光光度计进行光谱扫描。
1.2.3 温度对EGCG溶液的影响 分别吸取浓度为 501.4 μg/mL EGCG储备液2 mL于4支25 mL比色管中,添加无水乙醇至10 mL,制成同浓度的溶液,分别放入室温、40、60、80 ℃温度的水浴锅中30 min,用紫外-可见分光光度计进行光谱扫描。
1.2.4 时间对EGCG溶液的影响 分别吸取EGCG储备液2 mL于5支比色管中,添加无水乙醇至10 mL,制成同浓度的溶液,将其中4支比色管放入80 ℃水浴锅中,分别在1、3、5、7 h后扫描吸收曲线,剩下1支不加热作为原液进行对比。
1.2.5 紫外灯照射对EGCG溶液的影响 分别吸取2 mL EGCG储备液于6支25 mL比色管中,添加无水乙醇至 10 mL,制成同浓度的溶液,将其中的5支比色管置于照射频率为254 nm紫外灯下照射,照射时间分别为20、40、60、320、400 min,留1支比色管不照射紫外光作为对照,用紫外-可见分光光度计进行光谱扫描。
1.2.6 pH值对EGCG溶液的影响 分别吸取0.5 mL EGCG储备液于3支25 mL比色管中,再加入4 mL水,编号1、2、3,1号作为对照液进行定性扫描,向2号比色管中逐滴加入010、0.25、0.40、0.55、0.70、0.85 mL盐酸(0.01 mol/L),分别定性扫描后与原液对比;向3号比色管中逐滴加入0.1、02、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL氢氧化钠(0.01 mol/L),分别定性扫描后与原液对比。
1.2.7 溶剂对EGCG溶液的影响 分别称取EGCG 0.25 mg,转入25 mL比色管中,分别加入水、己烷、乙酸乙酯、四氯化碳、三氯甲烷、甲醇、乙醇定容至25 mL,配制成浓度为10.0 μg/mL EGCG溶液,用紫外-可见分光光度計进行光谱扫描。
1.2.8 H2O2与EGCG溶液的反应 量取4 mL 0.1 mmol/L EGCG储备液至25 mL比色管中,不断滴加0.04 mol/L的过氧化氢溶液,连续扫描其紫外吸收光谱图。
1.2.9 EGCG与DPPH·的反应 量取4 mL 0.1 mmol/L EGCG储备液至25 mL比色管中,不断滴加0.1 mmol/L的 DPPH· 乙醇溶液,连续扫描其紫外吸收光谱图。
2 结果与分析
2.1 液相色谱法检测EGCG产品成分及含量
摸索得到的色谱分离条件为:色谱柱:Shimpak C18(4.6 mm ×150 mm,5 μm);流动相:甲醇-水-冰醋酸(20 ∶80 ∶0.2);检测波长:280 nm;流速:1.0 mL/min;柱温:30 ℃;进样量5 μL。纯化的样品及EGCG对照品色谱如图 1、图2。EGCG 纯度大于97%。
2.2 浓度对EGCG溶液的影响
由图3可知,EGCG在210、276 nm处都有吸收峰。从a到e,随着EGCG溶液浓度升高,EGCG在276 nm处吸收峰位置不变且随着EGCG浓度增大而逐渐升高,可以作为其特征吸收,只是浓度过低时不显著。而在200~220 nm处吸收峰不稳定,随浓度增大而发生红移,所以该处吸收不能作为其特征吸收。
2.3 温度对EGCG溶液的影响
对4组100.2 μg/mL EGCG溶液,分別考察其在室温、40、60、80 ℃的水浴锅中加热30 min后的变化,用紫外-可见分光光度计进行定性光谱扫描。从图4可以看出,随着温度的升高,EGCG溶液吸收曲线基本形状没有变化,只是吸收强度随温度的升高逐渐减弱,说明该浓度的EGCG溶液加热时发生了部分降解,温度越高降解程度越大。王静等发现即使在0 ℃氧化2 min,EGCG的氧化程度也会达0.3[7]。
2.4 加热时间对EGCG溶液的影响
从图5可以看出,80 ℃下放置一段时间后,EGCG溶液吸收曲线大体形状没有改变,276 nm处特征吸收峰位置没有变化,吸光度值随放置时间延长而增大,1~5 h内,吸收峰升高且趋于稳定,而7 h后吸收强度再次大幅增加。276 nm处吸收强度增大应该与EGCG浓度增大没有关系,可能是其他类似物质大量产生引起的。吴平等研究了不同温度热处理的EGCG,发现EGCG的氧化产物比较复杂,无法进行定量分析[8],有待进一步研究。
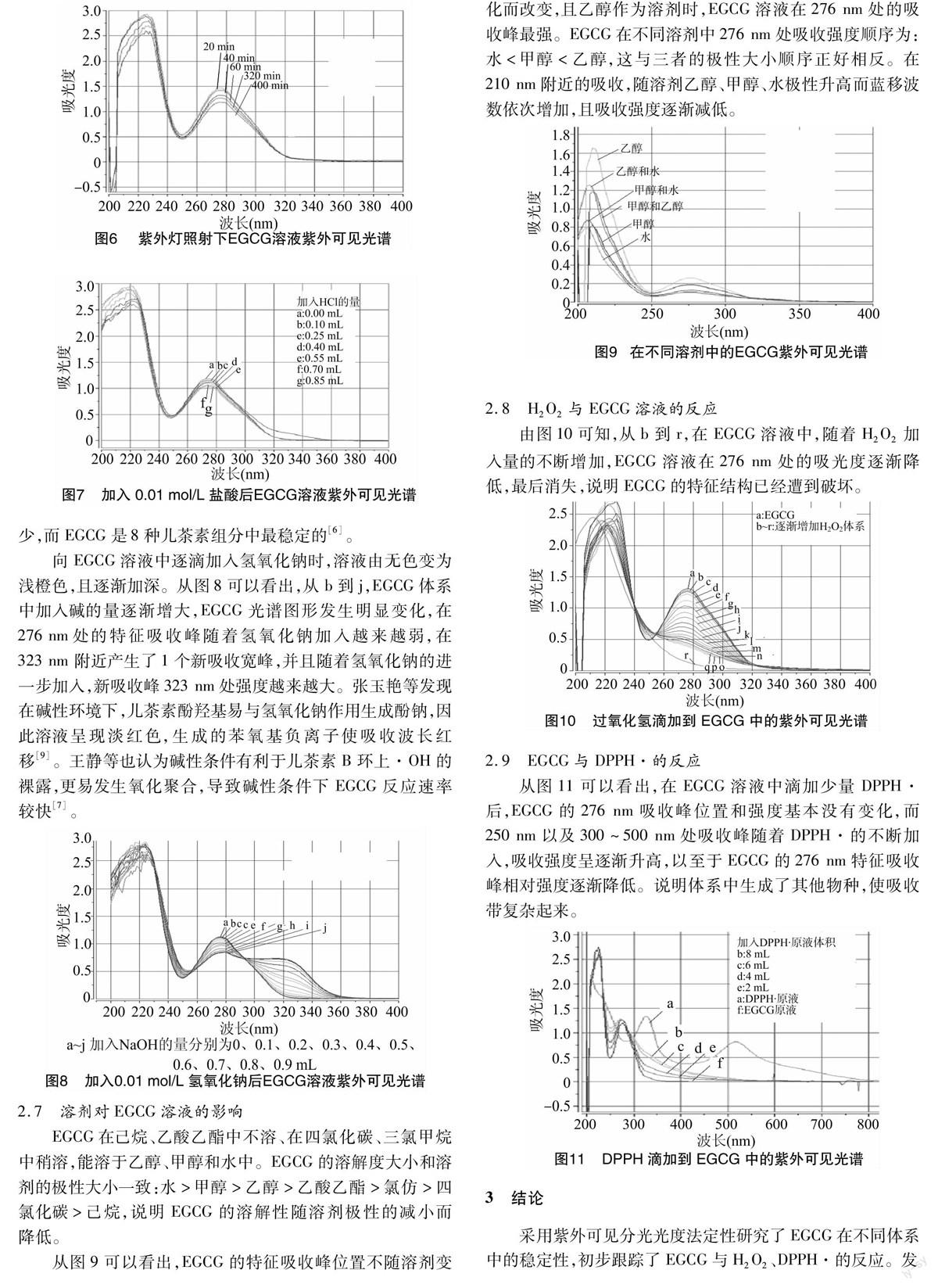
2.5 紫外灯照射对EGCG溶液的影响
从图6可知,EGCG经一段时间紫外光照射后,其吸收曲线基本形状没有明显改变,随着照射时间延长,276 nm处特征吸收强度逐渐降低,可能是EGCG在紫外光照射下逐渐发生某种降解的缘故。
2.6 酸碱对EGCG溶液的影响
由图7可知,EGCG溶液中加入不同量的盐酸后,溶液颜色没有变化,其光谱图基本形状也没有明显变化,从276 nm特征吸收处观察,随着加入盐酸的量逐渐增多,276 nm处吸收强度降低幅度逐渐增大,但是总体幅度不大,说明EGCG在酸性体系中是相对稳定的,随着酸性增强稳定性逐渐有所降低。陈利燕等将不同酸度(pH值分别为2.6、3.6、4.6、5.6)的儿茶素溶液在25 ℃放置18 h后,儿茶素的含量都有所减少,而EGCG是8种儿茶素组分中最稳定的[6]。
向EGCG溶液中逐滴加入氢氧化钠时,溶液由无色变为浅橙色,且逐渐加深。从图8可以看出,从b到j,EGCG体系中加入碱的量逐渐增大,EGCG光谱图形发生明显变化,在276 nm处的特征吸收峰随着氢氧化钠加入越来越弱,在 323 nm 附近产生了1个新吸收宽峰,并且随着氢氧化钠的进一步加入,新吸收峰323 nm处强度越来越大。张玉艳等发现在碱性环境下,儿茶素酚羟基易与氢氧化钠作用生成酚钠,因此溶液呈现淡红色,生成的苯氧基负离子使吸收波长红移[9]。王静等也认为碱性条件有利于儿茶素B环上·OH的裸露,更易发生氧化聚合,导致碱性条件下EGCG反应速率较快[7]。
2.7 溶剂对EGCG溶液的影响
EGCG在己烷、乙酸乙酯中不溶、在四氯化碳、三氯甲烷中稍溶,能溶于乙醇、甲醇和水中。EGCG的溶解度大小和溶剂的极性大小一致:水>甲醇>乙醇>乙酸乙酯>氯仿>四氯化碳>己烷,说明EGCG的溶解性随溶剂极性的减小而降低。
从图9可以看出,EGCG的特征吸收峰位置不随溶剂变化而改变,且乙醇作为溶剂时,EGCG溶液在276 nm处的吸收峰最强。EGCG在不同溶剂中276 nm处吸收强度顺序为:水<甲醇<乙醇,这与三者的极性大小顺序正好相反。在210 nm附近的吸收,随溶剂乙醇、甲醇、水极性升高而蓝移波数依次增加,且吸收强度逐渐减低。
2.8 H2O2与EGCG溶液的反应
由图10可知,从b到r,在EGCG溶液中,随着H2O2加入量的不断增加,EGCG溶液在276 nm处的吸光度逐渐降低,最后消失,说明EGCG的特征结构已经遭到破坏。
2.9 EGCG与DPPH·的反应
从图11可以看出,在EGCG溶液中滴加少量DPPH·后,EGCG的276 nm吸收峰位置和强度基本没有变化,而 250 nm 以及300~500 nm处吸收峰随着DPPH·的不断加入,吸收强度呈逐渐升高,以至于EGCG的276 nm特征吸收峰相对强度逐渐降低。说明体系中生成了其他物种,使吸收带复杂起来。
3 结论
采用紫外可见分光光度法定性研究了EGCG在不同体系中的稳定性,初步跟踪了EGCG与H2O2、DPPH·的反应。发现EGCG的稳定性较差,温度、紫外光照、持续受热、酸碱条件、氧化剂和自由基等都会引起它的分解或转化。EGCG与H2O2、DPPH·的反应过程中紫外可见吸收光谱连续变化明显。
参考文献:
[1]仉燕崃,李 楠,韩国柱,等. 表没食子儿茶素没食子酸酯的研究进展[J]. 中草药,2006,37(2):303-306.
[2]朱发伟. 茶叶中表没食子儿茶素没食子酸酯的研究进展[J]. 中草药,2005,36(8):1271-1272.
[3]葛 建,林 芳,李明揆,等. 表没食子儿茶素没食子酸酯(EGCG)生物活性研究进展[J]. 安徽农业大学学报,2011,38(2):156-163.
[4]臧 鹏,屈维丽,于燕波,等. 表没食子儿茶素没食子酸酯在食品体系中的抗氧化作用研究[J]. 食品工业科技,2011,32(11):361-363.
[5]陈惠衡,傅冬和,施 玲,等. 儿茶素稳定性试验研究[J]. 食品研究与开发,2009,30(4):10-12.
[6]陈利燕,屠幼英,陈 暄,等. 儿茶素在酸性环境中的稳定性研究[J]. 茶叶,2002,28(2):86-88.
[7]王 静,戚向阳. 表没食子酸儿茶素没食子酸酯体外氧化影响因素及其氧化产物分析[J]. 精细化工,2006(11):1094-1098.
[8]吴 平,夏 涛,高丽萍,等. 热处理过程中表没食子儿茶素没食子酸酯变化的动力学研究[J]. 食品与发酵工业,2010,36(11):34-39.
[9]张玉艳,沈生荣,唐德松,等. Cu2+与EGCG络合作用的研究[J]. 浙江大学学报:农业与生命科学版,2004,30(3):290-295.
