Trizol法提取普通小球藻总基因组DNA
2015-08-20段文斌金刚代建国张丽君栾崇林于
段文斌 金刚 代建国 张丽君 栾崇林 于化泓
摘要:Trizol法主要应用于动植物RNA提取,由于其在提取RNA的过程中将DNA有效分离到有机相中,并且在有机相中DNA未被降解,因此本研究采用Trizol法提取具有细胞壁的普通小球藻的基因组DNA,发现提取得到的DNA纯度和产率高,且DNA完整性好。经检测:D260 nm/D280 nm=1.86,平均得率为977 μg/g鲜质量;琼脂糖电泳检测其条带清晰,未发生降解。该方法具有简单快速获得高纯度和高产率的小球藻基因组DNA的优点。
关键词:Trizol法;普通小球藻;DNA提取
中图分类号:S917 文献标志码: A 文章编号:1002-1302(2015)07-0033-02
Trizol法最早由Chomczynski等提出,用于提取细胞或组织中的总RNA[1]。经过Trizol处理过的样品,其总RNA、DNA及蛋白质分别分布在上层水相、中间层、下层有机相。Trizol试剂中含有的苯酚、异硫氰酸胍等物质,将细胞迅速破碎,并抑制释放出来的核酸酶,同时能够保持RNA、DNA的完整性,因此对RAN、DNA的同时提取纯化十分有用[2],大大节约试验时间,提高试验效率。小球藻(Chlorella vulgaris)作为一种单细胞绿藻,具有极强的光合自养能力;含有丰富的脂质、蛋白质、维生素、核酸、食物纤维、叶绿素等,都是人体健康不可或缺的营养物。小球藻还生产多种生物活性物质[3]。由于其脂类可以达到细胞干质量的10%~30%而被用于生产生物柴油[4-5];通过转基因小球藻可以被用来生产病毒抗体[6];也发现小球藻具有抗菌活性[7];小球藻可以治理重金属、有机物以及氮磷污染[8]。因此,科研工作者开始对小球藻进行深入研究。本研究尝试使用Trizol法[9]提取小球藻基因组DNA,以期获得简单快速获取高纯度高产率基因组DNA的方法。
1 材料与方法
1.1 材料
普通小球藻购自中国科学院典型培养物种保藏委员会海洋生物种质库,使用SE培养基培养,在三角瓶中培养,培养温度为25 ℃,光照强度条件为2 000 lx,光暗周期设置为12 h/12 h;培养至对数后期取样,试验前将普通小球藻4 ℃黑暗处理24 h,将细胞内储存的淀粉消耗掉,将有利于DNA的提取。
1.2 试剂
Trizol Reagent 购自Invitrogen公司,氯仿、无水乙醇及异丙醇均为国产分析纯,10 mol/L NH4Ac,TE(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH值8.0),70%乙醇。
1.3 仪器
离心机:德国Eppendorf公司生产;凝胶成像系统:美国SYNGENE公司生产;核酸/蛋白分析仪;BECKMAN COULTER DU800;酶标仪:Thermo Fisher SCIENTIFIC。
1.4 试验步骤
将培养至对数期(D680 nm约为0.6[10])的普通小球藻 300 mL 在1 500 g下离心5 min进行收集并称鲜质量(500~600 mg),用新鲜培养基重悬浮1次,并再次离心收集;加入 5 mL Trizol试剂,吹打混匀,转入玻璃匀浆器研磨10 min;加入1.5 ml氯仿,混合均匀,在10 000 g、室温下离心10 min,弃上层水相和中间变性蛋白层,吸取下层有机相至新的离心管中;加入等体积的无水乙醇沉淀DNA,-20 ℃静置10 min,10 000 g、室温下离心10 min;弃去上清,加入100 μL TE溶解管底的DNA沉淀,吹打混匀,加入40 μL 10 mol/L NH4Ac,混匀,4 ℃静置10 min,10 000 g、室温下离心10 min;吸取上清至新的离心管中,加入140 μL的异丙醇,混匀,-20 ℃放置10 min,12 000 g、室温下离心10 min,弃去上清;加入70%的乙醇洗涤2次沉淀,离心,吸去离心管底的液体,在室温下晾干5 min,加入80 μL TE溶液溶解DNA。
1.5 检验方法
使用1%的琼脂糖凝胶电泳分析以及核酸/蛋白分析仪测定其D260 nm、D280 nm及其比值;取5 μL溶有DNA的TE溶液稀释400倍后进行DNA浓度测定,并根据DNA浓度计算公式(DNA浓度=稀释倍数×D260 nm×50/1000)计算出浓度值,计算结果单位为μg/μL。
2 结果与分析
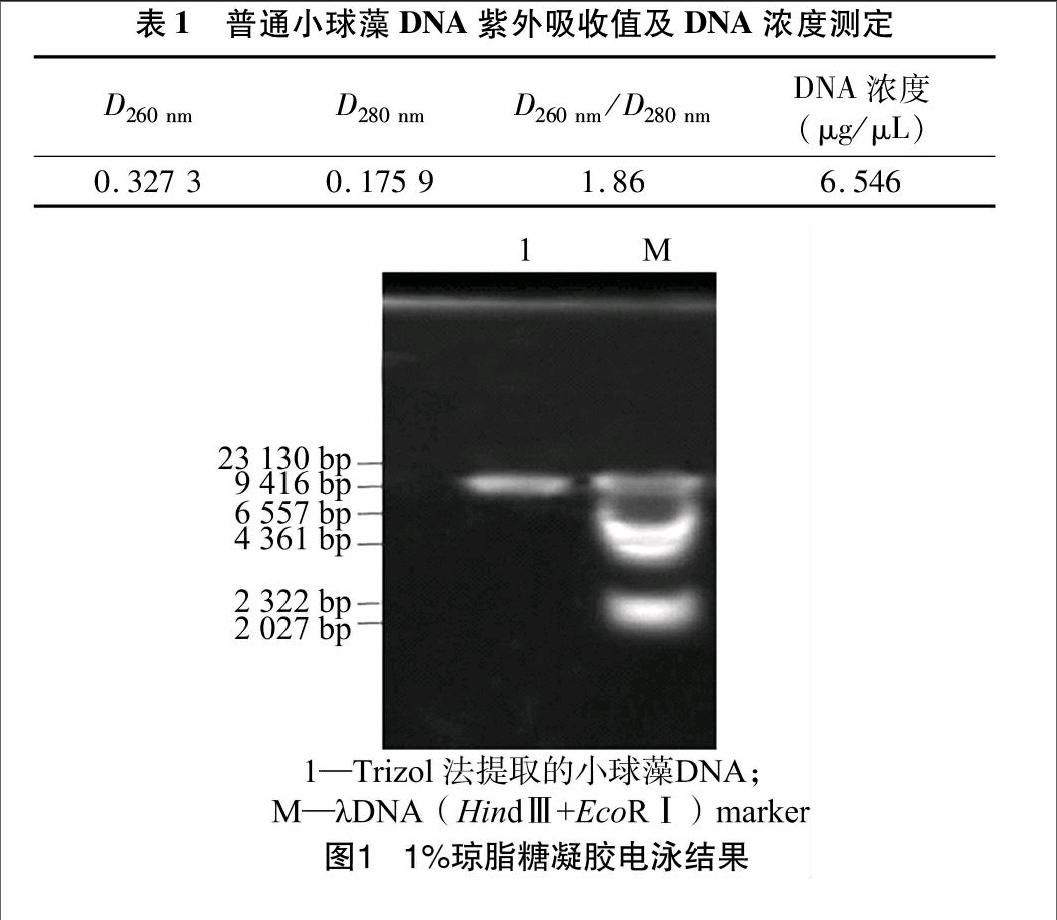
使用Trizol法提取普通小球藻基因组DNA,其紫外吸收光谱在260 nm、280 nm波长处都有吸收峰,D260 nm/D280 nm值为1.86,表明该方法提取得到的DNA样品没有蛋白质等其他杂质,纯度较高(表1);并且具有高DNA产率,平均产率为977 μg/g鲜质量)。从图1可以看出,琼脂糖凝胶电泳成像后的图像中点样孔处干净,表明并没有蛋白质污染;DNA条带单一,无拖尾及降解现象,说明所提取的DNA完整性好并且没有RNA污染,电泳图谱与21 kb位置相齐。
3 讨论
由于小球藻具有很厚的细胞壁[11],并且是单细胞真核藻类,细胞直径3~8 μm,这些小球藻自身的特性给小球藻基因组DNA提取造成了不小困难,其细胞壁破碎和细胞溶解效果对基因组DNA的提取产率和效果具有较大影响;已有小球藻基因组DNA提取方法[12],如任学艳等的SDS法[13]。SDS法试验步骤较多,在研磨时由于没有缺少合适的保护试剂,DNA容易被降解,影响到基因组DNA的产率和提取速度。CTAB法现在有较多的改进方法[13-14],但是基因组得率较低,张桂和等提取的蛋白核小球藻(Chlorella pyrenoidosa)得率为 695 μg/g鲜质量[14]。陈颖等的超声波法和纤维素酶法有RNA污染、DNA降解以及产率低的问题。本试验采用加入Trizol后进行玻漓匀浆器研磨,一是保证小球藻的充分破碎,对小球藻基因组DNA起到保护作用,是保证基因组DNA的得率的重要因素。
本试验设计出了提取普通小球藻基因组DNA的方法;该方法稳定可靠,并且具有简单快速获取高纯度和高产率基因组DNA的优点。该方法可以被用于分子生物学试验作为常规提取普通小球藻基因组DNA的方法。
参考文献:
[1]Chomczynski P,Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate phenol chloroform extraction[J]. Analytical Biochemistry,1987,162(1):156-159.
[2]秦娟娟,路志勇,焦章平,等. 改良TRIzol法同步提取血液RNA和DNA[J]. 法医学杂志,2013,29(3):209-211.
[3]Daniell H,Chebolu S,Kumar S,et al. Chloroplast-derived vaccine antigens and other therapeutic proteins[J]. Vaccine,2005,23(15):1779-1783.
[4]邹 宁. 生物反应器培养藻类生产生物柴油技术[C]// 2008农业生物环境与能源工程国际论坛论文集. 北京:中国农业工程学会,2008:130-133.
[5]赵引德. 新奥微藻制生物柴油中试成功[N]. 中国化工报,2008-12-12(2).
[6]Hayashi K H,Hayashi T. A screening strategy for selection of anti-HSV-1 and anti-HIV extracts from algae[M]. Chichester,UK:John Wiley&Sons Ltd,2009:264-271.
[7]江红霞,郑 怡. 8种微藻抗菌活性研究[J]. 福建师范大学学报:自然科学版,2002,18(2):117-120.
[8]浩云涛. 椭圆小球藻(Chlorella ellipsoidea)的污水净化效应及其对Cd2+的耐受性机制[D]. 南京:南京师范大学,2002.
[9]王暑辉,徐 倩,徐 筱,等. 富含多糖多酚的侧柏叶片总RNA提取方法[J]. 吉林农业大学学报,2012,34(1):76-80,89.
[10]李士虎,朱 明. 分光光度法测定单胞藻数量初步研究[J]. 淮海工学院学报:自然科学版,2001,10(增刊1):8-9.
[11]Hiroshi T,Tayoyasu H. Studies on the cell wall of Chlorella Ⅲ:Incorporation of photosythetically fixed carbon into cell wall of synchronously growing cells of Chlorella ellipsoidea[J]. Plant & Cell Physiology,1982,23(6):1033-1040.
[12]陈 颖,刘根齐,李文彬,等. 3种小球藻DNA提取方法的比较[J]. 植物生理学通讯,2001,37(3):242-244.
[13]王恒强,孔庆军,任雪艳,等. 小球藻的分离及其DNA提取方法的研究[J]. 农业科学与技术:英文版,2008,9(4):44-46.
[14]张桂和,徐碧玉,王 珺. 几种海洋微藻基因组DNA的分离提取及PCR检测[J]. 热带海洋学报,2007,26(1):68-72.
