橡胶树SSR—SRAP—AFLP标记遗传图谱构建
2015-08-20王惠君王文泉和丽岗贺军军
王惠君 王文泉 和丽岗 贺军军

摘要:利用橡胶树GT1与IAN873杂交组合183株实生苗的F1代群体作为构图群体,利用SSR、SRAP、AFLP等3种分子标记对该群体进行遗传连锁分析,构建1张包括18个连锁群、372个标记位点的橡胶树分子遗传连锁图(LOD≥3),其中包括19个SSR标记、73个SRAP标记、280个AFLP标记,连锁图谱的总图距覆盖1 735.9 cM,所有标记间的平均图距为5.22 cM。在此连锁图谱上的标记区间为[8,46],所有连锁群长度区间为[55.3 cM,134.7 cM]。LG9连锁群包含标记最少为8个;LG1连锁群包含标记最多为46个;LG1的平均图距最小为2.80 cM;LG17的平均图距最大为7.92 cM。总图谱中存在图距大于20 cM的空隙为5个。
关键词:橡胶树;分子标记;遗传连锁图谱
中图分类号:S794.101 文献标志码: A 文章编号:1002-1302(2015)07-0041-05
收稿日期:2015-01-04
基金项目:国家自然科学基金 (编号:31261140363、31000537、31171230);中央级公益性科研院所基本科研业务费专项(编号:ITBBZX0843);国家重点基础研究发展计划(编号:2010CB126601)。
作者简介:王惠君(1981—),男,山西原平人,硕士,助理研究员,从事生物多样性研究。E-mail:382494058@qq.com。
通信作者:王文泉,博士,研究员,博士生导师,从事热带生物资源、热带经济作物结构基因组学与分子育种及热带珍稀濒危野生植物的保护生物学研究。E-mail:wquanw@hainan.net。
橡胶树(Heva brasiliensis)属大戟科橡胶树属植物[1],原产于南美洲亚马逊河流域。具有高弹性及耐高温等特性的天然橡胶是合成橡胶不可替代的材料,也是重要的战略物资、工业原料。虽然分子标记技术在橡胶树研究方面已取得了一定进展,但关于橡胶树分子生物学研究还很欠缺。Lespinasse等以橡胶树杂交组合(PB260×RO38 106) F1代群体为材料,构建了第1张总图距为2 144 cM及标记间平均图距为3 cM的橡胶树遗传图谱,包含18个连锁群,由301个RFLP标记、388个AFLP标记、18个SSR标记、10个同工酶标记组成[2]。和丽岗利用杂交组合(IAN873×GT1)的195个 F1代群体构建了总图距为1 455.57 cM及标记间平均距离为 558 cM 的AFLP连锁遗传图,包含18个连锁群,由261个AFLP标记组成[3]。冯素萍等以杂交组合(IAN873×热研88-13)的94个F1代群体构建了总图距为1 937.06 cM及标记间平均距离21.29 cM的连锁群,包含18个连锁群,由91个SSR标记组成[4]。王惠君利用杂交组合(IAN873×GT1)的F1代群体构建了总图距为774 cM及标记间平均距离为11.38cM的连锁遗传图,该图包括18个连锁群,由7个SSR标记、61个SRAP标记组成[5]。Triwitayakorn等用EST-SSR分子标记构建了总图距为842.9 cM且包含23个连锁群的橡胶树连锁遗传图[6]。以上遗传图谱为进一步分析橡胶树重要性状的QTL定位及分子标记辅助选择育种奠定了基础。本试验应用SSR、SRAP、AFLP等3种分子标记技术对橡胶树杂交组合(IAN873×GT1)的195株实生苗的F1代群体构建高密度的橡胶遗传连锁图谱,旨在为开发利用橡胶树资源提供依据。
1 材料与方法
1.1 作图群体的构建
GT1:天然橡胶生产国主要栽培品种的魏克汉种质,具有抗寒、中产、抗旱特点。IAN873:抗南美叶疫病无性系品种的非魏克汉种质,抗寒但不抗风,生长量、产量比GT1高。以云南省热带作物研究所提供的利用非近交亲本橡胶树杂交组合(IAN873×GT1)得到的183个F1代群体作为构图群体。
1.2 基因组DNA的提取
以橡胶树嫩叶片作为材料,选用改良CTAB法[7]提取橡胶树基因组DNA。改良提取缓冲液的组成为:Tris/HCl(pH值8.0)100 mmol/L,EDTA(pH值8.0)60 mmol/L,NaCl 1.4 mol/L,CTAB 2%。用琼脂糖凝胶1.5%电泳分析检测提取的DNA;用紫外分光光度计法检测其浓度、纯度。
1.3 SSR分析
参照网站公布的信息进行SSR引物的合成。SSR扩增反应参照冯素萍等的方法[4],采用25 μL体系并且在ABI-PCR仪上进行PCR扩增反应,扩增反应程序为:94 ℃预变性 5 min;94 ℃ 变性1 min,60 ℃复性30 s,72 ℃延伸1 min,34个循环;72 ℃延伸10 min,4 ℃保存。
1.4 SRAP分析
设计SRAP引物序列[8],所用引物由上海生物工程技术有限公司提供,其中F-primer合成32条,R-primer 合成21条。依据薛丹丹等报道[9],设定的原初20 μL反应体系优化后为DNA模板50 ng、10×PCR buffer (Mg2+) 2.0 μL、dNTPs(20 mmol/L) 0.4 μL、F-primer(50 ng/μL)0.6 μL、R-primer(50 ng/μL)0.6μL、Taq(5 U/μL)0.4 μL、ddH2O 15.0 μL。参照Li等的PCR扩增反应程序:94 ℃ 5 min;94 ℃ 45 s,35 ℃ 45 s,72 ℃ 1 min,5个循环;随后将退火温度升至51 ℃,34个循环;72 ℃延伸9 min,4 ℃下保存。使用琼脂糖凝胶1.0%电泳对此PCR扩增反应产物进行检测。
1.5 AFLP分析
参照王惠君等的方法[10],限制性内切酶采用经典的EcoRⅠ、MseⅠ组合。酶切程序和DNA片段与接头的连接同时进行。每个DNA样品酶切连接反应,反应体系20 μL:DNA 500 ng,T4连接酶缓冲液2 μL,ATP 1.25 μL,MseⅠ、EcoRⅠ接头分别1 μL,EcoRⅠ和MseⅠ0.3 μL,T4连接酶 0.6 μL;设定的反应程序为37 ℃ 380 min、16 ℃ 380 min。酶切链接的产物稀释后才可以使用,选择浓度稀释到原液的 1/3 进行预扩增反应。预扩增体系20 μL:取酶切连接稀释后DNA 产物 5 μL,缓冲液 2 μL,MSeⅠ引物 (M00) 和EcoRⅠ引物(E00)各0.6 μL(其中Primer E00:5′-GACTGCGTACCAATT CA-3′、Primer M00:5′-GATGAGTCCTGAG TAAC-3′)dNTPs 0.4 μL,Taq酶0.12 μL。参数设置为:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 40 s,72 ℃ 80 s,31个循环;最后72 ℃ 5 min。预扩增引物后再增加2个碱基作为选择性扩增引物,进入选择性扩增阶段,用8对EcoRⅠ、MseⅠ引物进行组合,即64个引物组合。参数设置为:94 ℃ 3 min;94 ℃ 30 s,65 ℃ 40 s(-1 ℃/循环),72 ℃ 80 s,12个循环(梯度PCR);94 ℃ 30 s,56 ℃ 30 s,72 ℃ 75 s,22个循环;最后72 ℃ 5 min。扩增反应均在BIOMITRA-T1热循环仪上进行。
1.6 数据转换及作图软件应用
记录的分离谱带是由作图的F1群体亲本谱带所决定的,SRAP标记、大多数的AFLP标记属于显性标记,母本、父本有的谱带记录为1,无谱带记录为0;SSR标记和少数的AFLP标记属于共显性标记,记录谱带时只要与父本谱带一致的记录为A,与母本谱带一致的记录为B,如果是杂合的记录为H;此外不管显性标记还是共显性标记,只要谱带缺失或者模糊的均记为“-”;估计多态性谱带的分子量大小是依据与标准分子量 DL2 000 标准带型的相对位置。对于一些引物,假如1对引物同时可以检测到几个位点,依据扩增出分子量大小排序,按从大到小的原则标记。在其所用引物后加“-1、-2、-3”和“-a、-b、-c”符号进行区别标记。作图之前,按照JoinMap3.0要求的数据格式将A、B、H或者0、1转换成原始矩阵所要求的数据格式a、c;不同水平偏分离的标记在其后面用“*”表示;输入所需数据后,用LOD groupings进行计算并获得连锁群,输出遗传连锁图谱[11-12]。
2 结果与分析
2.1 筛选引物及多态性标记
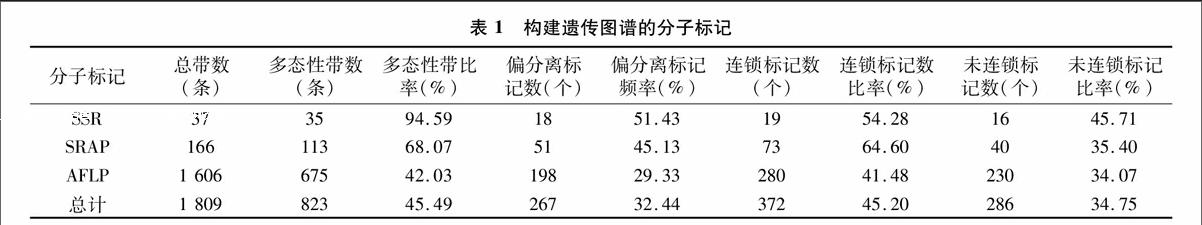
利用SSR、SRAP、AFLP等3种分子标记技术对橡胶树进行遗传图谱构建。选择来自NCBI的30对SSR引物分别进行多态性筛选,对2个亲本进行筛选,其中有13对引物多态性丰富且谱带稳定。从13对引物中扩增出37条带,其中35条为多态性带,多态性比率高达94.59%。在显著水平(5%)上共发现18个标记表现为偏分离,比率达51.43%。对96对引物组合双亲进行SRAP筛选分析,从中筛选出20个扩增比较好且存在明显多态性引物的组合,共获得166条带,经过分析,其中有113条为多态性谱带,多态性比率为68.07%,SRAP多态性、重复性较好。在显著水平(5%)上发现共有51个标记表现为偏分离,频率达45.13%。用64对AFLP组合引物双亲本进行筛选分析,从中筛选出具有明显多态性的标记13对。总共获得675个多态性位点,对这些遗传位点的标记分离比进行统计分析,剔除不用于作图的异常分离标165个,在显著水平(5%)上发现198个标记表现为偏分离。其中符合作图要求的以3 ∶1分离模式比例的标记共有162个,符合1 ∶1分离模式比例的标记共有150个(表1)。
2.2 分子标记分离分析及遗传图谱的构建
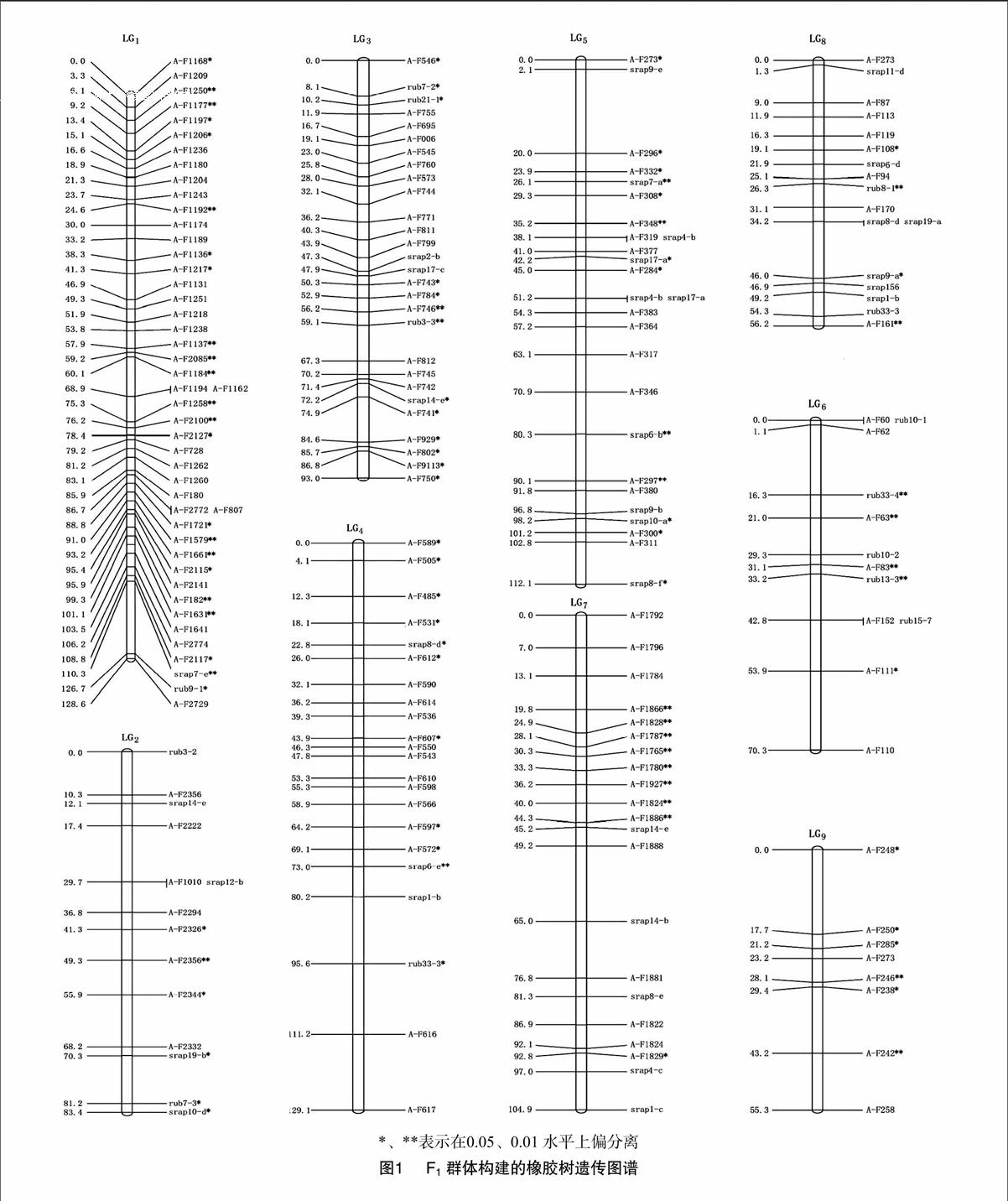
利用JoinMap3.0对823个多态性标记进行遗传连锁分析作图,在LOD≥3条件下获得包含372个标记(其中SSR标记19个,SRAP标记73个,AFLP标记280个)、18个连锁群的橡胶树遗传图谱(图1),连锁群数目与橡胶树18对染色体数目相一致。其中SSR、SRAP及AFLP标记的比例分别为5.1%、19.3%、75.3%。获得最终的遗传连锁图谱覆盖总长度为1 735.9 cM,标记间的平均图距为 5.22 cM。连锁群上的标记数区间范围为[4,46],连锁群的长度区间范围为[55.3 cM,134.7cM],群内平均图距区间[127 cM ,17.02 cM](表2)。用于连锁分析的823个标记当中,首先剔除掉异常分离标165个AFLP标记,其中286个标记未构建入连锁群,占34.75%,286个标记中包括230个AFLP标记、40个SRAP标记、16个SSR标记。构建的18个连锁群中,LG9包含标记数最少,为8个;LG1包含的标记数最多,达46个。整个遗传连锁图谱最小图距为0.5 cM,在LG1上,最大图距为25.2 cM,在LG11上;平均图距最小为 280 cM,分布在LG1上;平均图距最大为7.92 cM,分布在LG17上;遗传图谱包含5个空隙(≥20 cM),LG11上2个,LG15、LG17、LG18各1个。
2.3 偏分离分析
构建的橡胶树遗传连锁图上包含372个标记位点,其中5%水平上包含47个标记位点不能满足孟德尔分离比,其偏分离水平表现显著的标记占总标记的12.63%;在1%水平上包含119个标记位点不能满足孟德尔分离比,其偏分离水平表现极显著的标记占总标记的 32.00%。连锁群上偏分离标记占总标记的44.62%。从偏分离位点的分布来看,每个连锁群上均有分布。其中 LG1上偏分离标记个数最多为23个,占LG1总标记数的50.00%;LG11、LG16上的偏分离标记个数最少,都为1个,分别占LG11、LG16的8.33%、11.11%,同时LG16上的偏分离标记在所有连锁群中所占比例也是最少的;LG9上的偏分离标记在所有连锁群中所占比例最多,为7500%;其中 LG7、LG10上的偏分离标记分布与其他连锁群相比较聚集。其他大部分偏分离位点在连锁群上分布比较均匀。
3 结论与讨论
3.1 SSR、SRAP及AFLP作图分析
本研究主要利用SSR、SRAP及AFLP等3种分子标记进行遗传连锁图谱的构建,结果显示,AFLP标记在遗传图谱作图中所占比例最多,虽然此种标记的信息量非常丰富,但是试验程序要求精度高并相对繁琐,同时聚集现象频繁导致在所绘制连锁群上出现较多大的空隙。SSR 标记虽然揭示的多态性较丰富、可信度、重复率较高,但开发引物费用较高,因此开发的SSR标记不多。SRAP分子标记试验操作容易、结果稳定、扩增条带清晰,较容易进行数据分析,并且过程简单,重复
性好。开发的SRAP引物中包含CCGG、AATT的核心序列,保证扩增反应是针对基因组的开放阅读框区域。此种特殊性增强了扩增反应结果与表型的相关性,同时可以更多地揭示所选材料表型差异性。因此,适用于较高密度遗传图谱的构建。
3.2 作图群体及图谱构建分析
橡胶树为大戟科橡胶树属植物,属于高度杂合的高大乔木,异花授粉,世代周期较长,基因组庞大,遗传背景相关材料较少,因而很难得到像其他农作物一样的重组近交系作为遗传作图,这给橡胶树遗传图谱构建带来一定困难。大部分林木具有无性繁殖特性,这个特点对保存作图群体较为有利,作图群体建立后就可以永久性保存,同时还可以反复测定性状。以大多数林木的重要经济性状作为数量性状,凭借这一特性进行QTL(数量性状位点)定位分析较为容易,从而可以建立或选择1个较为理想的分离群体作为构建遗传图谱的首要条件。目前林木遗传作图群体较为常用的方法主要有半同胞作图群体、全同胞交配群体、单倍体作图群体(针叶树)、F1作图群体、F2群体、回交1代(BC1)群体、回2代群体(BC2)。依据双假测交理论[12-14],即一方亲本的大部分杂合位点在另一方亲本呈显纯隐性或为杂合位点时,这些位点在F1代群体中发生分离。亲本材料遗传差异越大,多态性也就越高,越有利于丰富图谱信息量。因此,本研究以橡胶树质量性状相差较大的IAN873×GT1的F1代183株实生苗群体作为构建橡胶树遗传图谱材料。
在分子生物学领域,大多数学者认为,作为1个染色体连锁框架图最低要求为所用标记间的平均距离不能大于 20 cM。用于进行主效基因定位作为试验目的构建的连锁框架图谱的平均距离范围一般区间为[10 cM,20 cM],遇到特殊情况时平均距离要求更小。如以基因克隆作为试验目的的最低要求为所克隆基因的目标区域标记间的平均图距区间为[0 cM,1 cM]。如用于QTL定位分析作为试验目的的最低要求为平均距离范围区间为[0 cM,10 cM]。本试验所构建的橡胶树遗传连锁框架图谱除了有5个大于20 cM的空隙外,该图的图距和平均图距区间范围分别为[0.5 cM,19.6 cM]和[2.80 cM,7.92 cM],符合农艺性状QTL分析和主效基因定位的最低要求。因此,本试验可作为橡胶树农艺性状QTL分析的基础。
3.3 偏分离分析
生物学界普遍认为,分离现象也是生物进化的推动因素之一[13],导致偏分离的原因很多。目前主要原因有:遗传搭车效应[14-15],即在母本体内存在使雄配子体失活的相关基因,此类基因位点转录出来的酶或RNA等影响配子体的存活力、竞争力,从而调控配子体选择。染色体丢失,即当物种杂交时染色体片段可能发生丢失,在同一连锁群上所用的标记发生偏离[16]。花粉选择的结果,即在合子形成前柱头与花粉之间的相互作用抑制了部分基因漂流,当合子形成后会引起败育,很有可能是由于结构上存在差异或同源染色体遗传,或者是自交引起的不亲和性导致的主要隔离机制[17-21]。数据统计时因各种原因如试验环境、操作程序、试剂、仪器等也会引起误差,导致谱带清晰度差异,不同个体间谱带缺失、谱带辨认模糊以及操作人员的误判等也可能会导致偏分离。本试验中,1%水平上偏分离的标记率为 32.00%,5%水平上比率为 12.63%,未表现出有较为明显偏向亲本某一方趋势的。偏分离标记个数分布最多的在 LG1上为23个,偏分离标记所占比例大于0.6在LG9、LG10、LG 18上,说明在以上连锁群当中分布影响偏分离的遗传因子区域可能较为广泛存在。
参考文献:
[1]王惠君,王文泉,杨子贤,等. 橡胶综述[J]. 安徽农业科学,2006,34(13):3049-3052.
[2]Lespinasse D,Rodier G M,Grivet L,et al. A saturated genetic linkage map of rubber tree(Heavea spp.) based on RFLP,AFLP microsatellite and isozyme markers[J]. Theoretical and Applied Genetics,2000,100(1):127-138.
[3]和丽岗. 橡胶树分子遗传图谱的构建及相关性状的初步定位[D]. 海口:华南热带农业大学,2007.
[4]冯素萍,李维国,于 飞,等. 巴西橡胶树SSR遗传图谱的构建[J]. 遗传,2010,32(8):857-863.
[5]王惠君. 橡胶树初级分子遗传图谱的构建[D]. 海口:华南热带农业大学,2007.
[6]Triwitayakorn K,Chatkulkawin P,Kanjanawattanawong S,et al. Transcriptome sequencing of Hevea brasiliensis for development of microsatellite markers and construction of a genetic linkage map[J]. DNA Research,2011,18(6):471-482.
[7]王惠君. 橡胶树AFLP银染体系建立前期的准备[J]. 北京农业,2012(6):175-176.
[8]Li G,Quiros C F. Sequence-related amplified ploymorphism (SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J]. Theor Appl Genet,2001,103:455-461.
[9]薛丹丹,郑轶琦,王志勇,等. 结缕草属植物SRAP-PCR体系的建立和优化[J]. 草业学报,2008,17(6):93-101.
[10]王惠君,和丽岗,夏志强,等. 橡胶树AFLP银染体系的建立和优化[J]. 生物技术通讯,2007,18(4):631-634.
[11]Hemmat M,Weeden N F,Manganaris A G,et al. Molecular marker linkage map for apple[J]. The Journal of Heredity,1994,85(1):4-11.
[12]Testolin R,Huang W G,Lain O,et al. A kiwifruit(Actinidia spp.) linkage map based on microsatellites and integrated with AFLP markers[J]. Theoretical and Applied Genetics,2001,103(1):30-36.
[13]Porceddu A,Albertini E,Barcaccia G,et al. Linkage mapping in apomictic and sexual Kentucky bluegrass(Poa pratensis L.) genotypes using a two way pseudo-testcross strategy based on AFLP and SAMPL markers[J]. Theoretical and Applied Genetics,2002,104(2/3):273-280.
[14]Foisset N,Delourme R,Barret P,et al. Molecular-mapping analysis in Brassica napus using isozyme,RAPD and RFLP markers on a doubled-haploid progeny[J]. Theoretical and Applied Genetics,93(7):1017-1025.
[15]Xu S J,Singh R J,Hymowitz T.Establishment of a cytogenetic map soybean: progress and prospective[J]. Soybean Genet Newslett,1997,24:121-122.
[16]Kinishita T. Report of the committee on gene mbolization,nomenclature and linkage group[J]. Rice Genet Newslett,1991,8:2-37.
[17]Lagercrantz U,Lydiate D J. RFLP mapping in Brassica nigra indicates differing recombination rates in male and female meioses[J]. Genome,1995,38(2):255-264.
[18]Zhao B,Deng Q M,Zhang Q J,et al. Analysis of segregation distortion of molecular markers in F2 population of rice[J]. Acta Genet Sin,2006,33(5):449-457.
[19]Tzeng T H,Lyngholm L K,Ford C F,et al. A restriction fragment length polymorphism map and electrophoretic karyotype of the fungal maize pathogen Cochliobolus heterostrophus[J]. Genetics,1992,130(1):81-96.
[20]尚 伟,周元昌.利用ILP标记构建水稻连锁图谱[J]. 三明农业科技,2007(3):11-16.
[21]Marra R E,Huang J C,Fung E,et al. A genetic linkage map of Cryptococcus neoformans variety neoformans serotype D (Filobasidiella neoformans)[J]. Genetics,2004,167(2):619-631.
