国外引进双孢菇菌种与国内栽培菌种的RAPD和酯酶同工酶指纹图谱分析
2015-08-20张欣倪王鸿磊丁强吕蔚邹积华崔从光俞守能
张欣倪 王鸿磊 丁强 吕蔚 邹积华 崔从光 俞守能
摘要:利用RAPD和酯酶同工酶指纹图谱对国内主栽的2个双孢菇菌株及从荷兰、美国引进的8个双孢菇菌株进行亲缘关系分析。结果表明,从47个RAPD引物中筛选了14个条带清晰重复性好的引物,共产生了88条清晰的扩增条带,其中多态性条带64条,多态性位点百分率为72.73%,10个菌株可分为4个类群;酯酶同工酶电泳共扩增出了清晰条带7条,其中多态性条带6条,多态性位点百分率为85.8%,10个菌株可分为3个类群。2种技术均显示,国内菌株与国外引进菌株之间亲缘关系较远。因此,引进国外优质双孢菇菌株对增加中国双孢菇遗传多样性具有重要作用。
关键词:双孢菇;酯酶同工酶;RAPD;亲缘关系
中图分类号: S646.032 文献标志码: A 文章编号:1002-1302(2015)07-0254-03
双孢菇(Agaricus bisporus)是中国广泛栽培的一种中低温性食用菌,近年来产量不断增加。但是,中国的双孢蘑菇品种之间遗传关系较近[1],且缺乏系统的归类整理,导致中国目前市场上菌种的同种品种不同名称,或者是不同品种同一名称的混杂现状,直接影响了中国双孢菇菌种的生产、种质资源的保护和优良菌种选育。采用合理有效技術对双孢蘑菇进行品种划分,区分其品种亲缘关系,鉴定双孢蘑菇的品系显得尤为重要。
RAPD技术是Williams研究小组提出的一种分子标记技术[2-3]。该技术通过人工合成的核酸单链(常为10个碱基)为引物,以试验对象的DNA为模版,进行PCR扩增,产生一系列不同分子量的基因片段,不同引物的凝胶电泳结果,可以作为品系的遗传特征进行记录,用于品种鉴定。RAPD技术设备简单,技术简便易行,目前,已广泛应用于不同物种的遗传多样性研究[4-9]。同工酶分子标记是从基因产物水平来研究生物的遗传变异,是一种重要的分子遗传标记技术[10],酶带的变化可作为鉴定物种,研究分类、进化、遗传与变异的重要指标。自1959年Markert等提出酯酶同工酶概念后,酯酶同工酶标记技术在许多食用菌研究中得到了广泛的重视和应用[11-14]。高分辨率的同工酶技术成为生化分类的主要方法之一[15]。
本研究利用RAPD和酯酶同工酶技术对中国的2个主栽双孢菇菌株及从荷兰、美国引进的8个优质双孢菇菌株进行遗传相似性分析,从分子水平上研究双孢菇菌株之间的亲缘关系和遗传差异,为双孢菇菌株的鉴定提供技术支持,同时为双孢菇种质资源的引进及引进菌株在双孢菇遗传育种方面的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种 (1)258、2796本实验室保藏;(2)H901、HRLM、F3F、HA15引自荷兰;(3)L901、5113、XXX、2200引自美国。
1.1.2 PCR试剂 RAPD引物由英潍捷基(上海)贸易有限公司合成,Taq DNA 聚合酶、dNTP、DNA marker、Gelstain等购自北京全式金生物技术有限公司。
1.1.3 仪器设备 JY300C电泳仪:北京君意东方电泳设备有限公司生产;蓝盾580可见光凝胶电泳透射仪:厦门致善生物科技有限公司生产;A200PCR仪:杭州朗基科学仪器有限公司生产;04S-3C全自动数码凝胶图像分析系统:北京君意东方电泳设备有限公司生产;3K30冷冻高速离心机:德国Sigma公司生产。
1.2 方法
1.2.1 RAPD分析 双孢菇菌株利用PDA液体培养基[16],24 ℃ 150 r/min 培养14 d,过滤收集菌丝体。菌丝体DNA提取采用CTAB法[17]。0.8%琼脂糖凝胶电泳检测DNA质量,紫外分光光度计检测 DNA浓度,稀释至10 ng/μL,于-20 ℃冰箱中保存备用。PCR反应体系为15 μL,含1×PCR缓冲液、DNA模板 20 ng,dNTPs 200 mmol/L,引物0.3 μmol/L,TaqDNA聚合酶 1 U。PCR反应条件为:94 ℃预变性7 min;94 ℃变性1 min,退火1 min(退火温度视引物而定),72 ℃延伸2 min,35个循环;72 ℃延伸7 min,4 ℃终止反应。PCR产物用1.5%琼脂糖凝胶电泳检测,电压4 V/cm,Gelstain染色,凝胶成像系统观察并照相。
1.2.2 酯酶同工酶分析 称取0.5 g菌丝体,置于预冷的灭菌研钵中,加1 mL 样品提取液,加少量灭菌石英砂,冰浴研磨,收集于1.5 mL离心管中。4 ℃ 10 000 r/min 离心5 min,将上清液、蔗糖溶液、溴酚蓝溶液按5 ∶1 ∶1的比例混合,即为电泳样品[18]。电泳分离胶浓度为7.5%,浓缩胶浓度为48%,电极缓冲液采用Tris-Gly系统,以1%溴酚蓝作指示剂。电泳初始电流10 mA,待样品进入分离胶后电流升至 20 mA,在0~4 ℃下电泳至溴酚蓝指示剂距胶底1 cm停止电泳。用1%醋酸-1-萘酯、2%醋酸-2-萘酯和固蓝RR盐4 ℃染色15~30 min,用蒸馏水冲洗数次后置于乙酸溶液中固定,凝胶成像系统拍照[19]。
1.2.3 数据处理 利用NTSYSpc 2.10对电泳条带进行分析,计算各双孢菇菌株间的Nei氏遗传相似性及遗传距离,以平均连锁法(UPGMA)进行聚类分析,得出聚类图谱[20]。
2 结果与分析
2.1 双孢菇菌株RAPD分析
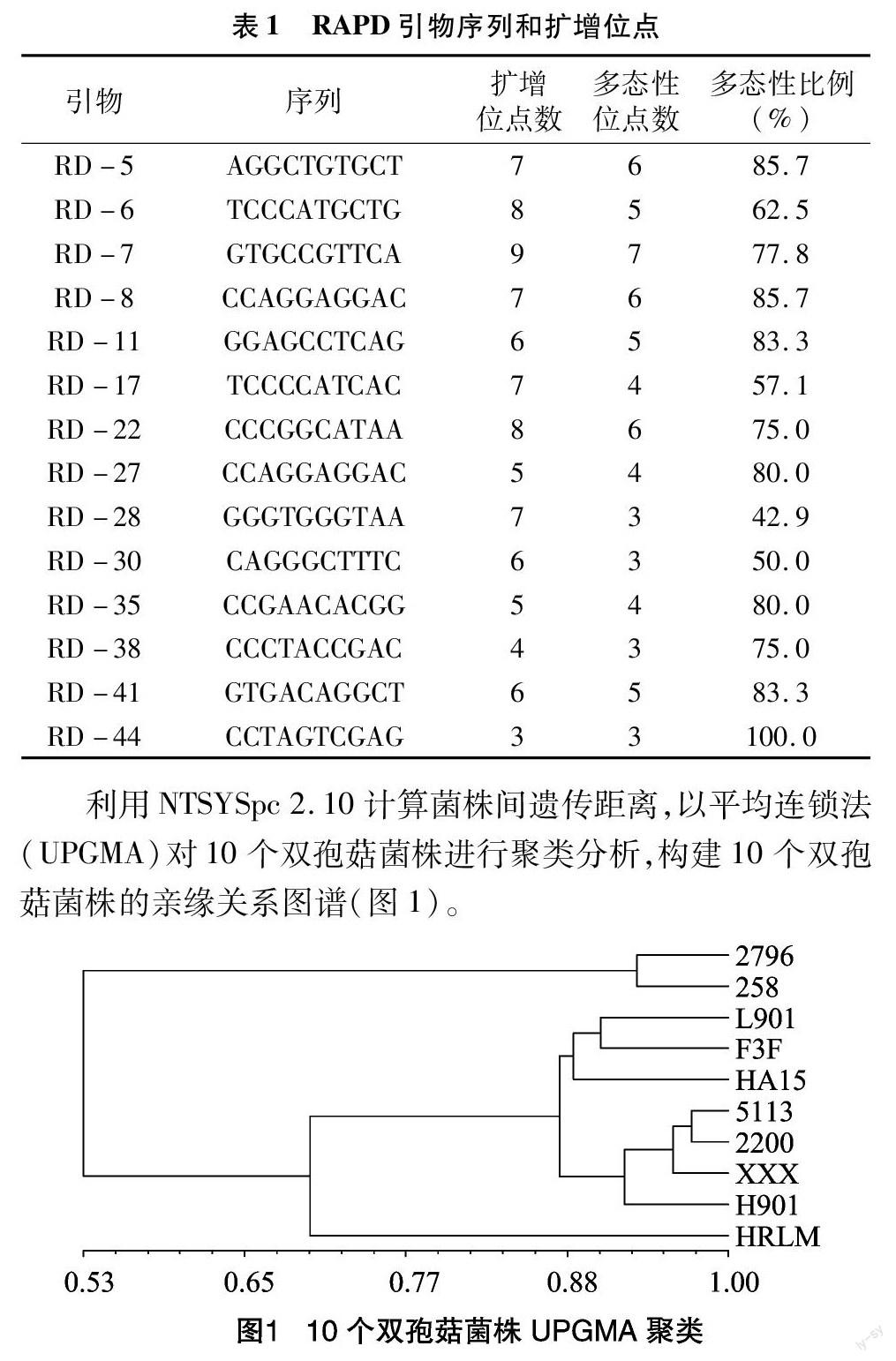
利用47条引物对10个双孢菇菌株进行了RAPD扩增,其中14条引物扩增出了清晰且具有多态性的条带,共产生了清晰的扩增条带88条,其中多态性条带64条,多态性位点百分率为72.73%,结果见表1。
利用NTSYSpc 2.10计算菌株间遗传距离,以平均连锁法(UPGMA)对10个双孢菇菌株进行聚类分析,构建10个双孢菇菌株的亲缘关系图谱(图1)。
从RAPD聚类图(图1)可见,8个引进菌株与2个国内主栽菌株的差异明显,遗传相似性只有0.53,在聚类图上明显分为2个分支。国内主栽的2个品种遗传差异较小,相似性达到0933,可归为1个类群。国外引进的8个菌株可分为3个类群,其中HRLM菌株与其他7个菌株差异较大,单独归为1个类群。引自美国的L901和引自荷兰的F3F、HA15親缘关系较近,归为1个类群,荷兰菌株H901与美国菌株5113、2200、XXX归为1个类群,这2个类群亲缘关系较近,遗传相似性接近0.88。
2.2 酯酶同工酶聚类分析
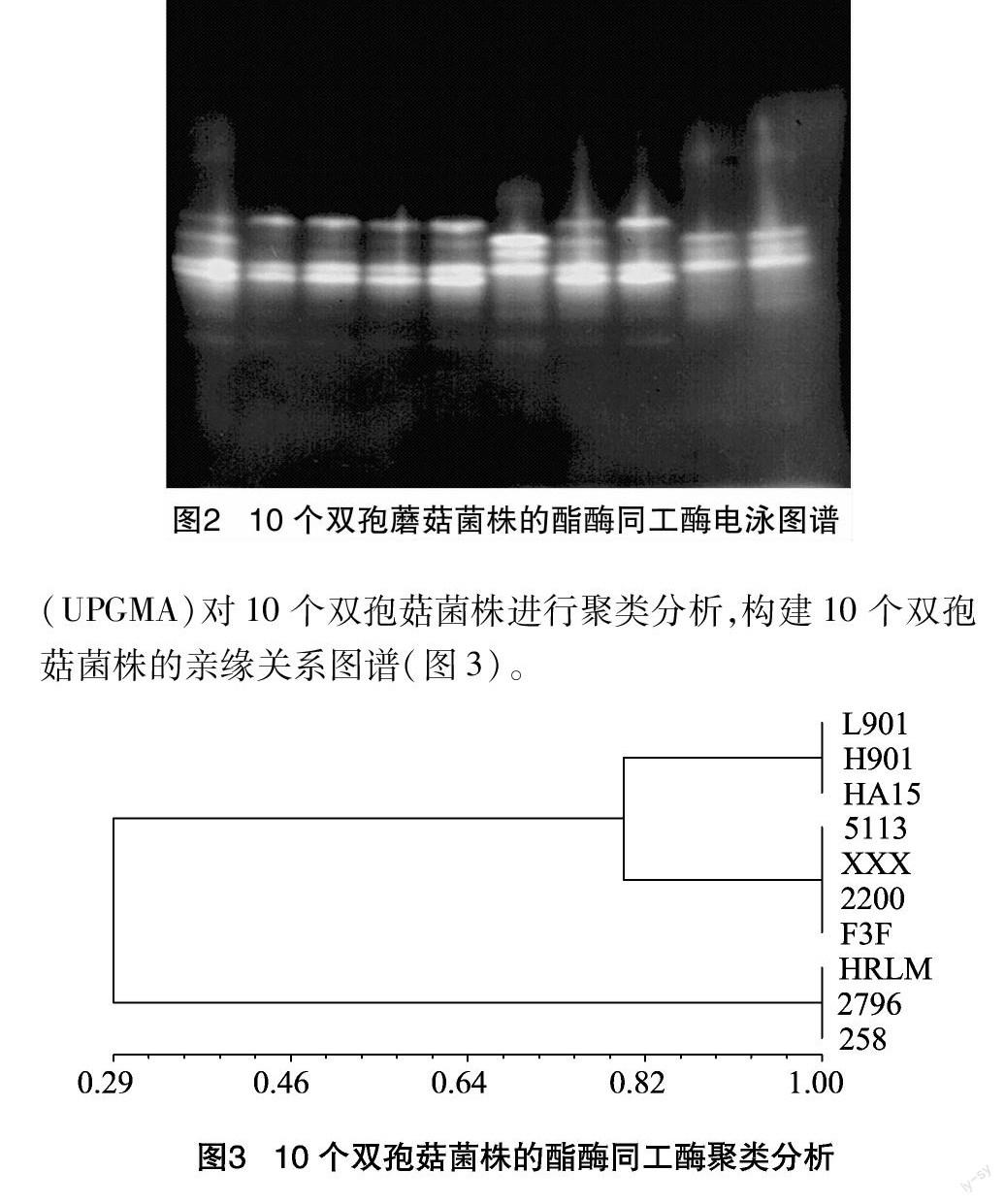
10个双孢菇菌株酯酶同工酶图谱见图2,共扩增出了清晰条带7条,其中多态性条带6条,多态性位点百分率为85.8%。
利用NTSYSpc 2.10计算菌株间遗传距离,以平均连锁法
(UPGMA)对10个双孢菇菌株进行聚类分析,构建10个双孢菇菌株的亲缘关系图谱(图3)。
10个不同品种双孢蘑菇的酯酶同工酶电泳图谱带在位置、宽窄、浓淡以及数量等方面都体现出了一定的差异性。从图谱上看,10个双孢菇菌种分为3群,中国品种2796、258、荷兰品种HRLM谱带相同,荷兰菌种H901、HA15、美国菌种L901谱带相同,美国菌种5113、XXX、2200和荷兰菌种F3F谱带相同。中国品种与HRLM亲缘关系较近,而其他引进品种间亲缘关系较远。
3 讨论
中国是双孢菇生产大国,但不是双孢菇生产强国,菌种是制约中国双孢菇产业发展最重要的因素之一。我国双孢菇菌株亲缘关系过于接近,影响我国双孢菇育种等工作的顺利开展。本研究结果表明,国外优质双孢菇菌株与中国主栽菌株之间亲缘关系较远,为我国双孢菇产业发展提供了一条新的思路。通过引进国外优质菌株,与国内菌株进行杂交育种,对提高中国双孢菇遗传多样性、双孢菇产量和抗病性等方面具有重要的作用。
同时,国外菌株在遗传相似性方面也相对比较接近,在引种时要对引进菌株进行亲缘关系检测,避免菌株的重复引进。RAPD和酯酶同工酶电泳均可以反映菌株间的亲缘关系[21],而RAPD标记检测的多态性要远远高于酯酶同工酶标记[22],同时,当菌株亲缘关系接近时酯酶同工酶酶谱与RAPD谱带存在差异性。在实际应用过程中,应将二者有机结合起来,以获得更加可靠的试验结果。
参考文献:
[1]王 波,甘炳成,贾定洪,等. 蘑菇属17个菌株的酯酶同工酶分析[J]. 西南农业学报,2007,20(6):1307-1309.
[2]Williams J G,Kubelik A R,Livak K J,et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J]. Nucleic Acids Research,1990,18(22):6531-6535.
[3]Welsh J,Mcclelland M. Fingerprinting genomes using PCR with arbitrary primers[J]. Nucleic Acids Research,1990,18(24):7213-7218.
[4]宋 健,曹伟平,王金耀,等. 球孢白僵菌不同菌株酯酶同工酶酶谱与RAPD多态性的研究[J]. 中国农学通报,2013,29(18):137-141.
[5]黄 浩,许国权,周世力. 几种中国栽培灵芝品种的RAPD及rDNA分子标记鉴定[J]. 江汉大学学报:自然科学版,2013,41(2):70-74.
[6]叶长文,谭海芹,吴应森,等. 香菇135和9015品种遗传多样性的RAPD分子标记研究[J]. 浙江大学学报:理学版,2013,40(2):230-234.
[7]杜 民,尹绍武,刘艳红,等. 4种裸胸鳝的分子遗传多样性和亲缘关系的RAPD分析[J]. 海洋通报,2013,32(3):321-327.
[8]Castrillo L A,Vandenberg J D,Wraight S P. Strain-specific detection of introduced Beauveria bassiana in agricultural fields byuse of equence-characterized amplified region markers[J]. Journal of Invertebrate Pathology,2003,82(2):75-83.
[9]陈美元,廖剑华,李洪荣,等. 双孢蘑菇栽培菌株遗传多样性的DNA指纹分析[J]. 中国农学通报,2009,25(4):149-156.
[10]郑素月,张海花. 同工酶技术及其在食用菌种质资源研究中的应用与进展[J]. 邯郸农业高等专科学校学报,2004,21(3):16-18.
[11]Royse D J,May B. Use of isozyme variation to identify genotypic classes of Agaricus brunnescens[J]. Mycologia,1982,74(1):93-102.
[12]Royse D J,May B. Genetic relatedness and its application in selective breeding of Agaricus brunnescens[J]. Mycologia,1982,74(4):569-575.
[13]辜运富,张小平,陈 强,等. 双孢蘑菇菌丝体酯酶同工酶及可溶性蛋白的电泳分析[J]. 四川农业大学学报,2003,21(3):217-220.
[14]李 红,苏君伟,张 敏,等. 采用同工酶分析技术鉴定11个平菇菌株亲缘关系[J]. 辽宁农业科学,2008(3):27-29.
[15]王孝敏,吴英杰,张爱莲. 同工酶分析技术鉴定猴头菌种[J]. 食用菌,1992,14(5):6-7.
[16]周德庆. 微生物学实验教程[M]. 北京:高等教育出版社,2006:372.
[17]Lee S B,Taylor J W. Isolation of DNA from fungal mycelia and single spores[M]//Innis M A,Gelfand D H,Sninsky J J,et al. PCR protocols:A guide to method and applications. New York:Academic Press,1990:282-287.
[18]中华人民共和国农业部. 食用菌菌种真实性鉴定——酯酶同工酶电泳法[M]. 北京:中国农业出版社,2010:1-6.
[19]王 波,甘炳成,彭卫红,等. 双孢蘑菇杂交菌株的酯酶同工酶分析[J]. 吉林农业大学学报,2008,30(2):142-145.
[20]Nei M,Li W H. Mathematical model for studying genetic variations in terms of restriction endonucleases[J]. Proceedings of the National Academy of Sciences of the United States of America,1979,76(10):5269-5273.
[21]王俊玲,李 明,田景花,等. 6个杏鲍菇菌株及其杂交子代的酯酶同工酶分析[J]. 河北农业大学学报,2004,27(3):29-32.
[22]赵 勇,贺冬梅,温亚丽,等. 酯酶同工酶及RAPD技术在香菇杂种优势研究中的应用[J]. 菌物系统,2003,22(4):549-556.
