不同环境因素对昆明本地灰葡萄孢、黄曲霉菌株生长的影响
2015-08-20张悦李丹陈子牛黄晓雯
张悦 李丹 陈子牛 黄晓雯
摘要:对昆明市宜良县玫瑰发病植株上分离获得的1个灰葡萄孢菌株和1个昆明本地土壤中分离的黄曲霉菌株的生物学特性进行了分析。结果发现,昆明花卉致病灰葡萄孢菌株在4~25 ℃条件下均可生长,在25 ℃下生长速度最快,4 ℃时相对较慢,而在37 ℃时生长几乎停止;黄曲霉在4 、37 ℃时生长均受到明显抑制,只在25 ℃时才能正常生长,表明黄曲霉菌株对温度要更加敏感;pH值对于灰葡萄孢菌株的生长影响相对较小,灰葡萄孢在偏酸环境中生长较快;pH值对于黄曲霉菌株的生长影响较大,黄曲霉在中性及偏碱环境中生长明显较快;光照对灰葡萄孢菌株生长的影响大于黄曲霉菌株,这可能和黄曲霉腐生于土壤,对光照刺激不敏感有关;2种菌株在不同培养基上的生长情况表明,两者都可以利用葡萄糖、蔗糖为碳源生长,碳源对灰葡萄孢菌株生长几乎没有影响,而黄曲霉利用葡萄糖的能力要强于蔗糖,因此高葡萄糖环境可能更易于黄曲霉生长。
关键词:灰葡萄孢;黄曲霉;温度;pH值;光照;培养基
中图分类号:S432.4+4 文献标志码: A 文章编号:1002-1302(2015)07-0118-03
灰葡萄孢是灰霉病的病原菌,在农业生产上会造成严重的经济损失,在气候凉爽潮湿的地区为害尤为严重[1]。它是一类侵染性很强的以腐生为主的真菌,可以侵染200多种植物,其中包括云南省经常种植的花卉、葡萄、番茄、草莓、蔬菜等多种经济作物。除了能引起田间损失,灰葡萄孢在果实的储存和运输中也会造成严重危害,使果实的储存期变短、品质变差,带来经济损失[2-4]。
曲霉属真菌是自然界分布最普遍的腐生菌之一,能使农产品变质、霉坏,造成重大的经济损失[5]。据报道土壤中的曲霉资源较为丰富[6],刘艳梅等曾从甘肃省土壤中分离得到了7个种和3个变种的曲霉菌种[7]。作为贮藏物污染菌,黄曲霉是曲霉属中非常常见的一个种类,其存在于土壤和各类动植物中。此前,有研究发现不同温度对番茄灰葡萄孢孢子萌发的影响很大,其孢子的萌发适温在15~ 25 ℃,最适温度为20 ℃,30 ℃以上病害发展受到抑制。低温有利于病菌产孢,产孢最适温度为15 ℃[8]。此外,还有研究发现番茄灰葡萄孢喜偏酸性的环境,其在pH值3~11的范围内都能生长,pH值为6时菌丝生长最快、产孢量最高[9-10]。黄曲霉是温暖地区常见的占优势的霉菌,菌落生长较快,培养10~14 d,其直径可达6~7 cm[11]。
本研究以昆明本地分离得到的玫瑰致病灰葡萄孢菌株和土壤黄曲霉菌株为研究材料,分析其在不同温度、pH值、光照及培养基等环境条件下生长情况,明确昆明本地致病灰葡萄孢、黄曲霉菌株的生物学特性,为了解昆明本地灰葡萄孢、黄曲霉菌株环境适应能力以及制定合理防治策略提供一定的理论参考。
1 材料与方法
1.1 灰葡萄孢、黄曲霉菌株的分离、纯化与鉴定
供试灰葡萄孢菌株采集自昆明市宜良县发病玫瑰,黄曲霉菌株取样分离于昆明本地土壤。试验用灰葡萄孢菌株采用组织分离法对病原菌分离,黄曲霉菌株则采用常规土壤微生物分离方法分离。此后,得到的各菌株采用已报道方法[12]进一步进行单孢分离,最终按《真菌鉴定手册》进行鉴定。
1.2 培养基的制备
本试验共采用了3种培养基,培养基的成分如下。PDA培养基:去皮马铃薯40 g、葡萄糖4 g、琼脂4 g、水200 mL;清水琼脂培养基:琼脂4 g、水200 mL;PSA培养基:去皮马铃薯40 g、蔗糖4 g、琼脂4 g、水200 mL。
1.3 温度对菌丝生长的影响
用灭菌打孔器(直径5 mm)取灰葡萄孢菌株、黄曲霉菌株菌落边缘的菌块,移植到PDA平板培养基中央,分别置于各处理温度下的恒温箱中培养,每24 h测量菌落直径,每个处理重复3次,取平均值。
1.4 pH值对菌丝生长的影响
试验设4个pH值梯度:5、6、7、8,将熔化好的PDA培养基用1 mol/L盐酸或1 mol/L氢氧化钠调节到所需pH值后(以精密试纸测定),倒平板备用。将灰葡萄孢菌株、黄曲霉菌株分别接种到PDA平板上活化后,用5 mm打孔器在菌落边缘打孔,挑取菌片置于不同pH值的平板中央,在25 ℃下培养,每24 h测量菌落直径,每个处理3次重复,取平均值。
1.5 光照条件对菌丝生长的影响
试验设计2个处理:全光照、全黑暗。将灰霉菌株、黄曲霉菌株接种到PDA平板上活化后,用5 mm打孔器在菌落边缘打孔,挑取菌片置于PDA平板培养基中央,在试验设定的条件下于25 ℃恒温培养,每24 h测定菌落的直径,每个处理3次重复,取平均值。
1.6 不同培养基对菌丝生长的影响
培养基设3种处理:PDA培养基、清水琼脂培养基、PSA培养基。将灰葡萄孢菌株、黄曲霉菌株接种至PDA平板上活化后,用5 mm打孔器在菌落边缘打孔,挑取菌片置于平板中央,在设定的25 ℃下恒温培养,每24 h测定菌落的直径,每个处理3次重复,取平均值。
2 结果与分析
2.1 灰葡萄孢、黄曲霉菌株菌落的特征观察
通过试验观察发现,灰葡萄孢菌株在培养基中生长时,菌丝初期为白色或浅灰色,呈现出致密的绒毛状且紧挨培养基生长。菌丝产孢后,培养皿边缘的菌丝颜色开始逐渐由白色向灰色或灰褐色转变,菌丝生长繁茂但较短。
黄曲霉分离菌株培养初期为灰白色、扁平,之后出现放射状沟纹,菌落颜色转为黄至暗绿色,菌落背面无色至淡红色。菌株顶囊大、球状;小梗1~2层,布满整个顶囊表面。菌丝为有隔菌丝,分生孢子球形或近似梨形,表面粗糙。
2.2 灰葡萄孢、黄曲霉菌株生物学特性的比较研究
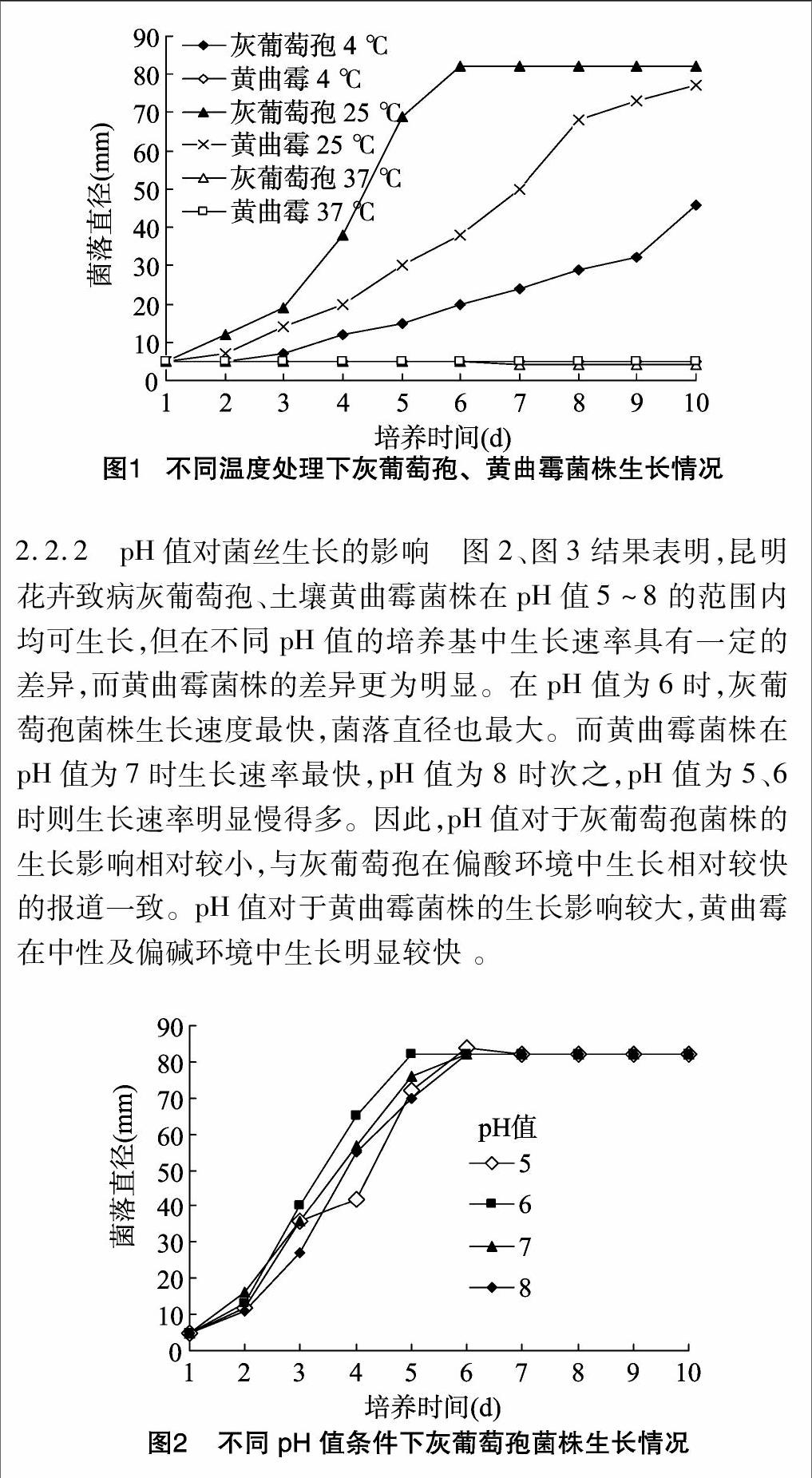
2.2.1 温度对菌丝生长的影响 在不同温度处理下昆明地区分离的致病灰葡萄孢、土壤黄曲霉菌株的菌落生长速率有明显的不同。2种真菌在温度为4~25 ℃的区间内都能生长。灰葡萄孢在37 ℃时生长受到较大的抑制;而黄曲霉在4、37 ℃时生长受到抑制(图1)。
通过试验分析表明,灰葡萄孢菌株菌丝虽然在4~37 ℃的温度区间都可以生长,但是生长环境的温度过高或过低都会对菌丝的生长产生较大的影响,而最佳生长温度为25 ℃。温度对黄曲霉菌株生长的影响明显较灰葡萄孢大,过低或过高的温度都会抑制黄曲霉生长。
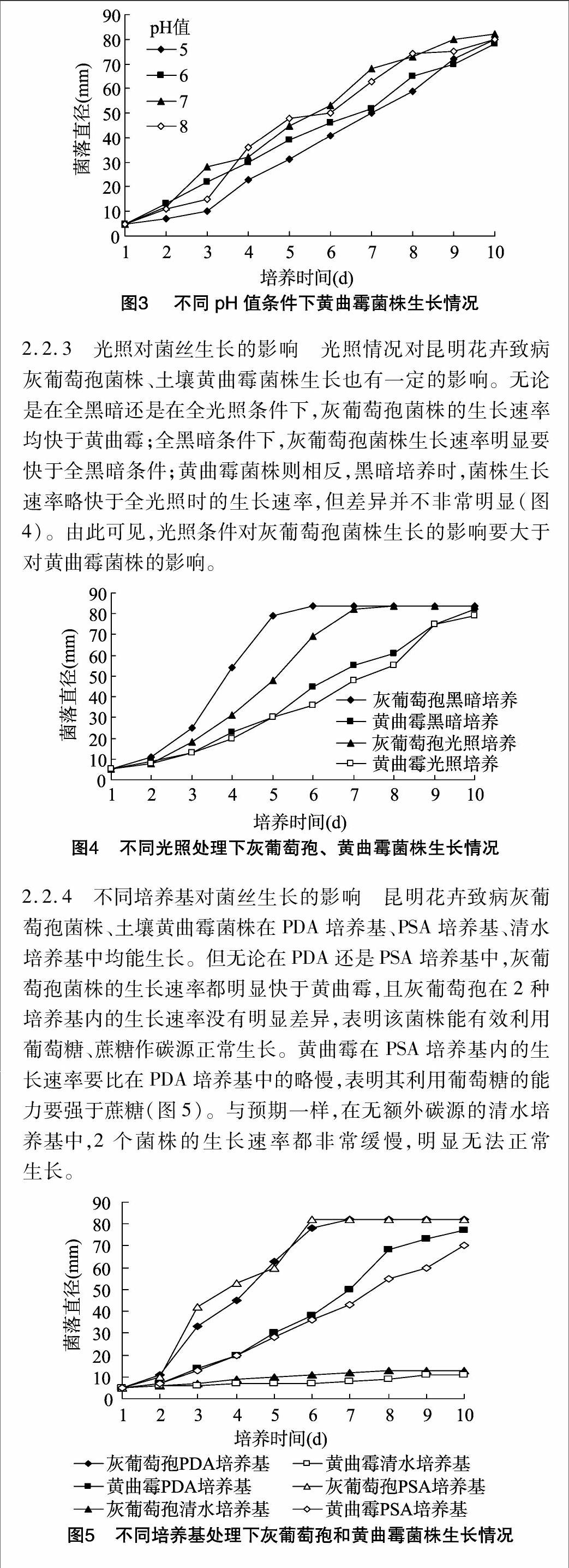
2.2.2 pH值对菌丝生长的影响 图2、图3结果表明,昆明花卉致病灰葡萄孢、土壤黄曲霉菌株在pH值5~8的范围内均可生长,但在不同pH值的培养基中生长速率具有一定的差异,而黄曲霉菌株的差异更为明显。在pH值为6时,灰葡萄孢菌株生长速度最快,菌落直径也最大。而黄曲霉菌株在pH值为7时生长速率最快,pH值为8时次之,pH值为5、6时则生长速率明显慢得多。因此,pH值对于灰葡萄孢菌株的生长影响相对较小,与灰葡萄孢在偏酸环境中生长相对较快的报道一致。pH值对于黄曲霉菌株的生长影响较大,黄曲霉在中性及偏碱环境中生长明显较快 。
2.2.3 光照对菌丝生长的影响 光照情况对昆明花卉致病灰葡萄孢菌株、土壤黄曲霉菌株生长也有一定的影响。无论是在全黑暗还是在全光照条件下,灰葡萄孢菌株的生长速率均快于黄曲霉;全黑暗条件下,灰葡萄孢菌株生长速率明显要快于全黑暗条件;黄曲霉菌株则相反,黑暗培养时,菌株生长速率略快于全光照时的生长速率,但差异并不非常明显(图4)。由此可见,光照条件对灰葡萄孢菌株生长的影响要大于对黄曲霉菌株的影响。
2.2.4 不同培养基对菌丝生长的影响 昆明花卉致病灰葡萄孢菌株、土壤黄曲霉菌株在PDA培养基、PSA培养基、清水培养基中均能生长。但无论在PDA还是PSA培养基中,灰葡萄孢菌株的生长速率都明显快于黄曲霉,且灰葡萄孢在2种培养基内的生长速率没有明显差异,表明该菌株能有效利用葡萄糖、蔗糖作碳源正常生长。黄曲霉在PSA培养基内的生长速率要比在PDA培养基中的略慢,表明其利用葡萄糖的能力要强于蔗糖(图5)。与预期一样,在无额外碳源的清水培养基中,2个菌株的生长速率都非常缓慢,明显无法正常生长。
3 讨论
灰葡萄孢适应性较强,是蔷薇科花卉常见的一种致病真菌。黄曲霉是一种常见土壤腐生真菌,由于其分泌的毒素对人体有一定危害,在农业生产中受到了较高的关注。温度试验表明,昆明花卉致病灰葡萄孢菌株在4~37 ℃下均可生长,但在25 ℃下生长速度最快,4 ℃时相对较慢,在37 ℃时生长几乎停止;而黄曲霉在4 、37 ℃时生长均受到明显抑制,只在25 ℃时正常生长,表明黄曲霉菌株对温度要更加敏感。因此,阴冷的天气最有利于玫瑰致病灰葡萄孢菌株的生长。昆明市每年春夏雨季气温在25 ℃左右时,都是监测玫瑰灰霉病的关键时期;当气温高于30 ℃以上时,可相对减少对灰葡萄孢病害的监测。
此外,试验还发现,在pH值为5~8时,灰葡萄孢、黄曲霉菌株都可以生长,但pH值对于灰葡萄孢菌株的生长影响相对较小,灰葡萄孢在偏酸环境中生长相对较快。pH值对于黄曲霉菌株的生长影响较大,黄曲霉在中性及偏碱环境中生长明显较快,这表明2种真菌在适应微环境的酸碱度上还是有明显差异。另外,光照对灰葡萄孢菌株生长的影响要大于黄曲霉菌株,这可能和黄曲霉腐生于土壤,对光照刺激不敏感有关。培养基试验表明,2种真菌都可以利用葡萄糖、蔗糖为碳源生长,但2种碳源差异对灰葡萄孢菌株几乎没有影响,黄曲霉利用葡萄糖的能力要强于蔗糖,因此高葡萄糖环境可能更易于黄曲霉生长。
参考文献:
[1]Cotoras M,Silva E. Differences in the initial events of infection of Botrytis cinerea strains isolated from tomato and grape[J]. Mycologia,2006,97(2):485-492.
[2]纪明山,祁之秋,王英姿,等. 番茄灰霉病菌对嘧霉胺的抗药性[J]. 植物保护学报,2003,31(4):396-400.
[3]Williamson B,Tudzynski B,Tudzynski P,et al. Botrytis cinerea: the cause of grey mould disease[J]. Molecular Plant Pathology,2007,8(5): 561-580.
[4]Staats M,van Baarlen P,van Kan J A. Molecular phylogeny of the plant pathogenic genus Botrytis and the evolution of host specificity[J]. Molecular Biology and Evolution,2005,22(2):333-346.
[5]Horn W B. Ecology and population biology of aflatoxigenic fungi in soil[J]. Toxin Reviews,2003,22(2/3): 351-379.
[6]李冬梅,王端礼,李若瑜,等. 我国北方地区裸胞壳属的种[J]. 菌物系统,1998,17(2):130-136.
[7]刘艳梅,朱建兰. 甘肃省土壤曲霉属(Aspergillus Mich.ex Link:Fr.)的种[J]. 西北农业学报,2005,14(4):145-148,157.
[8]李宝聚,陈立芹,孟伟军,等. 温度调控对番茄灰霉病菌侵染的影响[J]. 植物保护,2004,30(2):75-80.
[9]马辉刚,李瑞明,胡水秀. 番茄灰霉病菌生物学特性研究[J]. 江西农业大学学报,1998,20(2):57-59.
[10]朱建兰. 番茄灰霉病菌的生物学特性研究[J]. 甘肃农业大学学报,1995,30(1):73-78.
[11]Angle J S,Dunn K A,Wagner G H,et al. Effect of cultural practices on the soil populations of Aspergillus flavus and Aspergillus parasiticus[J]. Soil Science Society of America Journal,1982,46: 301-304.
[12]杨婉琴. 一种简便的单孢分离法[J]. 林业科学研究,1993,6(2):234.
