紫外光谱定量测定木质纤维预水解液中溶解性木素和糠醛含量
2015-08-20赵旭红石海强张健李娜牛梅红平清伟
赵旭红,石海强,2,3,张健,李娜,牛梅红,平清伟
(1 大连工业大学轻工与化学工程学院,辽宁 大连 116034;2 华南理工大学制浆造纸工程国家重点实验室,广东 广州 510640;3 齐鲁工业大学制浆造纸科学与技术教育部重点实验室,山东 济南 250353)
引 言
在传统制浆之前增加预水解段提取木质纤维半纤维素,通过进一步转化可生产高附加值产品,如木糖醇、燃料乙醇等[1-3],预水解后物料可分离制备木素并获得纸浆。该技术路线复合生物质精炼发展理念,具有技术基础和成本优势。研究发现预水解分离半纤维素过程中,部分木质素也发生降解转化成低分子酚类物质进入到水解液中,这部分物质在半纤维素水解液的生物转化过程中对微生物的发酵行为有很强的活性抑制作用[4-6]。而且这部分木素酚类物质分子量小,溶解性强,去除困难[7]。准确快速地定量测定预水解液中的溶解性木素酚类物质含量,是预水解液的脱毒处理和降低木素降解溶出新技术研发过程中亟待解决的一个问题。
木质纤维原料和纸浆中木素定量通常采用克拉森法和酸溶木素测定法。目前水溶解性木素一般借鉴酸溶木素方法,采用紫外分光光度计测定[8-9]。与原料木素分析法不同,预水解过程是在高温热水体系中进行,预水解液中除了溶解性木素酚类物质外,还含有源于半纤维素和木素的降解产物,如糠醛、5-羟甲基糠醛(5-HMF)、甲酸、乙酸和乙酰丙酸等物质[10]。研究证实,由戊糖和己糖单元脱水形成的糠醛和羟甲基糠醛(HMF)物质,在280 nm附近有紫外特征吸收[11],柴欣生等[12]采用三波长紫外光谱技术对桉木热水提取液中糠醛和羟甲基糠醛进行了测定,证明方法的可行性。前期研究还发现,甲酸和乙酸等物质在205 nm 处有显著吸收,从而干扰溶解性木素酚类物质的定量测定。本研究首先对阔叶材相思木和一年生芦苇在不同预水解条件下的水解液进行190~600 nm 范围内的紫外光谱扫描,研究其光谱特征和吸收峰位置;然后对水解液中可能影响木质素测定的物质进行了紫外光谱扫描;最后通过硼氢化钠还原消除糠醛类物质的干扰,对水解液中溶解性木素进行了测定,并与传统酸溶木素测定结果进行比较。同时依据该方法原理对预水解液中的糠醛类物质也进行了定量分析,并与标准物测定结果进行对照。
1 实验材料与方法
1.1 实验原料
实验中所使用的相思木由亚太森博纸业提供(产地越南),芦苇由盘锦振兴纸业提供(产地为辽宁盘锦),贮存期半年左右。
1.2 主要试剂与仪器
试剂:糠醛(furfural)(standard for GC, ≥99.5%,上海晶纯生化科技股份有限公司),硼氢化钠(≥96.0%,国药集团化学试剂有限公司),甲酸(GR,天津市光复精细化工研究所),冰乙酸(GR,天津市光复精细化工研究所),硫酸(AR,沈阳新兴试剂厂),氢氧化钠(AR,天津市科密欧化学试剂有限公司)。
仪器:紫外光谱仪(Cary300,VARIAN),1cm石英比色皿,真空旋转蒸发仪(RV10,IKA),智能油浴与高压反应釜(ZKYY-10L),低温循环冷却装置(DLSB-5/25),冷冻干燥器(7740070,LABCONCO)。
1.3 实验方法
1.3.1 预水解液的制备 相思木片和芦苇片按固液比1:4 和1:7 在高压反应釜中进行预水解,反应条件为:160、170℃,保温20、60 min。水解结束后立即取出反应罐并冷却,分离固液两相,将半料浆用水冲洗至不呈酸性为止,自然风干后测定预水解后半料浆的得率及木素含量。收集水解液并用定量滤纸过滤,密闭置于冰箱贮存备用。
1.3.2 预水解液与标准物的紫外光谱扫描 参照Tappi205 酸溶木素测定方法,用3%H2SO4将水解液稀释适当倍数,本实验为250 倍,并以3%H2SO4为参比液,在19~600 nm 范围进行紫外光谱扫描。将色谱级甲酸、冰乙酸、糠醛用3%H2SO4稀释适当倍数,分别配制成0.61g·L-1、1.049 g·L-1和5.80 mg·L-1的溶液,以3%H2SO4为参比液,在190~600 nm 范围进行紫外光谱扫描。
1.3.3 硼氢化钠还原及还原后水解液的紫外光谱分析 取500 μl 水解液到10 ml 的容量瓶中,用0.1 mol·L-1NaOH 溶液中和。然后取400 μl 中和液转移到25 ml 容量瓶中,加入10 g·L-1的硼氢化钠溶液100 μl,室温下反应2 min。反应结束后,用0.1 mol·L-1NaOH 溶液稀释至25 ml 定容。使用0.1 mol·L-1NaOH 溶液作为参比溶液进行紫外光谱扫描。同时将未处理水解液使用0.1 mol·L-1NaOH溶液稀释相同倍数,进行紫外光谱扫描。
1.3.4 溶解性木素的提取及工作曲线的制定 溶解性木素的提取:将170℃、60 min 条件下的预水解液真空浓缩后进行提取。具体方法参考文献[13]。工作曲线制定:精确称取上述提取木素0.0100 g,用0.1 mol·L-1NaOH 溶解定容于10 ml 容量瓶中,即1.0 g·L-1的标准液。采用逐级稀释的方法配制浓度为2、10、20、25、40 mg·L-1的木素溶液,采用光度法测定280 nm 处吸光度值,以浓度c(mg·L-1)为横坐标,吸光度值A 为纵坐标,作标准工作曲线。
1.3.5 醛类标准曲线的制备[14]移取色谱级糠醛(ρ=1.16 g·ml-1)125 μl 至100 ml 容量瓶,用0.1 mol·L-1NaOH 稀释定容,即1.45 g·L-1的标准溶液。采用逐级稀释方法配制浓度为5.800、2.900、1.4500、1.1600、0.7250、0.5800、0.3625 mg·L-1的糠醛溶液,用紫外分光光度计分别记录280 nm处吸光度值,以浓度c(mg·L-1)为横坐标,吸光度值A 为纵坐标,作标准曲线。
2 结果与讨论
2.1 预水解液的紫外光谱分析
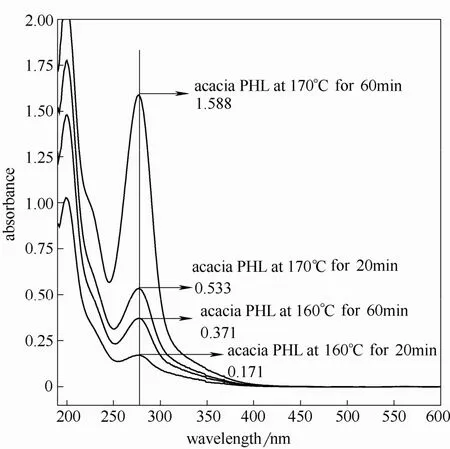
图1 不同条件下相思木预水解液的紫外光谱图Fig.1 UV spectra of acacia PHL at different conditions

图2 不同条件下芦苇预水解液的紫外光谱图Fig.2 UV spectra of reed PHL at different conditions
不同条件下预水解液的紫外光谱扫描图如图1、图2 所示。由图可见,预水解液在205 nm 和280 nm 附近出现明显特征吸收,这两个位置是木素的典型吸收,是目前进行木素定量测定的主要依据。随着预水解温度提高和时间的延长,同一种原料的水解液吸光度呈增加趋势,这可能是由于预水解液 中木素含量的增加,也可能是由于产生的干扰物质所致。水解液在280 nm 处的吸收强度随预水解强度不同而差别显著,说明在该特征吸收位置处,干扰性物质也可能具有显著吸收,且随着预水解强度增加这部分物质产生速度加快,对木素的定量测定造成较大影响。205 nm 处是目前酸溶木素测定方法所选用的波长,但与原料木素测定方法不同,预水解在高温水热条件下会产生较大量甲酸及乙酸等低分子有机酸[11],研究中发现这类物质在205 nm 处产生显著吸收,对木素的测定产生影响。
图3 为甲酸、乙酸和糠醛标准物质的紫外光谱图。由图可知甲酸、乙酸在205 nm 附近有明显的紫外吸收,而糠醛则在220 nm 和276 nm 处有特征吸收峰。甲酸、乙酸和糠醛是木质纤维高温预水解液中普遍存在的降解产物,因此,选用205 nm 或280 nm 测定预水解液溶解性木素含量时,都会由于干扰性物质的存在而影响准确性。必须选择适当的UV 波长并进行方法改进,以获得更加准确的可溶性木素定量测定。
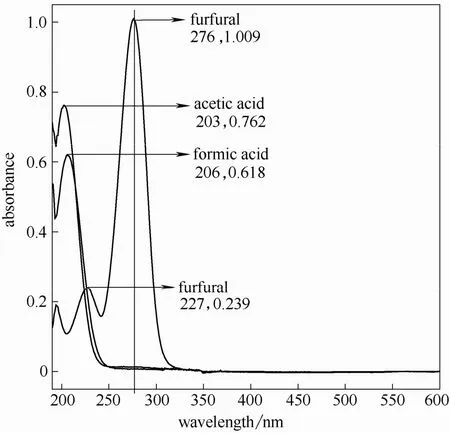
图3 甲酸、乙酸、糠醛的紫外光谱图Fig.3 UV spectra of formic acid,acetic acid and furfural
2.2 硼氢化钠还原前后水解液的紫外光谱分析
由文献[15]可知,糠醛类物质的干扰可以通过在碱性介质中(0.1 mol·L-1NaOH)硼氢化钠还原反应而消除其在紫外光谱中的特征吸收。由于NaOH 溶液在200 nm 附近有较明显的吸收,因而本研究选择280 nm 用以测定木素含量[16]。图4~图11 是不同条件的预水解液经硼氢化钠还原前后的紫外吸收光谱。
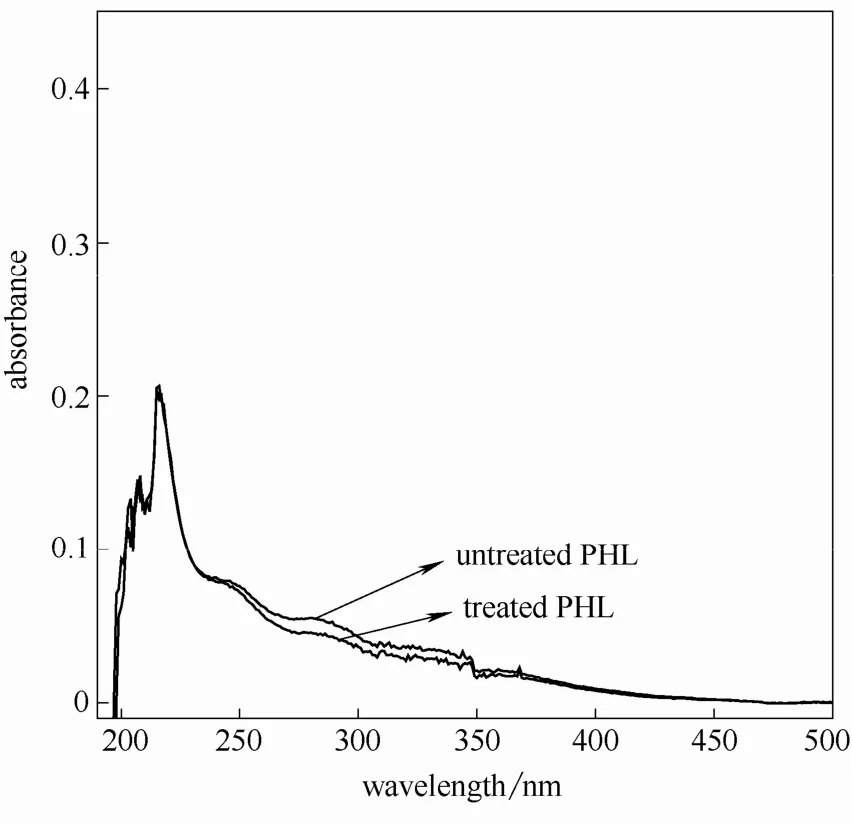
图4 相思木预水解液紫外光谱图(160℃,20 min)Fig.4 UV spectra of acacia PHL at 160℃ for 20 min
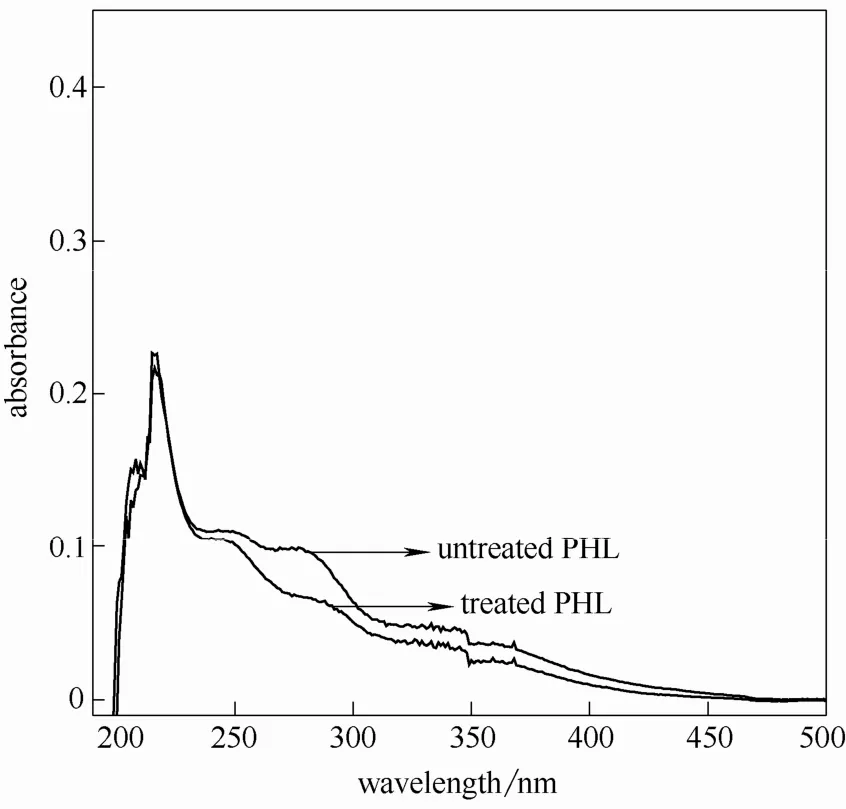
图5 相思木预水解液紫外光谱图(160℃,60 min)Fig.5 UV spectra of acacia PHL at 160℃ for 60 min

图6 相思木预水解液紫外光谱图(170℃,20 min)Fig.6 UV spectra of acacia PHL at 170℃ for 20 min
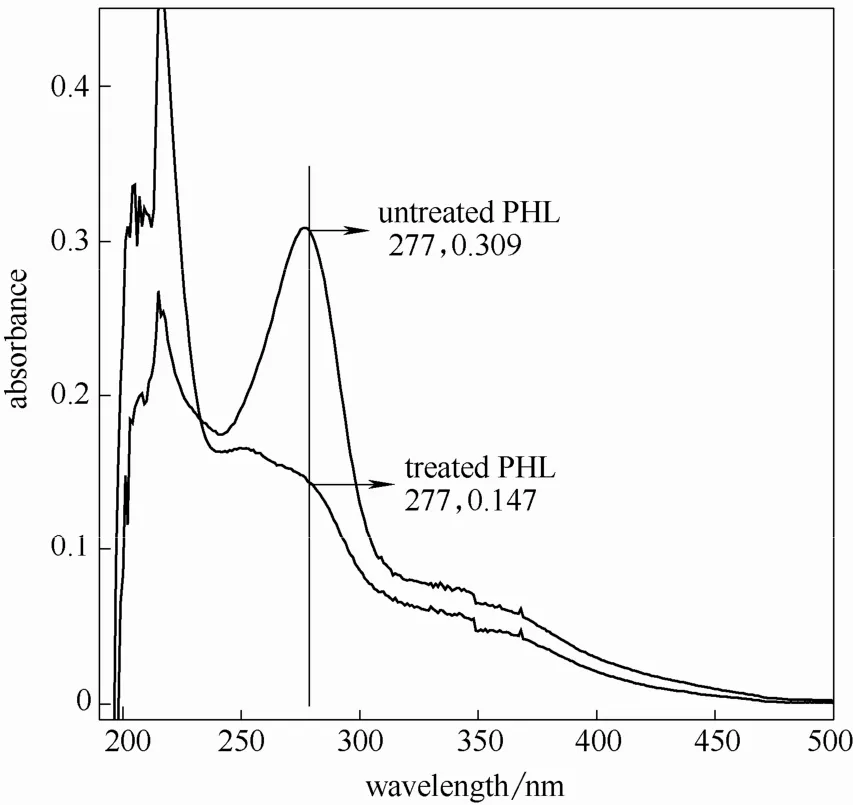
图7 相思木预水解液紫外光谱图(170℃,60 min)Fig.7 UV spectra of acacia PHL at 170℃ for 60 min
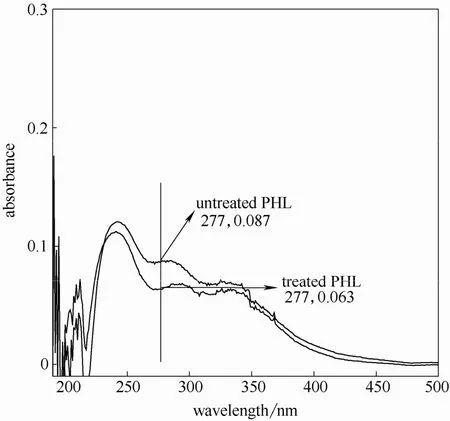
图8 芦苇预水解液紫外光谱图(160℃,20 min)Fig.8 UV spectra of reed PHL at 160℃ for 20 min

图9 芦苇预水解液紫外光谱图(160℃,60 min)Fig.9 UV spectra of reed PHL at 160℃ for 60 min
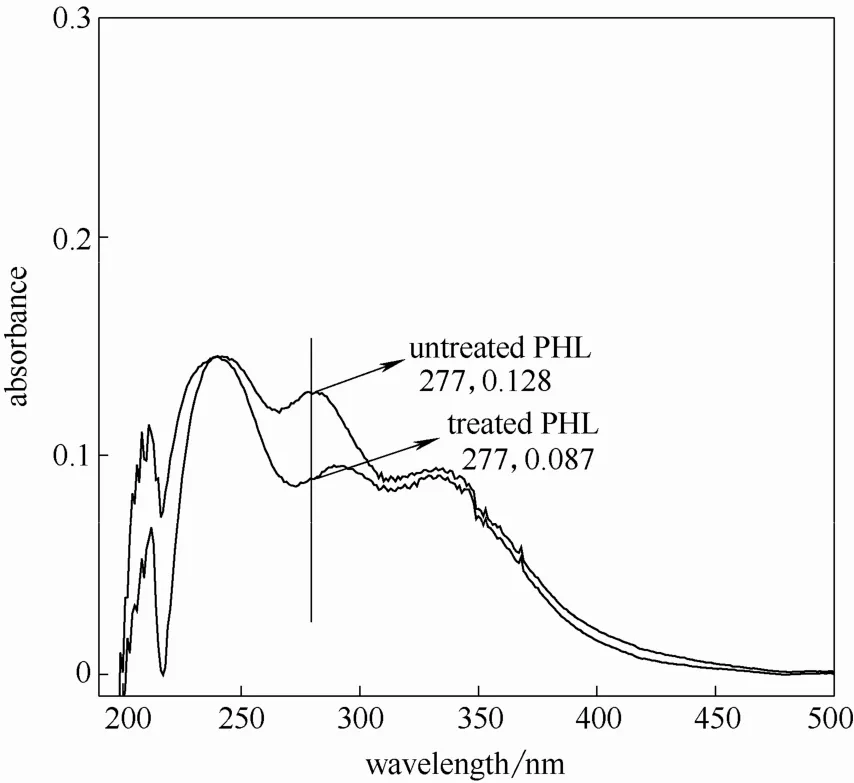
图10 芦苇预水解液紫外光谱图(170℃,20 min)Fig.10 UV spectra of reed PHL at 170℃ for 20 min
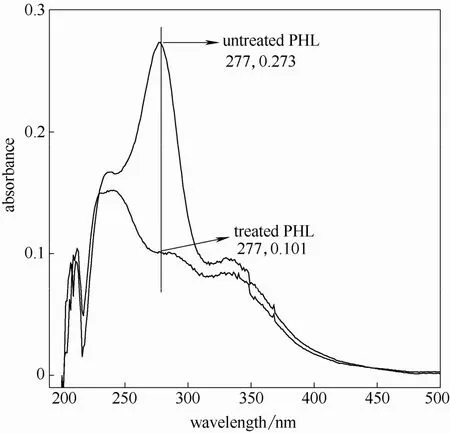
图11 芦苇预水解液紫外光谱图(170℃,60 min)Fig.11 UV spectra of reed PHL at 170℃ for 60 min
由图可知,水解液经硼氢化钠还原后的紫外吸收在280 nm 附近均有不同程度的下降,说明水解液中糠醛类物质对木素测定影响不同。因此,可以根据充分还原后水解液在280 nm 处的吸光度值计算出水解液中木素含量。另外,还可由还原前后的吸光度差值(ΔA)计算得出糠醛类物质的含量[17]。
由图还可以发现同一原料,随着预水解温度提高和时间的延长还原前后280 nm 处吸光度差值增大,说明预水解条件的加剧导致糠醛类物质产生速度加快。两种原料相比,芦苇在较弱的水解条件即有显著糠醛类物质生成,说明其反应速率较木材类原料快,这一点与其他研究结果相似[18-19]。
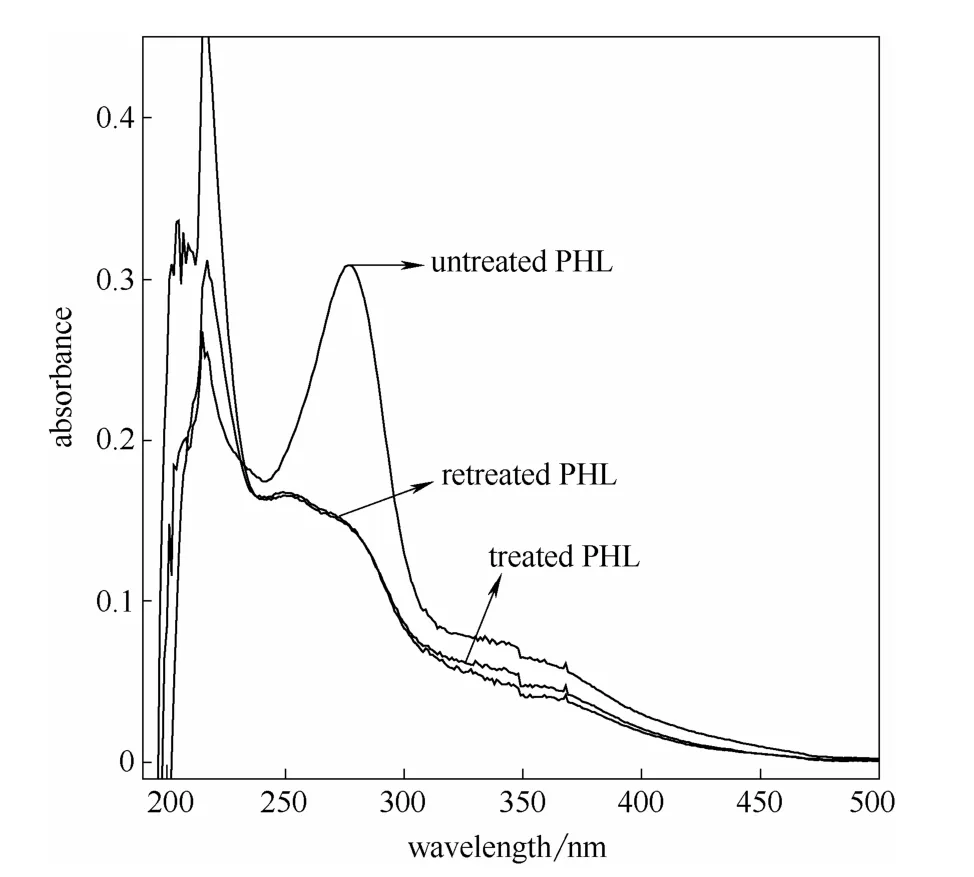
图12 再处理相思木预水解液紫外光谱图(170℃,60 min)Fig.12 UV spectra of retreated acacia PHL at 170℃ for 60 min
280 nm 处吸收值最大的170℃,60 min 预水解液,增加硼氢化钠用量后的紫外吸收光谱图如图12和图13 所示。加量还原后未见280 nm 处吸收值进一步降低,验证了实验中所采用的还原剂用量可将水解液中糠醛充分还原,在本实验范围内是适用的。
随机取芦苇170℃、60 min 下的水解液,向还原后的水解液重新加入不同浓度的糠醛后进行紫外光谱扫描,在280 nm 的吸光度值有不同程度的增大,如图14 所示,进一步表明糠醛对水解液中木素测定造成的干扰是显著的,通过还原处理去除糠醛影响后测定可溶性木素是可行的。

图13 再处理芦苇预水解液紫外光谱图(170℃,60 min)Fig.13 UV spectra of retreated reed PHL at 170℃ for 60 min
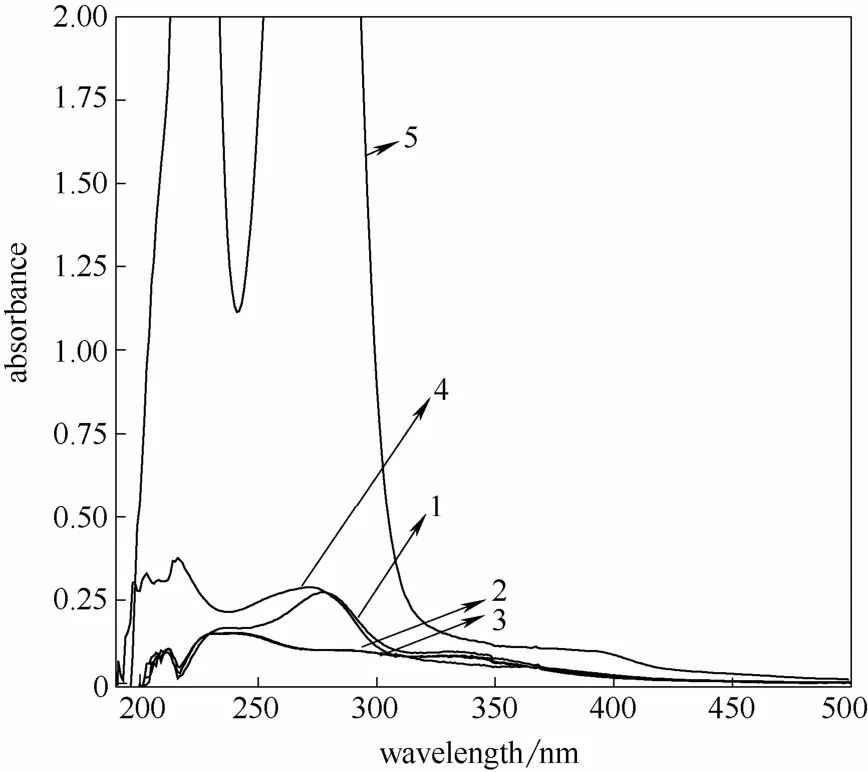
图14 芦苇预水解液不同处理后的紫外光谱图 (170℃,60 min)Fig.14 UV spectra of reed PHL at 170℃ for 60 min
2.3 溶解性木素的定量测定
图15 和图16 分别为相思木、芦苇预水解液提取木素不同浓度在280 nm 处吸光度工作曲线。由线性回归方程可知,提取木素NaOH 溶液浓度与吸光度之间线性相关性较高,分别达到0.9994 和0.9997,可用于外标法定量测定。
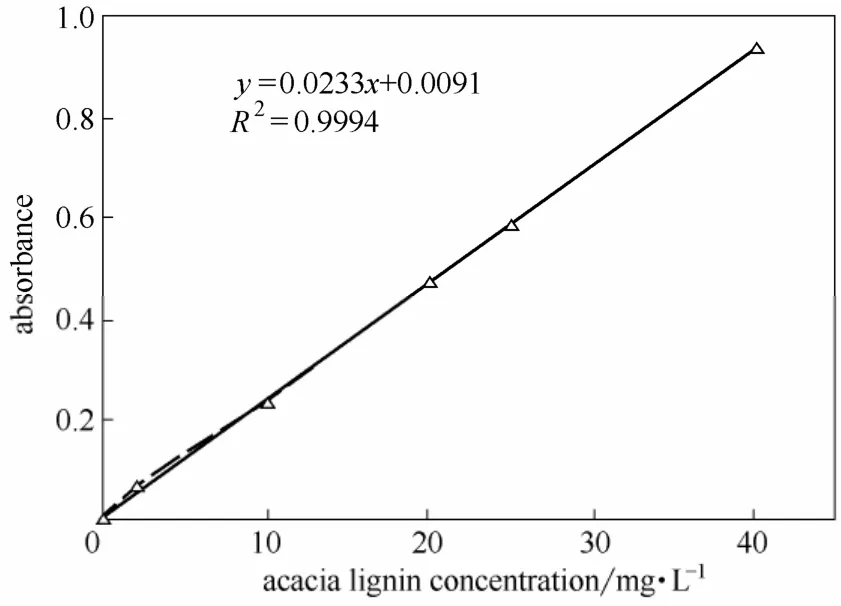
图15 相思木木素的标准曲线Fig.15 Relation between absorbance and acacia lignin concentration
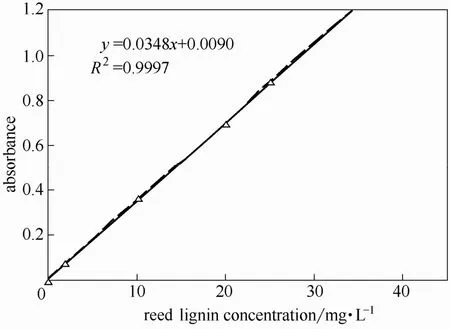
图16 芦苇木素的标准曲线Fig.16 Relation between absorbance and reed lignin concentration
根据水解液还原后280 nm 处的吸光度值和标准曲线计算各水解液中木素含量,并与传统酸溶木素测定结果进行了比较,结果见表1。通过对比可知,预水解液经硼氢化钠还原后测定280 nm 处吸光度值,通过工作曲线计算的木素浓度值低于相同预水解液采用酸溶木素的A205方法测定吸光度的计算值。说明预水解液中低分子酸性物质对A205酸溶木素测定法定量测定预水解液中溶解性木素含量存在干扰。
2.4 糠醛的定量测定
由图3 可知糠醛标准物的最大吸收波长为276 nm,与文献[12]报道的272 nm 非常接近,因此可以将醛类物质在该波长处的贡献从水解液吸光度中扣除,在实现对木素进行更精确的定量之外,还可以通过吸光度值的降低定量测定预水解液中糠醛的含量。不同浓度的糠醛与276 nm 处吸光度值的对应关系如图17 所示。
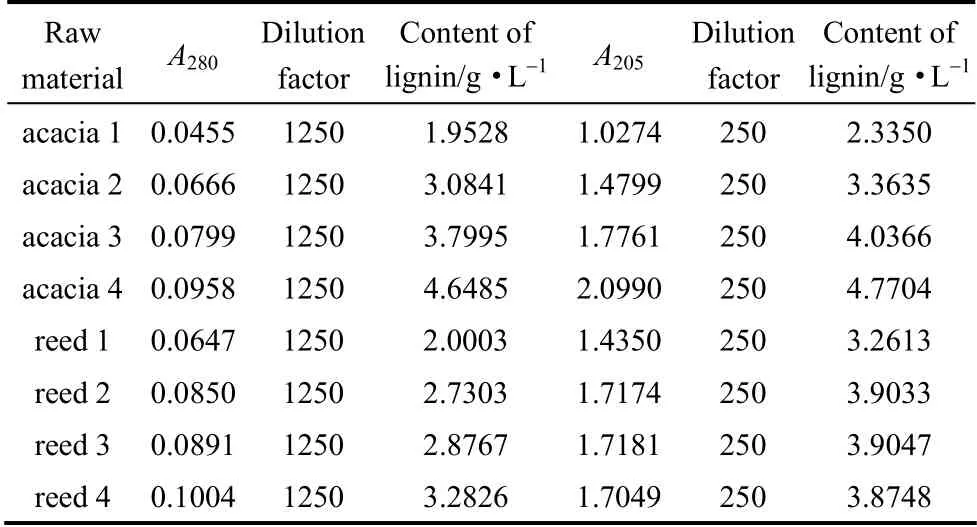
表1 Tappi 205 和NaBH4 还原法测定预水解液中 木素含量的比较Table 1 Comparison of lignin content in PHL measured with method of Tappi 205 and reduction of NaBH4
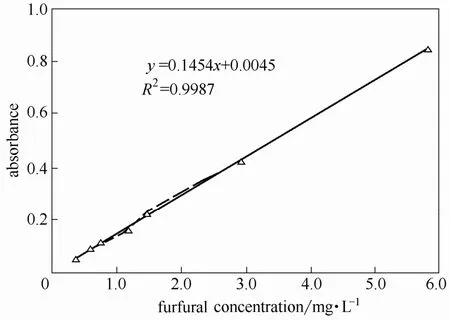
图17 糠醛标准曲线Fig.17 Relation between absorbance and furfural concentration
由图可见该工作曲线的线性相关系数较高,达到0.9987。由直线的斜率计算出糠醛在276 nm 处的摩尔吸光系数为13958 L·mol-1·cm-1,这与文献[20]所报道的14100 L·mol-1·cm-1接近。
在糠醛类物质和木素共存的溶液体系,由硼氢化钠还原前后紫外光谱特定波长处吸收的差异,根据朗伯-比尔定律,可以计算求得醛类化合物的含量,具体见式(1)和式(2)
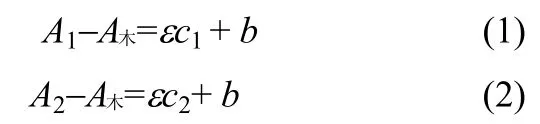
式中,A1、A2分别为还原前后276 nm 处的水解液吸光度值;A木为水解液中木素的吸光度值;ε为糠醛工作曲线的斜率0.1454;c1、c2分别为还原前后水解液中糠醛类物质的浓度,mg·L-1;b 为实验系统误差。式(1)、式(2)作差,得ΔA=ε(c1-c2)。由前文知该方法可以将水解液中糠醛充分还原,故c2=0。则

由式(3)及不同处理条件预水解液还原前后吸光度差值计算糠醛类物质含量如表2 所示。各原料预水解过程中,糠醛类物质在170℃条件下浓度明显高于160℃,且随着保温时间的延长,浓度增速加快。
为验证该方法的准确性,随机取芦苇170℃、60 min 下的水解液,通过加标的方法将一系列体积(1~3 ml)的糠醛稀释液分别加入到充分还原后的预水解液中测定276 nm 处吸光度值,分别读数5次取平均值,计算糠醛浓度和平均回收率,如表3所示。其中计算浓度为根据式(3)计算得到的,回收率为计算浓度与实测浓度的比值。3 种加标浓度下,平均回收率大于98%,说明方法准确度较高,可用于预水解液中糠醛类物质的测定要求。
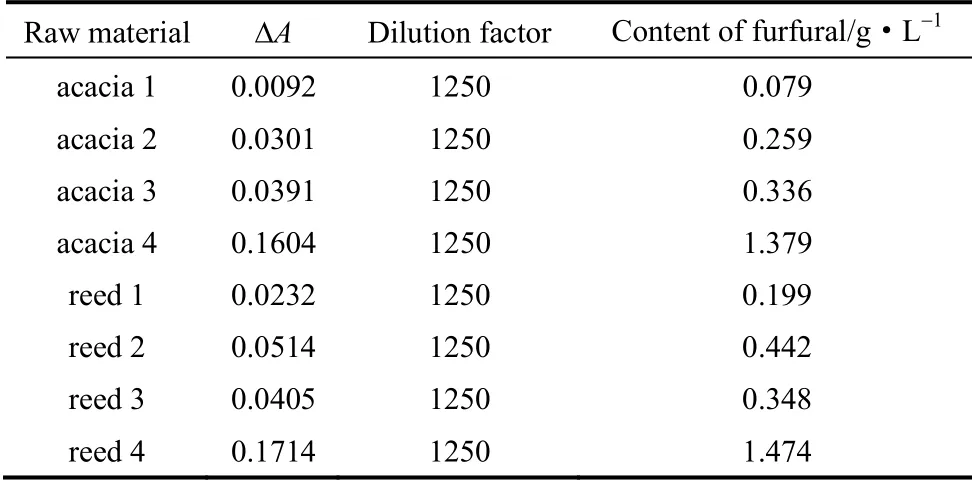
表2 由NaBH4 还原前后ΔA 计算的糠醛含量Table 2 Results of furfural content measured with ΔA before and after reduction of NaBH4

表3 精确度和RSD 计算Table 3 Results of accuracy and RSD
3 结 论
(1)木质纤维高温预水解液中普遍产生的降解产物甲酸、乙酸和糠醛,分别会干扰205 nm 和280 nm 处预水解液溶解性木素测定的准确性。硼氢化钠还原后水解液在280 nm 处紫外吸光度值均有不同程度的下降,且水解条件越高,还原前后的吸光度差值越大,通过充分还原去除糠醛影响后,以280 nm 为特征吸收位置定量测定可溶性木素可行。
(2)预水解液经硼氢化钠充分还原前后在280 nm 处吸光度差值可用于定量测定预水解液中糠醛的含量,通过充分还原后加标的方法,计算糠醛的平均回收率为98.14%~99.88%,精确度较高,相对标准偏差为0.17%~0.35%。
[1]Zhang Y P.Reviving the carbohydrate economy via multi-product lignocellulose biorefineries [J].J.Ind.Microbiol.Biotechnol., 2008, 35(5): 367-375.
[2]Liu Shijie, Zhang Zisheng, Scott G M.The biorefinery: sustainably renewable route to commodity chemicals , energy, and materials//The Second International Biorefinery Conference[C].Syracuse, New York, 2009: 541-542.
[3]Yang Mingni(杨明妮), Chai Lianzhou(柴连周), Zhang Guiqin(张桂琴), et al.Microwave irradiation promoting acid hydrolysis of straw pole into reducing sugar in ionic liquid [Bmin]Cl [J].CIESC Journal(化工学报), 2011, 62(S2): 90-96.
[4]Alterthum F, Ingram L O.Efficient ethanol production from glucose, lactose, and xylose by recombinant Escherichia coli [J].Applied and Environmental Microbiology, 1989, 55(8): 1943-1948.
[5]Zaldivar J, Martinez A, Ingram L O.Effect of alcohol com-pounds found in hemicellulose hydrolysate on the growth and fermentation of ethanologenic Escherichia coli [J].Biotechnol.Bioeng., 2000, 68: 524-530.
[6]Zaldivar J, Ingram L O.Effect of organic acids on the growthand fermentation of ethanologenic Escherichia coli LY01 [J].Biotechnol.Bioeng., 1999, 66: 203-210.
[7]Shi Haiqiang, Fatehi Pedram, Xiao Huining, Ni Yonghao.A combined acidification /PEO flocculation process to improve the lignin removal from the pre-hydrolysis liquor of kraft-based dissolving pulp production process [J].Bioresource Technology, 2011, 102(1): 5177-5182.
[8]TAPPI Test Method T222om-88.Acid-insoluble lignin in wood and pulp[S].Atlanta, GA: TAPPI Press, 1988.
[9]Liu Bingyue(刘秉钺), Shi Haiqiang(石海强), Li Xingqiang(李兴强).Analysis of lignin content in waste liquor of rice straw pulp by ultraviolet spectrophotomer [J].China Pulp & Paper(中国造纸), 2003, 22(6): 19-22.
[10]Gong C S, Cao N J, Du J, et al.Ethanol production from renewable resources [J].Advances in Biochemical Engineering and Biotechnology, 1999, 65: 209-241.
[11]Sjostrom E, Haglund P.Spectrophotometric determination of the dissolution of lignin during sulfite cooking [J].Tappi, 1964, 47(5): 286-291.
[12]Zhang Cui(张翠), Chai Xinsheng(柴欣生), Luo Xiaolin(罗小林), et al.Rapid method for determination of furfural and 5-hydroxymethyl furfural in pre-extraction stream of biomass using UV spectroscopy [J].Spectroscopy and Spectral Analysis(光谱学与光谱分析), 2010, 30(1): 247-252.
[13]Romualdo S Fukushima, Ronald D Hatfield.Extraction and isolation of lignin for utilization as a standard to determine lignin concentration using the acetyl bromide spectrophotometric method [J].J.Agric.Food Chem., 2001, 49(7): 3133-3139.
[14]Shi Haiqiang(石海强), He Beihai(何北海).Measurement of triglyceride content of resin in masson pulp by UV spectral method [J].Spectroscopy and Spectral Analysis(光谱学与光谱分析), 2007, 27(1): 135-138.
[15]Mikhail Iakovlev, Adriaan van Heiningen.SO2-ethanol water (SEW) pulping (I): Lignin determination in pulps and liquors [J].J.Wood Chem.Technol., 2011, 31 (3): 233-249.
[16]Moritz Leschinsky, Gerhard Zuckerstätter, Hedda K Weber, Rudolf Patt, Herbert Sixta.Effect of autohydrolysis of Eucalyptus globules wood on lignin structure (Ⅰ): Comparison of different lignin fractions formed during water prehydrolysis [J].Holzforschung, 2008, (62): 645-652.
[17]Susana R Pereira, Diogo J Portugal-Nunes, Dmitry V Evtuguin, Luísa S Serafim, Ana M R B Xavier.Advances in ethanol production from hardwood spent sulphite liquors [J].Process Biochemistry, 2013, 48(2): 272-282.
[18]Zhuang Xinshu(庄新姝).The study of biomass hydrolysis under extremely low acids for ethanol production[D].Hangzhou: Zhejiang University, 2005.
[19]Wang Shurong( 王 树 荣), Zhuang Xinshu( 庄 新 姝), Luo Zhongyang(骆仲泱), et al.Experimental study and products analysis of lignocellulosic biomass hydrolysis under extremely low acids [J].Journal of Engineering Thermophysics(工程热物理学报), 2006, 27(5): 741-744.
[20]Liu Zhiping(刘志平).Improvement of high temperature sulfonation of wheat straw alkali lignin and its precipitation mechanism on fiber surface[D].Guangzhou: South China University of Technology, 2012.
