普通小球藻固定模拟烟气中CO2的实验研究
2015-08-19罗梦圆杨俊红巩启涛左鹏鹏康利改
罗梦圆,杨俊红,巩启涛,左鹏鹏,康利改
(中低温热能高效利用教育部重点实验室,天津大学机械工程学院,天津 300072)
大气中CO2浓度增加造成的全球变暖已成为一个重要的环境问题。因此,发展固碳技术来控制CO2排放,分离、回收与利用CO2尤为重要[1-2]。
近年来,人们开发了物理、化学和生物等多种固碳方法[2-3]。其中,物理和化学方法属人工固碳,处理成本高且封存容量有限[4-5]。生物固碳属于自然的碳封存过程,不需提纯CO2,可节省分离、捕获和压缩CO2的成本[6];且生物固碳是碳永久封存,不存在CO2逃逸风险。因此,生物固碳法是一种很有前景的固碳方法[7]。
利用微藻光合作用的生物固碳法被认为是一种有效的生物固碳方法[8]。微藻具有油脂含量高、光合效率高及生长周期短等优势,且微藻对环境条件要求不高,适应能力强,许多微藻能够耐受高浓度的CO2[9-10]。利用微藻生产生物燃料可与微藻减排CO2直接联合起来[11]。
在微藻固碳领域,国内外学者已经开展了大量研究工作,尤其在CO2藻种的筛选和高效光生物反应器的开发两方面。不少研究结果表明,普通小球藻固碳效果较好,且有较高的CO2耐性[4,12],因此普通小球藻是一种适用于研究CO2环境下微藻固碳效应的藻种。光生物反应器是高效、大量培养微藻的关键设备。在管式、平板式和柱状气升式等众多光生物反应器形式中,管式光生物反应器由于其较高的微藻生长速率及光照比表面积大等优势,被认为是最适于培养微藻的光生物反应器形式[13-15]。
因此,本工作以普通小球藻为研究对象,利用自行设计的沿程曝气型套管式光生物反应器培养小球藻,研究不同CO2体积分数(5%、10%、15%、20%)的模拟烟气对普通小球藻的生长及固碳速率的影响,以期为普通小球藻固定工业烟气中CO2技术开发提供研究基础。
1 实验材料及方法
1.1 藻种和培养基
本研究采用普通小球藻(Chlorella vulgarisFACHB-1227)作为实验藻种,藻种采购于中国科学院典型培养物保藏委员会淡水藻种库(FACHB-Collection)。
实验选用SE无碳培养基[16]培养小球藻,其配方如下:NaNO30.25g/L,K2HPO4·3H2O 0.075g/L,MgSO4·7H2O 0.075g/L,CaCl2·2H2O 0.025g/L,KH2PO40.175g/L,NaCl 0.025g/L,Soil extract 40mL,FeCl3·6H2O 0.005g/L,Fe-EDTA 1mL,A5 solution 1mL。
1.2 光生物反应器、实验系统及实验设备
1.2.1 光生物反应器
实验培养过程在自制的沿程曝气型套管式光生物反应器中进行。反应器材质为透明有机玻璃,外管内径为200mm,壁厚为8mm,外管上端有直径为30mm的玻璃排气孔;内部套管外径为100mm,壁厚为5mm,内部套管轴向壁面上等距布置49个直径1mm的曝气孔,位于内管背光斜下角45°位置。内外管管长均为1000mm。沿程曝气型套管式光生物反应器的结构示意图见图1。
1.2.2 实验系统
采用作者课题组设计的的固碳产油微藻高效规模化培养系统,其结构简图见图2。

图1 沿程曝气型套管式光生物反应器结构示意图
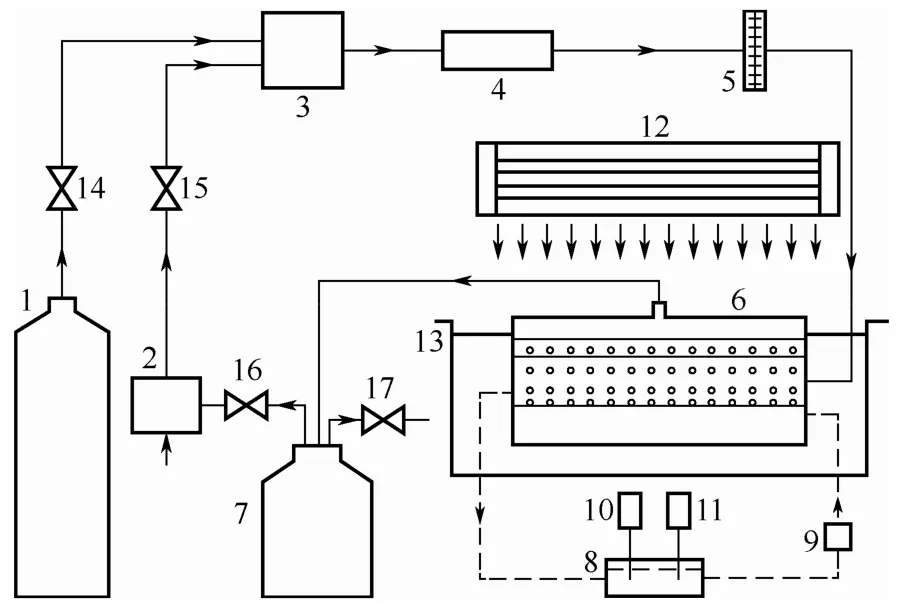
图2 固碳产油微藻高效规模化培养系统结构简图
图2实验系统分藻液的流动循环和气体循环。
藻液的流动循环:蠕动泵9作为藻液循环动力,将藻液从封闭的储液槽8中泵入光生物反应器6内,此时储液槽内由于藻液的减少导致槽内气压降低,使得光生物反应器6中的藻液流入储液槽8中,完成一次藻液的流动循环。
气体循环:培养开始时关闭节流阀16,打开节流阀14、15及排气阀17,由空气泵2吸入空气,经节流阀15控制进入混气室3,同时CO2气瓶1通过节流阀14控制将CO2气体通入混气室3,混气室中的气体通过气体分析仪4测量CO2含量,调节节流阀14控制CO2的流量,配置CO2浓度至设定浓度后关闭节流阀14。打开节流阀16并关闭储气罐排气阀17,开启空气泵2开始培养微藻,待CO2体积分数下降0.5%时,打开节流阀14适当补充CO2,待浓度达到设定浓度时,关闭节流阀14,反复进行。
1.2.3 实验主要设备
实验主要用到的设备有:SX-500型高压灭菌器,Tomy Digital Biology Co. Ltd;XDS-200D型倒置生物显微镜,上海蔡康光学仪器有限公司;LG10-2.4A型高速离心机,北京京立离心机有限公司; 101-1型电热鼓风干燥箱,天津市泰斯特仪器有限公司。
1.3 培养条件
藻液初始接种密度为3×105cells/mL,反应器装液量为35L。恒温水浴池提供25℃的恒温水浴,采用日光灯提供光源,光照强度为3960lux,光暗周期为12h∶12h,藻液循环速率为1.5L/min。实验采用间歇性曝气,空气流量为10L/min,每天9:00开始曝气并开启光源,每隔1h曝气一次,每次曝气0.5h,晚上21:00关闭光源并停止曝气。模拟烟气采用含5%、10%、15%和20%CO2的空气,同时与通入纯空气对比。
1.4 测量方法
1.4.1 藻细胞密度和干重的测定
藻细胞密度的测定采用血球计数板计数法[17],每天早晚各记录一次。
藻细胞干重的测定采用干重法。取待测藻液在高速离心机中4000r/min转速下离心10min,去除上清液,将沉淀物置于电热鼓风干燥箱中,在105℃下烘干2h至恒重[18-19],冷却至室温其称干重。
1.4.2 微藻固碳率的计算
小球藻的固碳率可利用藻细胞的干重及其含碳率来计算,见式(1)[20]。

式中,V为小球藻的固碳率,g/(L·d);,MCO2为CO2分子量,g/mol;MC为碳的原子量,g/mol,X0和X1分别为初始接种和培养结束时微藻干重,g/L;T为培养时间,天。C为微藻的含碳率(质量分数),根据微藻的经验分子式计算确定微藻的含碳率[7,21]。
1.4.3 藻液溶氧量、pH值的测定 由储液槽内安装的pH计和溶氧仪分别测量。
2 结果和讨论
微藻利用CO2进行光合作用并产生O2,不同的CO2通入量对藻体的生长有直接的影响,进而影响微藻的固碳速率。同时,由于CO2的通入,藻液的pH值及藻液溶氧量也会受到影响。
2.1 不同CO2浓度对小球藻细胞密度及固碳速率的影响
不同浓度CO2对普通小球藻细胞密度及固碳速率的影响见图3。

图3 不同浓度CO2下普通小球藻细胞密度随时间的变化
由图3知,培养前4天,空气组与模拟烟气组小球藻处于生长适应期,生长情况一致,如图3中Ⅱ所示。第5天开始,空气组小球藻细胞密度开始高于模拟烟气组,且生长趋势较好,小球藻开始进入生长期;而模拟烟气组在前5天小球藻的生长情况一致,第6天开始10%CO2组藻细胞密度高于5%、15%和20%CO2组,5%组要优于15%和20%CO2组。整个生长期,空气组藻细胞生长情况都要优于模拟烟气组,模拟烟气组中10%CO2组小球藻生长情况要优于5%、15%和20%CO2组,如图3中Ⅱ所示。第14天时,空气组、5%、15%和20%CO2模拟烟气组都进入稳定期;但10%CO2模拟烟气组仍处于生长期,且增长趋势较好,第16天时,10%CO2组小球藻的细胞密度达到空气组的细胞密度,第17天时高于空气组,且仍处于增长趋势,如图3中Ⅲ所示。
经过17天的培养,小球藻在不同浓度CO2下细胞密度及固碳率比较见表1。由表1知,17天后,空气组藻细胞密度达到7.67×106cells/mL。模拟烟气组在10%CO2时藻细胞密度达最大值8.76×106cells/mL,相比于5%、15%组和20%组分别提高了54.23%、66.86%和76.97%;其固碳率达30.18mg/(L·d),较5%、15%组和20%组分别提高了57.27%、70.89%和81.91%。
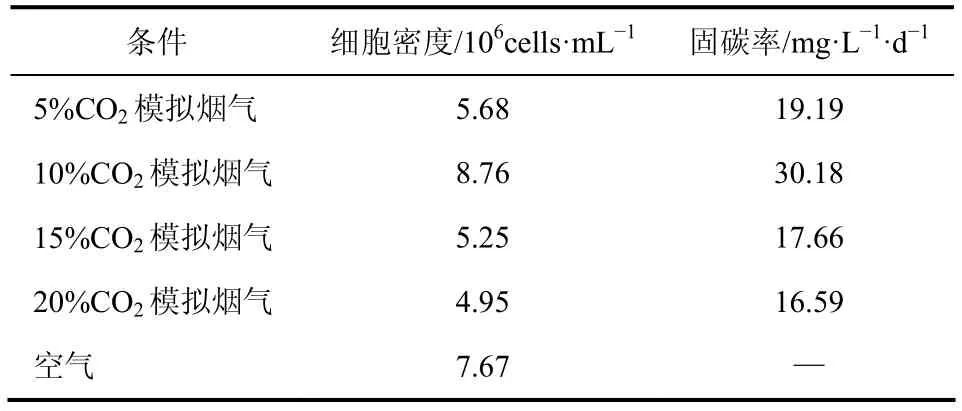
表1 培养17天后不同浓度CO2下普通小球藻细胞密度及固碳率
实验结果表明,普通小球藻在10%CO2下细胞密度和固碳率达最大。许多学者也得出了类似结论。巩三强等[22]采用BG-l1培养基在2.4L的气升式光生物反应器中通入5%和15% CO2的模拟烟气培养小球藻(Chlorella sorokinianaCS-01),结果表明,10%CO2的模拟烟气中小球藻生长最好,固碳率最大[240mg/(L·d)]。徐强等[23]采用SE培养基在自制的微藻培养反应装置中通入含7.0873%,9.5313%,15.0248%CO2的空气培养小球藻,结果表明,小球藻在通入9.5313%CO2时生长较好,CO2吸收率最大(26.1108%)。
2.2 不同CO2下微藻藻液的pH值变化
培养期间空气组和模拟烟气组的普通小球藻藻液pH值变化如图4。
由图4知,空气组的藻液pH值前9天一直缓慢上升,第9天之后开始稳定在9.00附近。模拟烟气组的藻液pH值都由初始值急剧下降,5%、10%、15%和20%CO2模拟烟气组的pH值由最初的7.40第二天分别急剧下降到5.83、5.38、5.07和5.16,然后缓慢上升基本稳定,最后分别达到5.96、5.78、5.54和5.57。模拟烟气组藻液pH值基本稳定在 5.00~6.25。
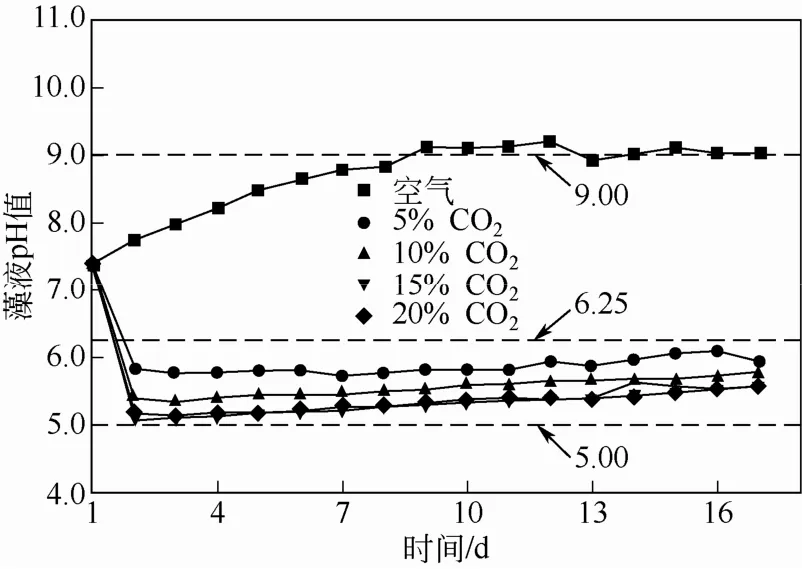
图4 不同浓度CO2下普通小球藻藻液pH值随时间的变化
藻液的pH值变化主要受到小球藻的生长代谢和通入CO2的影响。空气组藻液pH值上升主要是受微藻生长代谢的影响,藻细胞通过自身生长代谢活动改变培养基的pH值[24]。模拟烟气组的藻液pH值变低主要受到通入的CO2的影响,CO2被藻液吸收后会与H2O作用生成H2CO3。H2CO3在藻液中转变为HCO3-和CO32-形式的碳源,同时产生了H+,并且H+浓度随着CO2溶解量的增大而升高,从而导致藻液pH值降低[4]。本实验条件下模拟烟气组的藻液pH值一直处于较低范围(5.0~6.25),偏离普通小球藻适宜生长的最适pH值(10.0)[25],这对小球藻的生长不利,所以出现了生长情况不如空气组。
2.3 不同CO2下藻液的溶氧量的变化
藻液中的溶氧主要是小球藻通过光合作用产生,培养期间空气组和模拟烟气组的普通小球藻藻液溶氧值变化如图5。
由图5知,培养期间空气组和模拟烟气组藻液溶氧量在前11天波动较大,第14天开始基本保持稳定。空气组的藻液溶氧值整体处于6.0~6.5mg/L范围内,第14天开始基本稳定在6.5mg/L附近。5%模拟烟气组藻液溶氧值整体处于7.2mg/L附近;10% 模拟烟气组藻液溶氧值整体处于5.7~6.3mg/L范围内,第14天开始基本稳定在5.8mg/L附近;15%和20%模拟烟气组藻液溶氧值整体处于6.4~6.8mg/L范围内,第14天开始基本稳定在6.5mg/L附近。
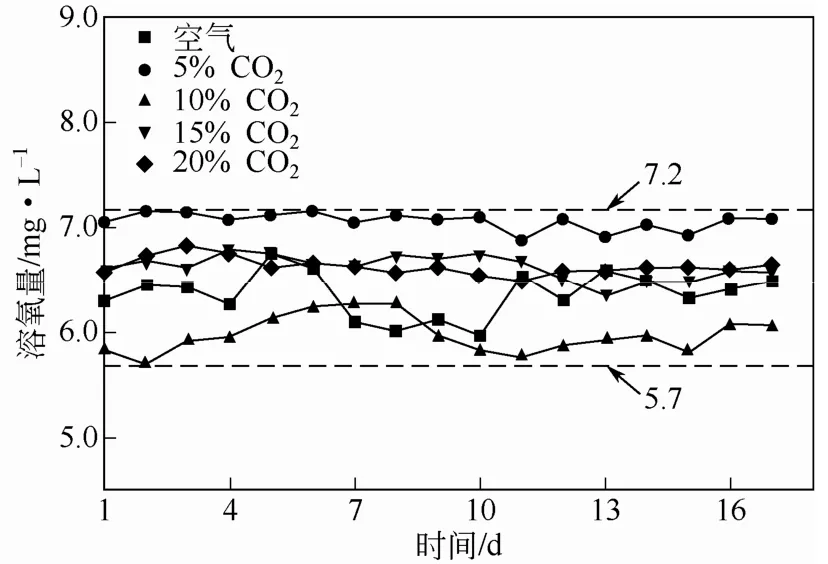
图5 不同浓度CO2下普通小球藻藻液溶氧量随时间的变化
实验中藻液溶氧量处于5.7~7.2mg/L范围内,均低于微藻生长可承受溶氧值(7.5mg/L)[26]。可见,本实验采用的沿程曝气型套管式光生物反应器,能够及时排除藻液中积累的溶解氧,可改善由于溶解氧积累抑制微藻生长的不利情况。
3 结 论
通过在自行设计的沿程曝气型套管式光生物反应器中培养普通小球藻,研究不同浓度CO2的模拟烟气对小球藻细胞密度、平均固碳率、藻液pH值和溶氧量影响,可得出如下结论。
(1)普通小球藻在10% CO2的模拟烟气下细胞密度和固碳速率最大。控制烟气中的CO2浓度在微藻适合生长的范围内有利于提高小球藻的固碳速率,更有效去除烟气中的CO2。
(2)由于通入CO2的影响,模拟烟气组的藻液pH值一直处于较低范围内(5.0~6.25),远远偏离普通小球藻生长的最适pH值,这对小球藻的生长不利。
(3)培养过程中藻液溶氧值处于微藻生长适宜范围内(≤7.5mg/L)。可见,沿程曝气型套管式光生物反应器中的内管曝气结构,可缓解由于溶解氧积累抑制微藻生长的不利情况。
不同浓度CO2的模拟烟气对普通小球藻的细胞密度及固碳速率的影响,为小球藻固定CO2技术开发提供一定研究基础。
[1] Arata S,Strazza C,Lodi A,et al. Spirulina platensis culture with flue gas feeding as a cyanobacteria-based carbon sequestration option[J].Chemical Engineering & Technology,2013,36(1):91-97.
[2] Chiu S-Y,Tsai M-T,Kao C-Y,et al. The air-lift photobioreactors with flow patterning for high-density cultures of microalgae and carbon dioxide removal[J].Engineering in Life Sciences,2009,9(3):54-260.
[3] Abu-khader Mazen M. Recent progress in CO2capture/sequestration:A review[J].Energy Sources Part A:Recovery Utilization and Environmental Effects,2006,28(14):1261-1279.
[4] 宋成军,董保成,赵立欣,等. 纯二氧化碳条件下小球藻固定CO2[J]. 环境工程学报,2012,6(12):4566-4572.
[5] 宋存义,周向. 捕集低浓度二氧化碳的化学吸收工艺及其综合比较[J]. 环境工程学报,2012,6(1):1-8.
[6] 李新宇,唐海萍. 陆地植被的固碳功能与适用于碳贸易的生物固碳方式[J]. 植物生态学报,2006,30(2):200-209.
[7] 刘明升,魏群,蔡元妃,等. 六种微藻固定CO2实验研究[J]. 广西大学学报:自然科学版,2012,37(3):544-548.
[8] Wang B,Li Y,Wu N,et al. CO2bio-mitigation using microalgae[J].Appl. Microbiol. Biotechnol.,2008,79(5):707-718.
[9] Phukan M M,Chutia R S,Konwar B K,et al. MicroalgaeChlorellaas a potential bio-energy feedstock[J].Applied Energy,2011,88(10):3307-3312.
[10] 都基峻,曾萍,石应杰,等. 模拟烟气条件下野生混合微藻的培养[J]. 环境科学研究,2010,23(3):366-370.
[11] Concas A,Pisu M,Cao G. Mathematical modelling of Chlorella Vulgaris growth in semi-batch photobioreactors fed with pure CO2[J].Chemical Engineering Transactions,2013,32:1021-1026.
[12] 张一昕,赵兵涛,熊锴彬,等. 微藻固定燃烧烟气中CO2的研究进展[J]. 生物工程学报,2011,27(2):164-171.
[13] Jacob-lopes E,Gimenes Scoparo C H,Franco T T. Rates of CO2removal by a Aphanothece microscopica Nageli in tubular photobioreactors[J].Chemical Engineering and Processing,2008,47(8):1371-1379.
[14] Kunjapur A M,Eldridge R B. Photobioreactor design for commercial biofuel production from microalgae[J].Industrial & Engineering Chemistry Research,2010,49(8):3516-3526.
[15] 吴良柏,李震,宋耀祖. 螺旋管式光生物反应器的研究[J]. 工程热物理学报,2010,31(8):1375-1378.
[16] 张毅,费晓雯,彭世清,等. 4 种不同培养基对小球藻Chlorellaspp. 生长和油脂累积的影响[J]. 热带作物学报,2010,31 (8):1340-1345.
[17] Ragauskas A J,Williams C K,Davison B H,et al. The path forward for biofuels and biomaterials[J].Science,2006,311(5760):484-489.
[18] Go S,Lee SJ,Jeong GT,et al. Factors affecting the growth and the oil accumulation of marine microalgae,Tetraselmis suecica[J].Bioprocess and Biosystems Engineering,2012,35(1-2):145-150.
[19] Das P,Aziz S S,Obbard J P. Two phase microalgae growth in the open system for enhanced lipid productivity[J].Renewable Energy,2011,36(9):2524-2528.
[20] Jacob-lopes E,Gimenes Scoparo C H,Cacia Ferreira Lacerda L M,et al. Effect of light cycles (night/day) on CO2fixation and biomass production by microalgae in photobioreactors[J].Chemical Engineering and Processing,2009,48(1):306-310.
[21] He Jiankun,Zhang Aling,Ye Yong. Technology options for CO2mitigation in China[J].Ambio,1996,25(4):249-253.
[22] 巩三强.模拟烟道气对小球藻Chlorella sorokinianaCS-01生长及脂质累积影响的研究[D].长沙:中南大学,2012.
[23] 徐强.藻类吸收和固定烟气中的CO2的研究[D].太原:太原理工大学,2010.
[24] 王翠,李环,王钦琪,等. pH 值对沼液培养的普通小球藻生长及油含量积累的影响[J]. 生物工程学报,2010,26(8):1074-1079.
[25] 吕梦梦. 普通小球藻培养过程中pH条件优化的实验研究[D]. 天津:天津大学,2012.
[26] Wang J,Han D,Sommerfeld M,et al. Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobioreactor[J].Journal of Applied Phycology,2013,25(1):253-260.
