氧对丙烷脱氢反应体系影响的热力学分析
2015-08-19林少波单玉领隋志军朱贻安李平周兴贵
林少波,单玉领,隋志军,朱贻安,李平,周兴贵
(华东理工大学化学工程联合国家重点实验室,上海200237)
随着丙烯市场需求量的迅猛增长,以丙烷为原料经催化直接脱氢制取丙烯已成为重要的丙烯增产途径。该工艺目前已工业化,但存在着能耗高和催化剂易结焦失活等问题。采用氧化脱氢和脱氢氧化等新型催化脱氢工艺不但可以降低反应温度,而且能部分提供反应热量从而减少能耗,同时还能减缓催化剂失活、延长催化剂的使用寿命,因而成为当前丙烷脱氢制丙烯技术的研究热点[1-4]。
虽然已有不少文献对丙烷氧化脱氢和脱氢氧化过程进行过热力学分析,但都侧重于生成目的产物反应的平衡组成计算[5-7],极少考虑其他烃类、一氧化碳及含氧有机物等副产物的生成以及所加入氧气量的影响,明显与目前催化实验及气相反应观察到的情况不相符[8-10]。本文作者在归纳文献中涉及临氧条件下丙烷脱氢各种反应产物组成[8-12]的基础上,确定了27种可能的产物,应用Aspen Plus化工模拟软件,根据吉布斯自由能变化最小值原理[13],较系统全面地计算了0.1MPa压力及300~700℃温度范围内,等温等压吉布斯反应器中反应体系的热力学平衡组成,讨论了氧化脱氢和脱氢氧化两种工艺中氧与丙烷摩尔比等热力学反应条件对产物分布的 影响。
1 热力学计算方法
1.1 独立反应
以C3H8和O2为原料,确定产物为C3H6、CH4、C2H2、C2H4、C2H6、C3H4、H2O、H2O2、H2、CO、CO2,以及含氧有机物包括甲醇(CH3OH)、甲醛(HCHO)、甲酸(HCOOH)、乙醇(CH3CH2OH)、乙醛(CH3CHO)、乙酸(CH3COOH)、环氧乙烷(C2H4O)、丙醇(CH3CH2CH2OH)、异丙醇(CH3CHOHCH3)、丙醛(CH3CH2CHO)、丙酮(CH3COCH3)、丙酸(CH3CH2COOH)、环氧丙烷(C3H6O)、丙烯醇(CH2CHCH2OH)、丙烯醛(CH2CHCHO)和丙烯酸(CH2CHCOOH),共27种物质(为了便于计算,忽略了C4及以上产物和焦炭等物种),通过原子矩阵法计算得出了表1中26个独立反应。
1.2 反应吉布斯自由能变化
查找热力学数据库后计算出各物质在300~700℃温度范围的ΔGθf,根据式(1)计算得到各个温度下的反应吉布斯自由能变化(ΔrGθ)[14]。

发现在300~700℃温度范围内,丙烷裂解生成丙烯和低碳烃[表1中(1)~(5)]、甲烷重整[表1中(8)]以及氢部分氧化生成过氧化氢[表1中(6)]反应的ΔrGθ相对较大,但大多随温度上升而减小,说明这些反应在高温下可以发生;而丙烷氧化脱氢生成丙烯[表1中(7)]以及丙烷部分氧化生成丙醇、异丙醇、丙烯醇、丙酮和丙醛反应[表1中(9)~ (13)]的ΔrGθ都小于-200kJ/mol,丙烷部分氧化生成其他含氧有机物[表1中(14)~(24)]以及深度氧化[表1中(25)和(26)]反应的ΔrGθ则均小于-500kJ/mol,表明丙烷氧化脱氢及其他氧化反应在热力学上是非常有利的。图1(a)、图1(b)画出了表1中(1)~(13)各独立反应的ΔrGθ随温度的变化。

表1 独立反应
2 体系平衡组成分析
2.1 丙烷氧化脱氢体系
在压力为0.1MPa、温度为300~700℃及进料O2/C3H8的摩尔比为(1∶1)~(1∶8)的条件下,反应体系原料C3H8及主要产物C3H6、CH4、C2H4、H2、H2O、CO和CO2的平衡组成如图2(a)~图2(h)所示,其中图2(a)~图2(e)还给出了无氧丙烷脱氢体系 (O2/C3H8=0∶8)的平衡组成以资比较,而由于原料O2及C3H4、C2H6、C2H2、CxHyOz、H2O2等产物在反应平衡体系中的含量相对较低,所以此处未给出这些物质的含量变化图。表2则列出了丙烷、氧及各产物在所计算的反应条件范围内的最高含量及存在条件,产物按最高含量排序为:CH4>CO~H2~C3H6> CO2> C2H4> C3H4~C2H6> C2H2> H2O >> CxHyOz>>H2O2。其中,CxHyOz为所有含氧有机物的总和。

图1 表1中反应式(1)~式(13)的ΔrGθ随温度的变化

图2 平衡体系各物质含量随反应温度和原料摩尔比的变化
计算结果发现,原料丙烷与氧气一样在所有含氧条件下几乎能完全转化。丙烯的最高含量产生在300℃无氧丙烷脱氢平衡体系中,加入氧对丙烯生成非常不利,氧加入量越多,丙烯生成量越少。丙烯选择性随温度和O2/C3H8摩尔比变化趋势与图2(b)中的丙烯含量变化一致,最大选择性61.93%出现在300℃无氧条件下(图略)。对丙烯构成严重竞争的产物是甲烷和一氧化碳,当丙烷无氧脱氢时,C—C断裂形成甲烷是主要副反应,而当丙烷氧化脱氢时,丙烷深度氧化生成一氧化碳成为最主要的含氧产物。在几乎所有的平衡体系中,甲烷和一氧化碳都是主要副产物,两者各自的含量甚至会超过丙烯量。所有含氧有机物的生成量都微乎其微,其中含量最多的是丙烯醛(图略)。值得一提的是,随着氧加入量的增加,氢的含量反而上升,揭示着热力学上丙烷脱氢体系难以通过加氧的方式消除氢。Layokun[11]和Pease等[15]曾对丙烷与氧气在不同温度区间内的均相反应进行过考察,认为丙烷主要发生裂解、脱氢以及部分与深度氧化反应,检测到的产物有低碳烃类、氢、一氧化碳、二氧化碳以及微量的醇、醛等含氧物质,发现氧加入量及温度对产物分布有很大影响,其实验结果与本文的热力学模拟结果比较相似。
2.2 丙烷脱氢氧化体系

图2 平衡体系各物质含量随反应温度和原料摩尔比的变化
在丙烷直接脱氢之后加入氧气进行反应,结合 该工艺目前的工业操作条件[16-17],计算了两种极端反应情况,即低温低氧含量和高温高氧含量下平衡体系中丙烯的物质的量和C3H8+C3H6总物质的量的损失率,结果分别显示于图3和图4中。图3的计算条件:反应温度300℃,nO2∶nC3H8+C3H6=1∶8;图4的计算条件:反应温度700℃,nO2∶nC3H8+C3H6=1∶1;其他进料条件均为nO2∶nC3H8+C3H6=100 kmol,nH2∶nC3H8+C3H6=(1∶8)~(2∶1),nC3H6∶nC3H8=(1∶4)~(4∶1)。

图3 T=300℃及nO2∶nC3H8 +C3H6=1∶8进料下平衡体系丙烯量和C3H8+C3H6损失率随原料摩尔比的变化

表2 各物质的最高摩尔分数及产生条件
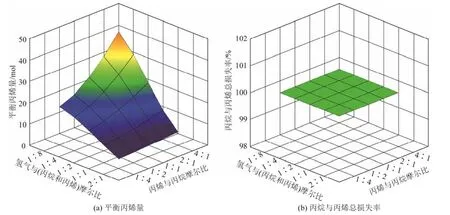
图4 T=700℃及nO2∶nC3H8 +C3H6=1∶1进料下平衡体系丙烯量和C3H8+C3H6损失率随原料摩尔比的变化
从图2(b)得知,低温和低氧含量有利于提高丙烯含量,再比较图3(a)可见,低温和低氧含量情况下,较少的氢进料和较多的丙烯进料可使平衡体系中的丙烯量维持相对高水平,当nH2∶nC3H8+C3H6=1∶8、nC3H8∶nC3H6=4∶1时,丙烯量达最高,为66.5kmol。然而,值得注意的是,此平衡丙烯量与进料丙烯量(80kmol)相比,实际上丙烯损失了。而当进料条件改为nH2∶nC3H8+C3H6=2∶1、nC3H6∶nC3H8=1∶4时,平衡丙烯量已降为零。只有在nH2∶nC3H8+C3H6<1∶4、nC3H6∶nC3H8<1∶1及nH2∶nC3H8+C3H6<1∶2、nC3H6∶nC3H8<1∶2的区域内,丙烯的平衡量才高于进料量,如nH2∶nC3H8+C3H6=1∶8、nC3H6∶nC3H8=1∶4时,丙烯进料量为20kmol,而平衡量为 45.1kmol,暗示部分丙烷转化为了丙烯。在Hayashi等[18]的实验中,也发现了类似现象,即在特定的反应条件下,丙烯含量会增加。图3(b)显示了不同进料条件下平衡体系中C3H8+C3H6总物质的量的损失率(定义为平衡体系中C3H8+C3H6的总物质的量相对于进料C3H8+C3H6总物质的量减少的百分率),可以看出,任何进料条件下平衡后C3H8+C3H6的总物质的量都减少了,在nH2∶nC3H8+C3H6=2∶1、nC3H6∶nC3H8=1∶4时损失率接近了100%,而此时甲烷生成量达最高值,为288.1kmol(图略),其余产物主要为二氧化碳(11.5kmol)和一氧化碳(0.3kmol),说明进料氢量较多及丙烯量较少会导致原料烃几乎全部裂解成C1物种,进而生成C1含氢和含氧化合物。即使在丙烯的平衡量高于进料量的区域,C3H8+C3H6总物质的量的损失也较大,例如,当以nH2∶nC3H8+C3H6=1∶8、nC3H6∶nC3H8=1∶4条件进料时,损失率为50.3%,意味着丙烷除了转化为丙烯,还生成了其他低碳产物,主要是甲烷(105.8kmol)和一氧化碳(25kmol)。
由图4可见,在高温和高氧含量情况下,各进料平衡体系的丙烯量极少(约10-6kmol),C3H8+C3H6总量损失率极大(约100%),主要产物是甲烷和一氧化碳及少量二氧化碳和水(图略),说明这些条件下理论上已无可能获得丙烯。
纵观上述两种极端反应情况下的平衡结果,无论低温高温,氧后加入到丙烷脱氢体系,都会大量生成甲烷和一氧化碳,造成总烃原料的损耗。低温时只有在小范围进料条件下才能使丙烷部分转化为目的产物丙烯,但平衡丙烯量只能维持在较低水平上。升高温度对丙烷脱氢氧化平衡体系中丙烯的稳定存在极其不利,原料总烃将全部转化为低碳化 合物。
3 结 论
对丙烷氧化脱氢和脱氢氧化两种反应体系在300~700℃温度范围进行了热力学分析,考虑了原料丙烷裂解生成丙烯和低碳烃、部分氧化生成含氧有机物及深度氧化生成一氧化碳和二氧化碳等27种产物。计算结果表明,加入氧非常不利于目的产物丙烯生成。与无氧脱氢相比,进行氧化脱氢会降低丙烯选择性和生成量,且反应温度越高、原料O2/C3H8摩尔比越大,则丙烯平衡生成量越少;最主要的副产物是甲烷和一氧化碳,而非二氧化碳和水。丙烷脱氢后再进行氧化,在低温和低氧含量下可获得相对较高的丙烯平衡量,但难以避免生成甲烷和一氧化碳而导致原料损耗;在高温和高氧含量下已无法获得丙烯,原料全部转化成甲烷和一氧化碳等副产物。
[1] Bhasin M M,McCain J H,Vora B V,et al. Dehydrogenation and oxydehydrogenation of paraffins to olefins[J].Applied Catalysis A:General,2001,221:397-419.
[2] 王红秋,郑轶丹. 丙烷脱氢生产丙烯技术进展[J]. 石化技术,2011,18(2):63-66.
[3] 周巍. 丙烷脱氢制丙烯技术浅析[J]. 石油化工设计,2013,30(3):36-38.
[4] 余长林,葛庆杰,徐恒泳,等. 丙烷脱氢制丙烯研究新进展[J]. 化工进展,2006,25(9):977-982.
[5] 上官荣昌,葛欣,王健锋,等. 二氧化碳氧化丙烷制丙烯的热力学分析[J]. 石油与天然气化工,2002,31(1):5-7.
[6] 刘淑鹤,方向晨,张喜文,等. 丙烷脱氢催化反应机理及动力学研究进展[J]. 化工进展,2009,28(2):259-266,282.
[7] 叶敏,李贤. 丙烷脱氢氧化制丙烯热力学分析[J]. 化学工业与工程技术,2011,32(6):18-21.
[8] Burch R,Crabb E M. Homogeneous and heterogeneous contributions to the oxidative dehydrogenation of propane on oxide catalysts[J].Applied Catalysis A:General,1993,100:111-130.
[9] Beretta A,Forzatti P,Ranzi E. Production of olefinsviaoxidative dehydrogenation of propane[J].Journal of Catalysis,1999,184:469-478.
[10] Fathi M,Lødeng R,Nilsen E S,et al.Short contact time oxidative dehydrogenation of propane[J].Catalysis Today,2001,64:113-120.
[11] Layokun S K. Oxidative pyrolysis of propane[J].Ind. Eng. Chem. Process Des. Dev.,1979,18(2):241-245.
[12] Satterfield C N,Wilson R E. Partial oxidation of propane[J].Industrial and Engineering Chemistry,1954,46(5):1001-1007.
[13] 张海娟,张舒冬,李江红,等. 丙烷脱氢反应的热力学分析[J]. 石油化工,2012,41(s1):86-88.
[14] 熊刚华,李平,张世渊,等. 小分子烃类及含氧有机物蒸汽重整制氢反应热力学[J]. 化学反应工程与工艺,2010,26(2):104-111.
[15] Pease R N,Munro W P. The slow oxidation of propane[J].J. Am. Chem. Soc.,1934,56(10):2034-2038.
[16] The Uhde STAR process:Oxydehydrogenation of light paraffins to olefins[EB/OL]. www. uhde. eu,2014.
[17] Liu R D,Zhu Y A,Sui Z J,et al. Support effects on catalytic performance for selective combustion of hydrogen in the presence of propene[J].Fuel Processing Technology,2013,108(35):82-88.
[18] Hayashi T,Han L B,Tsubota S,et al. Formation of propylene oxide by the gas-phase reaction of propane and propene mixture with oxygen[J].Ind. Eng. Chem. Res.,1995,34:2298-2304.
