活性污泥胞外聚合物与双氯芬酸的相互作用
2015-08-17包宜俊杨存满陆光华
包宜俊,杨存满,李 颖,陆光华
(浅水湖泊综合治理与资源开发教育部重点实验室,河海大学环境学院,南京 210098)
活性污泥胞外聚合物与双氯芬酸的相互作用
包宜俊,杨存满,李颖,陆光华
(浅水湖泊综合治理与资源开发教育部重点实验室,河海大学环境学院,南京210098)
利用三维荧光光谱和红外光谱方法,研究活性污泥胞外聚合物与双氯芬酸之间的相互作用。考察了pH、电导率和不同离子对两者之间相互作用的影响。结果表明:胞外聚合物的荧光峰强度随着双氯芬酸的加入而被猝灭,二者间结合常数值(lgK)为3.28~4.90。胞外聚合物与双氯芬酸结合会导致胞外聚合物原有的结构发生改变。研究发现:pH的变化可以增强两者的结合,有助于双氯芬酸在污水处理过程中的去除,而电导率和不同离子对体系的影响并不明显。
胞外聚合物;双氯芬酸;三维荧光光谱;结合作用
双氯芬酸(Diclofenac,DCF)作为非甾体消炎类药物,能够通过抑制前列腺素合成而起到消炎止痛作用, 被广泛使用[1]。研究表明DCF进入人体后大部分会以原型或代谢产物的形式排放到环境中[2],而DCF的代谢产物容易在污水处理过程中裂解成原型排放到环境水体中。文献报道DCF在污水处理厂中的去除效率在21%~40%之间[3],因此DCF在自然水体中检出率很高,给人体健康和环境安全带来威胁。Sui[4]等检测北京两个污水处理厂尾水中DCF的残留浓度为0.035~0.46 μg/L。Wang[5]等人在调查黄河、海河及辽河中的酸性药物残留时发现DCF有较高的检出率,最高浓度达到717 ng/L。Zhao[6]等人在珠江流溪河、石井河以及珠江河段的地表水中也检测出DCF,最高浓度为150 ng/L。
胞外多聚物(extracellular polymeric substance,EPS)是微生物在生长和代谢过程中产生的一类高分子物质,它覆盖在微生物细胞表面及填充在污泥絮体内部空隙中,维持着污泥的结构和功能的完整性,在活性污泥系统中起着极其重要的作用。EPS主要由大分子有机物质组成,如腐殖质类、多聚糖类、蛋白类和核酸类,组成非常复杂。EPS表面具有大量的活性官能团和疏水区域,具有极大的吸附和络合能力[7],能够通过吸附和络合作用与菲、苯、腐殖酸和染料等有机污染物结合,从而将污染物从水体中去除[8]。由于双氯芬酸的苯环结构,EPS与双氯芬酸间能够发生相互作用,从而影响双氯芬酸在水体中的迁移过程。但是,目前为止二者的相互作用机制尚不清楚,环境条件对二者作用影响还未见报道。本研究利用三维激发发射矩阵荧光(Three-dimensional excitation-emission matrix,EEM)、同步荧光及傅里叶红外光谱方法研究了活性污泥胞外聚合物与双氯芬酸的相互作用机制,探讨胞外聚合物在双氯芬酸迁移和去除过程中所起的作用,为强化双氯芬酸在活性污泥系统中的去除提供理论依据和技术指导。
1 材料与方法
1.1材料与仪器
双氯芬酸(纯度大于99%)购于梯希爱(上海)化成工业发展有限公司。蒽酮试剂,酒石酸钠溶液,Fulin酚试剂,甲醇,离子交换树脂(Cation exchange resin, CER)均为分析纯,购于南京荣华科学器材有限公司。
电导率仪(雷磁,DSJ-308A,上海),高速冷冻离心机(湘智,TGL-16M,长沙),荧光光谱仪(Hitachi,F7000,日本),紫外可见分光光度计(Hach,Alpha-1506,美国),傅里叶红外光谱仪(Bruker,Tensor27,德国)。
1.2实验方法
1.2.1EPS提取与测定
采自南京市江宁城市污水处理厂二沉池的活性污泥用离子交换树脂法提取活性污泥胞外聚合物。将50 mL活性污泥悬浮液置于离心管中以5000 r/min转速离心15 min,离心后舍弃上清液,用50 mL NaCl溶液 (0.1 mol/L)洗涤两次。将洗涤过的污泥悬浮液置于50 mL的磷酸缓冲溶液(pH 7.0)中。处理的污泥混合液转移至提取容器中,同时加入一定量的离子交换树脂(60g/g),在4oC下连续搅拌6h提取EPS。提取结束后将离子交换树脂/污泥的混合液静置3 min,保证离子交换树脂完全沉淀。将上层提取液在4oC下以10000 r/min速度离心30 min,得到的上清液用0.45 μm醋酸纤维素膜过滤,滤液即为EPS溶液。最后将该溶液在60oC干燥箱中烘干得到EPS固体。
EPS中多糖采用蒽酮比色法测定[9],用葡萄糖作为标准。蛋白质和腐殖酸采用改进Lowry法测定[10],分别用牛蛋白血清与腐殖酸作为标准。
1.2.2三维荧光光谱分析
将从300 ml活性污泥中提取的EPS固体用磷酸缓冲溶液配制成浓度为200 mg/L的储备液。移取5 mL EPS溶液加入到一系列10 mL比色管中,同时在每个比色管中加入的不同体积DCF溶液(1.0 g/L),用磷酸缓冲液定容至10 mL。为了保证EPS与DCF充分结合,溶液振荡2h后进行三维荧光以及同步荧光测定。设置对照实验和平行实验,测试结果取平均值。
三维荧光光谱激发波长和发射波长范围均为200~500 nm;激发和发射狭缝设为2.5 nm;扫描速度为12000 nm/min。三维荧光光谱采用Origin8.0等高线图绘制。
1.2.3红外光谱分析
为了研究EPS结合DCF的构型变化,采用红外光谱方法对EPS的构型进行分析。在配有DTGS KBr检测器和衰减全反射 (ATR)附件的Bruker,Tensor 27型FT-IR光谱仪进行红外光谱测定。所有光谱利用ATR方法记录,并在相同分辨率4.0 cm-1,扫描6次收集红外光谱。采用仪器自带软件采集数据,Origin8.0对数据进行分析。
2 结果与讨论
2.1EPS与DCF结合机制
三维荧光用于分析EPS与DCF间的作用机制。所用活性污泥每g VSS(可挥发性悬浮物)中EPS含量为124.0 mg/g。图1为活性污泥EPS与DCF作用前后的三维荧光谱图。从图1中可以看出DCF本身并没有荧光吸收峰,而活性污泥EPS有3个荧光吸收峰,分别为峰A(Ex/Em=230 nm/300 nm)、峰B(Ex/Em=240 nm/350 nm)和峰C(Ex/Em=270 nm/370 nm)。峰A位于Ⅰ区(含芳环基团的类蛋白物质Ⅰ),峰B位于Ⅱ区(含芳环基团的蛋白质Ⅱ区)。峰C位于Ⅳ区(溶解性微生物副产物)[11]。峰A、峰B和峰C都属于类蛋白峰,与EPS中的芳环氨基酸结构有关。由图1可知,EPS的荧光强度随着DCF浓度的增加不断降低。当DCF浓度达到25 mg/L时,峰C消失,峰A和峰B的位置发生了明显的红移。EPS荧光强度的降低和荧光峰位置的变化表明,活性污泥EPS中的类蛋白物质和DCF发生了作用,EPS本身结构发生了变化。
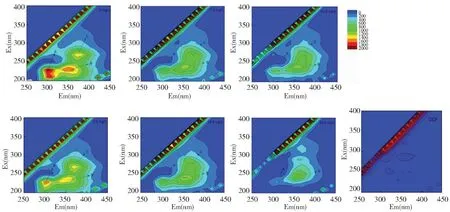
图1 EPS-DCF体系的三维荧光光谱图Fig.1 EEM fluorescence spectra of EPS -DCF system
荧光猝灭可以反映EPS本身结构的变化。通常引起荧光猝灭的机制分为静态猝灭和动态猝灭。为了研究EPS与DCF的荧光猝灭机制,使用Stern-Volmer方程[12]对猝灭机制进行分析:
(1)
式中F0和F分别为DCF加入前后EPS所测得的荧光强度;KSV为猝灭常数;kq为生物分子猝灭速率常数;τ为分子的荧光寿命,通常对于生物大分子τ值为1.0×10-8s;c为加入DCF浓度。

图2 EPS-DCF体系的Stern-Volmer曲线Fig.2 Stern-Volmer plots of EPS -DCF system
基于静态猝灭的机理,利用修正的Stern-Volme方程[13]和Ryan-Weber非线性模型[14]对EPS与DCF作用强度(即结合常数)进行计算。修正的Stern-Volmer方程:
(2)
式中f是滴定前后荧光的变化值占初始荧光强度的比例,K为结合常数。
Ryan-Weber非线性模型:
(3)
式中假设未加入DCF时EPS的荧光强度为100。F是EPS与对应浓度DCF结合后的荧光强度相对初始荧光强度的百分值;Fend为滴定达到理论终点时的荧光强度相对初始荧光强度的百分值。K为结合常数;c为加入DCF浓度;cL为EPS中配体L的总浓度。
表1 是修正的Stern-Volmer方程和Ryan-Weber非线性模型拟合出的不同峰的结合常数。两种模型拟合得到的结果表明:EPS中的类酪氨酸(A峰)结合DCF的强度要大于其它类蛋白峰。计算得到的结合常数虽小于金属离子与EPS的结合常数,但与有机污染物的结合常数相近[15]。基于EPS与DCF较高的结合强度,并能生成稳定的EPS-DCF络合物说明活性污泥中的EPS能够对污水生物处理过程中DCF的迁移和归趋产生影响。

表1 EPS-DCF体系的结合常数(lg K)值
2.2EPS结合DCF的结构变化
同步荧光是由Liody[16]提出的,包括固定激发和发射波长差,获得固定的Δλ。同步荧光不仅能保持高的灵敏度还有简化谱峰,减小峰宽及降低其它物质的干扰等优点。利用同步荧光光谱进一步探讨活性污泥中EPS与DCF结合后其自身结构的变化。通过测定EPS与DCF作用后最大发射波长的位移,可以研究EPS的结构变化。由于EPS主要是由类蛋白质组成,当Δλ为60 nm时,同步荧光可以得到色氨酸残基的特性。从图3可以看出,随着DCF浓度增加,EPS同步荧光光谱强度有规律的减弱,同时在340 nm处的同步荧光谱峰发生明显的红移,表明色氨酸残基周围极性增强。由于DCF进入蛋白中色氨酸残基位于的疏水区域,导致肽链伸展,从而使色氨酸暴露在水溶液中。色氨酸残基处于相对亲水的微环境中,使得同步荧光峰发生红移[17]。这一结果表明EPS官能团与DCF之间结合,改变了EPS自身的结构。

图3 EPS-DCF体系的同步荧光光谱 (Δλ=60 nm)Fig.3 Synchronous fluorescence spectra of EPS- DCF system (Δλ=60 nm)
图4显示了EPS结合DCF前后的红外光谱。分析结合之前的EPS红外谱图,存在强烈的蛋白和多糖吸收峰,较弱的羧酸类和酚类吸收峰。图中3800~3000 cm-1为EPS中蛋白和多糖的羟基伸缩振动[18],2360 cm-1左右为NH的伸缩振动。1650 cm-1和1540 cm-1的强烈吸收为蛋白中酰胺Ⅰ(主要是C=O伸缩振动)和酰胺Ⅱ(C-N伸缩振动和-N-H变形振动)[19]。与EPS相比,加入DCF后EPS红外谱图发生了微弱的变化,主要是EPS酰胺I峰从1650 cm-1移至1635 cm-1,2360 cm-1峰强增强。由此可见,DCF与EPS的结合使EPS的结构发生变化。其可能的原因DCF与EPS中的C=O和C-N或-N-H基团结合。

图4 EPS-DCF体系的红外谱图Fig.4 FT-IR spectra of EPS -DCF system
2.3环境因素对EPS-DCF结合强度的影响
2.3.1pH对EPS-DCF结合强度的影响
在反应体系中设定了3、4、5、6、7、8、9 不同的pH值,探讨了pH值对EPS-DCF体系荧光猝灭作用的影响,其结果如图5所示。可以看出,当pH值在3~5时,EPS荧光强度显著增强;当pH值在5-9时,EPS荧光强度趋于稳定。EPS-DCF体系与EPS的荧光强度随pH值的变化趋势一致,且在pH=8时达到最大。因此,选取对荧光强度影响较大的pH=8计算EPS-DCF结合强度。从表2中数据可知,在pH值为8时,两种模型拟合所得的lgK值与之前相比均有显著增大,说明EPS与DCF的结合作用增强。这可能是由于pH改变了体系中相关官能团如酚羟基和羧基的构型,从而导致了结合作用的改变[20]。

图5 pH值对EPS和EPS-DCF体系荧光强度的影响Fig.5 Fluorescence emission intensity of EPS and EPS-DCFsystem at different pH
2.3.2离子强度对EPS-DCF结合强度的影响
电导率对EPS-DCF体系荧光猝灭作用的影响如图6所示。不同电导率情况下,反应体系的荧光强度没有显著差异。表明离子强度对EPS与EPS-DCF体系没有显著影响。为了进一步验证,选取电导率2800 μs/cm计算结合常数。从表2中数据可知,两种模型拟合得到的lg K值与之前数据无明显变化。
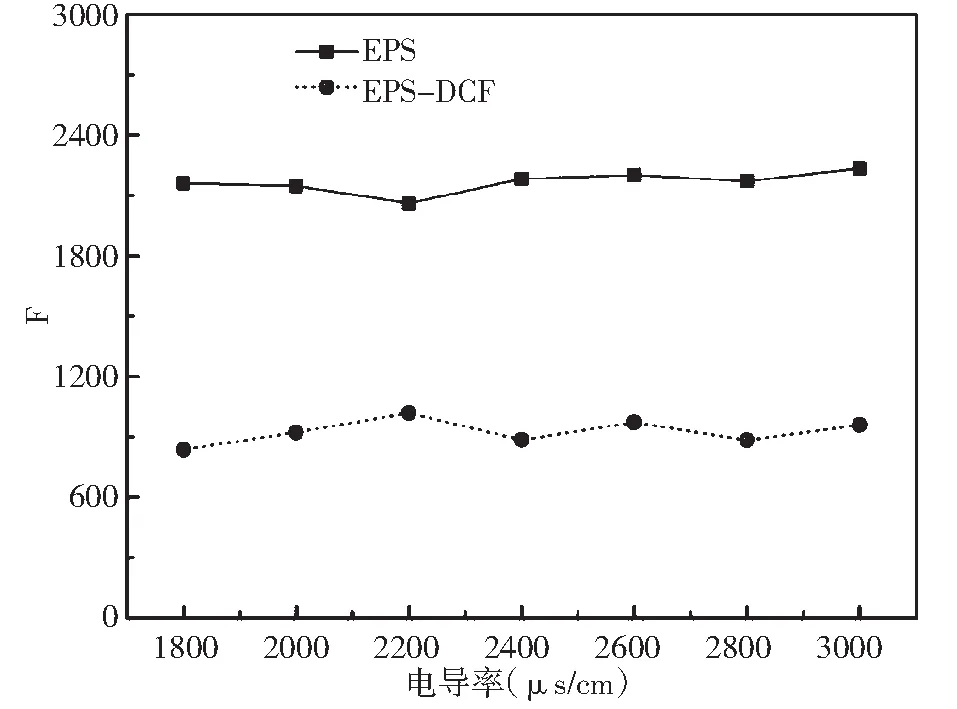
图6 电导率对EPS和EPS-DCF体系荧光强度的影响Fig.6 Fluorescence emission intensity of EPS and EPS-DCF system at different conductivity
2.3.3无机离子对EPS-DCF结合强度的影响
选取城市污水中检出率较高的3种金属离子Ca2+、Al3+、Fe3+,研究其对EPS-DCF反应体系荧光猝灭作用的影响,结果由表2所示。从中可知,两种模型下3种金属离子的存在均使lgK值稍有改变。其中峰C的结合常数与之前相比变化最为显著,且结合常数均增大,表明金属离子在一定程度上能促进EPS与DCF的结合。

表2 环境因素对EPS-DCF体系结合常数影响
3 结 论
利用多种分析方法研究了活性污泥中EPS与双氯芬酸DCF的相互作用机制。通过修正的Stern-Volmer方程和Ryan-Weber非线性模型拟合EPS-DCF体系的荧光数据得到的结合常数值表明EPS与DCF间存在较强的结合作用。这一结果说明水相中的DCF能够被活性污泥分泌的EPS有效的富集。同步荧光光谱和红外光谱分析结果表明两者结合后,EPS蛋白组成结构发生改变。同时,研究不同环境条件对体系结合强度的影响发现,pH的增加能够使EPS-DCF体系结合作用增强,金属离子在一定程度上能促进EPS与DCF的结合作用,而电导率对EPS-DCF体系的影响不大。
[1]Cuklev F, et al. Diclofenac in fish: blood plasma levels similar to human therapeutic levels affect global hepatic gene expression [J]. Environmental Toxicology and Chemistry, 2011, 30(9): 2126-2134.
[2]Heberer T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data [J]. Toxicology letters, 2002, 131(1): 5-17.
[3]Zhang Y, et al. Carbamazepine and diclofenac: removal in wastewater treatment plants and occurrence in water bodies [J]. Chemosphere, 2008, 73(8): 1151-1161.
[4]Sui Q, et al. Seasonal variation in the occurrence and removal of pharmaceuticals and personal care products in different biological wastewater treatment processes [J]. Environmental science & technology, 2011, 45(8): 3341-3348.
[5]Wang L, et al. Occurrence and risk assessment of acidic pharmaceuticals in the Yellow River, Hai River and Liao River of north China [J]. Science of the Total Environment, 2010, 408(16): 3139-3147.
[6]Zhao J L, et al. Occurrence and a screening‐level risk assessment of human pharmaceuticals in the Pearl River system, South China [J]. Environmental Toxicology and Chemistry, 2010, 29(6): 1377-1384.
[7]Lindberg R H, et al. Screening of human antibiotic substances and determination of weekly mass flows in five sewage treatment plants in Sweden [J]. Environmental science & technology, 2005, 39(10): 3421-3429.
[8]Sheng G P, et al. Characterization of adsorption properties of extracellular polymeric substances (EPS) extracted from sludge [J]. Colloids and Surfaces B: Biointerfaces, 2008, 62(1): 83-90.
[9]Dubois M, et al. Colorimetric Method for Determination of Sugars and Related Substances [J]. Anal Chem, 1956, 28(3): 350-356.
[10]Lowry O C. Protein measurement with the Folin phenol reagent [J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[11]魏群山, 等. 天然水体溶解性有机物(DOM)分级组分对典型城市源污染的荧光响应 [J]. 环境科学研究, 2010, (10): 1229-1235.
[12]Fang F, et al. A spectrofluorimetric study of the binding of carbofuran, carbaryl, and aldicarb with dissolved organic matter [J]. Analytica chimica acta, 1998, 373(2): 139-151.
[13]冯启言, 等. 煤矿区废水中溶解性有机质与铜的结合特性 [J]. 中国环境科学, 2013, 33(8): 1433-1441.
[14]Wu F, et al. Fluorescence quenching of fulvic acids by fullerene in water [J]. Environmental Pollution, 2013, 172:100-107.
[15]X P, et al. Binding of phenanthrene to extracellular polymeric substances (EPS) from aerobic activated sludge: a fluorescence study [J]. Colloids Surf B Biointerfaces, 2010, 80(1): 103-106.
[16]Lloyd J B F. Synchronized Excitation of Fluorescence Emission Spectra [J]. Nature, 1971, 20: 64.
[17]Bi S, et al. Investigation of three flavonoids binding to bovine serum albumin using molecular fluorescence technique [J]. Journal of Luminescence, 2012, 132(1): 132-140.
[18]Guibaud G, et al. Comparison of the complexation potential of extracellular polymeric substances (EPS), extracted from activated sludges and produced by pure bacteria strains, for cadmium, lead and nickel [J]. Chemosphere, 2005, 59(5): 629-638.
[19]Al-qadiri H M, et al. Rapid detection and identification of Pseudomonas aeruginosa and Escherichia coli as pure and mixed cultures in bottled drinking water using Fourier transform infrared spectroscopy and multivariate analysis [J]. Journal of agricultural and food chemistry, 2006, 54(16): 5749-5754.
[20]梅毅, 等. 运用3DEEMs及荧光偏振方法研究pH,离子强度及浓度效应对腐殖酸荧光光谱特性的影响 [J]. 地球化学, 2008, 37(2): 165-173.
Interaction between Diclofenac and Extracellular Polymeric Substance Extracted from Sludge
BAO Yi-jun, YANG Cun-man, LI Yin, LU Guang-hua
(KeylaboratoryofIntegratedRegulation&ResourcesDevelopmentofShallowLakesofMinistryofEducation,CollegeofEnvironment,HohaiUniversity,Nanjing, 210098,China)
In this study, three-dimensional fluorescence spectrometry and infrared spectroscopy were used to identify the interactions between extracellular polymeric substance (EPS) and diclofenac (DCF). Effects of pH, conductivity and different ions on the binding strength between EPS and DCF were investigated. The results showed that the 3D fluorescence signal peaks of EPS could be quenched by the addition of DCF. The binding constants (lgK) of EPS were 3.28~4.90. Infrared and Synchronous fluorescence spectra indicated the structure of EPS had been changed by DCF. Under different environmental conditions, the complexation could be enhanced by pH, it helps to remove DCF during wastewater treatment process. However, the influence of conductivity and different ions on the system is not obvious.
EPS; diclofenac; three-dimensional fluorescence spectrum; binding
2015-05-11
国家自然科学基金(51209068,51479067);江苏高校优势学科建设工程资助项目。
包宜俊(1991-),男,江苏镇江人,河海大学环境科学与工程专业2013级在读硕士研究生,主要从事环境污染化学研究。
李颖,hj6688@hhu.edu.cn。
X703
A
1001-3644(2015)06-0023-06
