有氧运动对心肌梗死大鼠心脏交感神经重构的影响
2015-08-14邵承颖等
邵承颖等
摘 要:目的:探讨8周有氧运动对心肌梗死大鼠心脏交感重构的影响及其机制。方法:42只健康雄性SD大鼠随机分为假手术组、心肌梗死组、心肌梗死+有氧运动组。结扎冠状动脉左前降支制备大鼠心肌梗死的模型,术后1周心肌梗死+有氧运动组成活大鼠进行8周跑台运动。采用免疫组织化学方法观察心肌中GAP43、TH阳性神经纤维分布及表达;采用western blot检测心肌中NGF蛋白表达;采用实时定量RT-PCR检测IL-1β及TNF-α mRNA表达。结果:与假手术组大鼠相比,心肌梗死组心肌中GAP43、TH阳性神经纤维密度明显增加(P<0.01),形态粗大且空间分布紊乱;NGF蛋白,IL-1β及TNF-α mRNA表达显著上调。有氧运动干预后心肌组织神经纤维密度明显降低(P<0.01),形态更趋于正常;心肌中NGF、IL-1β及TNF-α表达显著下降。结论:有氧运动减少心肌梗死后心肌局部炎症反应,下调梗死灶周组织NGF表达,抑制交感神经过度再生,从而改善心肌梗死后交感神经重构。
关键词:有氧运动;心肌梗死;神经重构;炎症
中图分类号:G804.2 文献标识码:A 文章编号:1006-2076(2015)03-0073-05
Abstract:Objective:To investigate the role of aerobic exercise in ameliorating sympathetic sprouting after myocardial infarction (MI) in rat hearts.Methods: 42 male Sprague-Dawley rats were randomly divided into three groups: sham group, MI and MI with aerobic exercise (MI+ME) group. An MI model was induced by ligation of the coronary artery; the rats in MI+ME group were assigned to 8 weeks of exercise. Immunohistochemistry was used to measure the density of nerve fibers positive for growth-associated protein 43 (GAP43) and tyrosine hydroxylase (TH). The protein levels of nerve growth factor (NGF) were detected by western blot analysis. The mRNA levels of interleukin-1β (IL-1β) and tumor necrosis factor-α (TNF-α) were examined by quantitative real-time PCR.Results:Compared with the sham-operated hearts, MI increased the density of[HK][HT]
1 材料与方法
1.1 实验材料
健康成年雄性SD大鼠42 只,体重250-280g(购自山东大学实验动物中心)。Trizol试剂盒购于美国Invitrogen公司;Real-time RT-PCR试剂盒购于大连宝生物工程公司,引物由上海生工生物工程公司设计并合成;抗酪氨酸羟化酶(TH)抗体购于美国Millipore公司,抗生长相关蛋白43(GAP43)抗体购于英国Abcam公司,辣根过氧化物酶标记兔抗绵羊二抗购于美国PKL公司,抗NGF抗体购于美国Epitomics公司,抗GAPDH抗体购于北京康为世纪生物科技有限公司。其余试剂均为国产分析纯。
1.2 实验方法
1.2.1 心肌梗死模型制备
SD大鼠随机分为假手术组、单纯心肌梗死组(心肌梗死组)以及心肌梗死+有氧运动组(有氧运动组),每组14只。利用结扎冠状动脉左前降支的方法制备大鼠心肌梗死的模型[7],所有动物用10% 水合氯醛溶液0.3 mL/100g腹腔注射麻醉,气管插管,小动物呼吸机通气。于大鼠胸骨左侧3-4肋间开胸,结扎左前降支,以心电图aVL导联ST段抬高 0.2 mV作为手术成功标志,随后逐层关胸。假手术组大鼠作为对照,只开胸穿线,不结扎。
有氧运动组大鼠手术恢复1周后参照Kemi OJ[8]的运动方案进行训练:动物跑台运动速度为15 m/min,大鼠进行适应运动10 min;将跑台运动速度增至20 m/min,持续运动50 min。大鼠运动60 min/d,5次/周,共计8周。假手术组及心肌梗死组正常笼内喂养不运动。
1.2.2 心肌标本处理
实验大鼠8周有氧运动干预后,所有成活大鼠再次麻醉并迅速取下心脏,经主动脉灌注生理盐水清除残存血液。取梗死灶周(梗死苍白边缘3 mm以内)心肌组织,假手术组取相应部分心肌组织,分别存放于中性甲醛及液氮中保存。
1.2.3 GAP43、TH阳性神经纤维密度测定
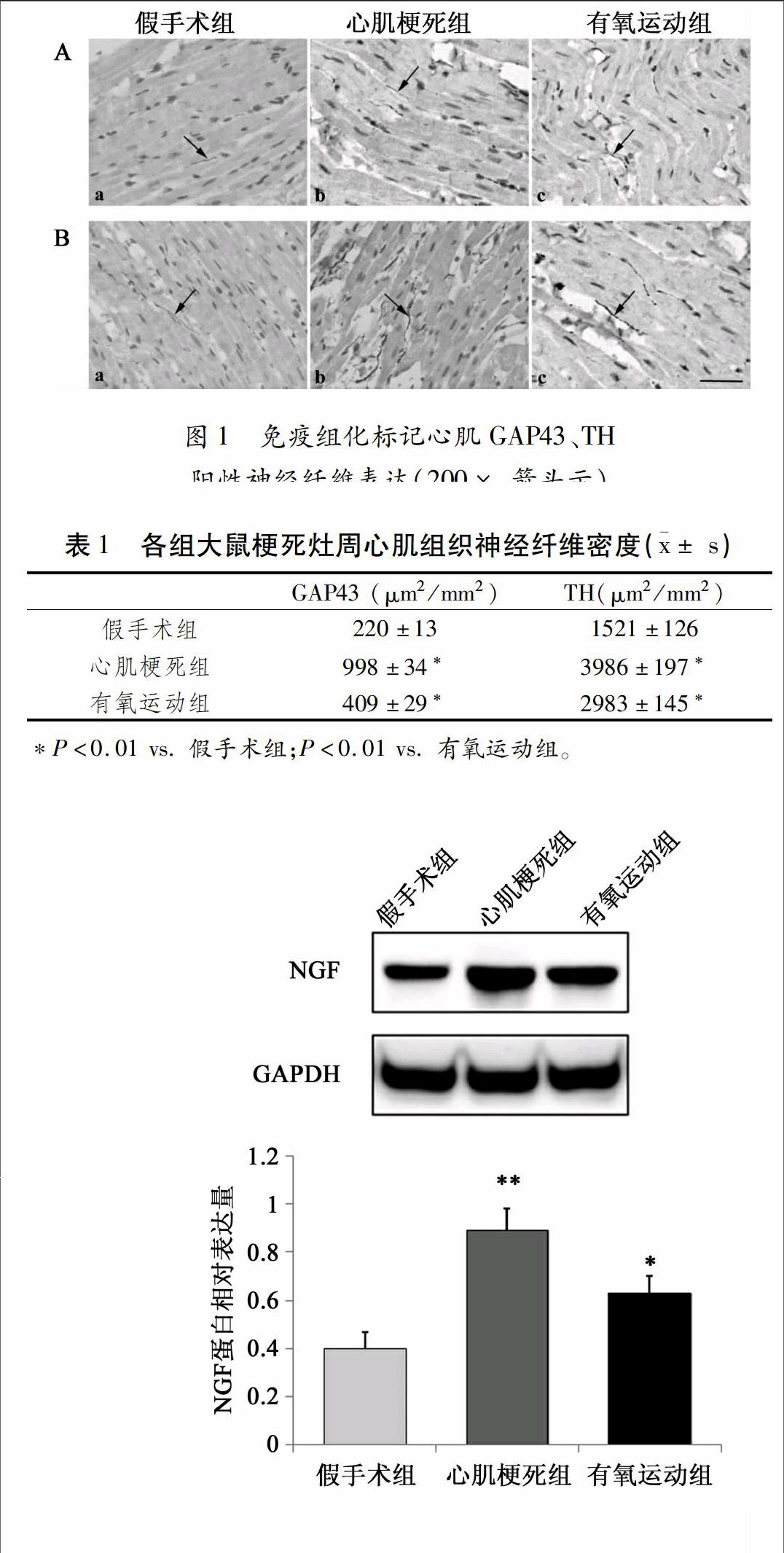
取甲醛固定后的心肌组织,石蜡包埋,切片,片厚4 μm,常规脱蜡、高压修复后加一抗4℃过夜,二抗37℃孵育30 min,DAB显色,复染后封片。参照Cao等[9]的方法,选取神经分布较为密集的区域对神经纤维密度进行分析:采用Image Pro Plus5图像处理分析软件定量分析GAP43及TH阳性神经纤维在所选区域中所占面积(以μm2/mm2表示),取其平均值作为阳性神经纤维密度值。
1.2.4 心肌中NGF蛋白表达
将心肌组织切成细小碎片,每100 mg 组织加1 mL心肌组织裂解液冰上匀浆,提取蛋白。用12%分离胶、5%浓缩胶100 V电泳60 min,160 V恒压电转60 min,5%脱脂奶粉封闭2 h后加一抗(1[JX-*4]:[JX*4]500),4°C过夜,辣根过氧化物酶标记的二抗(1[JX-*4]:[JX*4]10000)室温孵育1 h。ECL发光液显影,Image J图像处理软件,以内参GAPDH蛋白条带光密度值为标准,计算目的蛋白相对表达量。
1.2.5 IL-1β及TNF-α mRNA表达
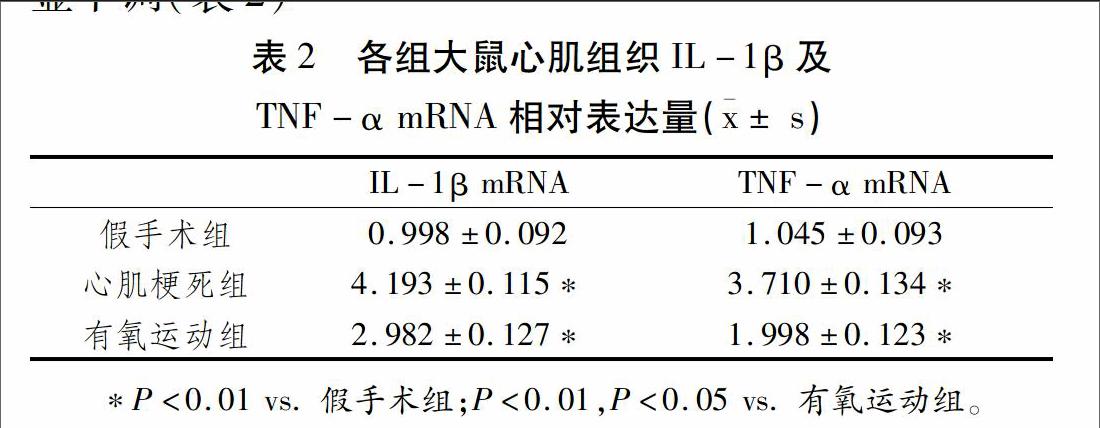
[JP3]根据Trizol试剂盒提供的方法提取心肌组织总mRNA。按照real-time RT-PCR试剂盒的方法进行逆转录及扩增。引物序列:IL-1β,上游 5-AGT GGC AAT GAA AAT GAC CTG-3,下游 5-CAC AAC GAC TGA CAA GAC CTG-3;TNF-α,上游5-CTG CCT CAG CCT CTT CTC TTT-3,下游 5-CAC TTG CGG GTT TGC TAC TAC-3;GAPDH,上游5-ACA GCA ACA GGG TGG TGG AC-3,下游5-TTT GAG GGT GCA GCG AAC TT-3。GAPDH作为内参,采用2-△△CT法计算目的基因相对表达量。[JP]
1.2.6 统计学分析
所有数据均采用SPSS17.0统计软件进行统计学分析。数据以均数±标准差([AKx-]±s)表示,多组间比较采用单因素方差分析,然后采用最小显著差异法进行组间两两比较。P<0.05为统计学差异具有显著性。
2 结果
2.1 动物一般情况
结扎大鼠冠状动脉前降支后数分钟后可发现结扎动脉供血区域心肌颜色呈暗红色,搏动减弱,与非梗死区分界明显。8周有氧运动结束后,假手术组无死亡,共14例大鼠完成实验;心肌梗死组有4例死亡,共10例大鼠完成实验;有氧运动组有2例死亡,共12例大鼠完成实验。
2.2 心肌中GAP43、TH阳性神经纤维分布及表达
假手术组GAP43阳性神经纤维少见或缺如,呈点状分布;心肌梗死组梗死灶周处心肌中GAP43阳性神经纤维密度明显增加,分布密集且形态粗大;与心肌梗死组相比,有氧运动组心肌组织的GAP43阳性神经纤维密度明显减少(P<0.01),分布较为稀疏(图1A,表1)。
假手术组TH阳性神经纤维在心肌组织中均匀分布,沿心肌纤维纵行分布;心肌梗死组TH阳性神经纤维密度明显增加,空间分布紊乱,形态异常,部分聚集成束,偶可相互交错呈网状;与心肌梗死组相比,有氧运动组TH阳性神经纤维密度明显降低(P<0.01),且形态更趋于正常化,未发现粗大、密集的神经纤维束。(图1B,表1)。
3 讨论
正常生理情况下,交感神经以其“固有”形式分布于心脏,但在某些心脏病变情况下,其支配形式也会发生改变,继而引起功能学的改变。心肌缺血可引起心脏去神经支配、神经再生、交感神经过度支配,即交感神经重构这一系列动态改变。这种心脏交感神经的异常支配加重了MI后心肌的电生理异质性及不稳定性,进而导致室性心律失常易感性增加[9]。在本实验中,我们选取GAP43及TH作为神经标记物研究MI后交感神经再生现象。与既往研究结果一致[9-10],我们的研究发现,心肌梗死灶周GAP43及TH阳性神经纤维密度明显增加,且空间分布紊乱,形态异常,部分聚集成束,偶可相互交错呈网状。该结果进一步证实MI可导致梗死灶周组织不同程度的交感神经再生及紊乱的交感神经支配,即交感神经重构。
NGF,作为神经营养因子家族的代表,对交感神经的生长、延伸、突触功能调控都有重要作用。NGF与靶细胞上TrkA或p75NTR受体结合,启动下游MAPK/ERK通路,进而促进交感神经生长及轴突延伸[11]。多项研究证实,MI后心肌局部NGF表达明显上调,且NGF在时间-空间的动态表达变化与交感神经密度呈正相关[3,10,12]。随着研究的进一步深入,炎症反应与交感神经再生的关系逐渐引起科研人员的关注。梗死心肌组织周围的巨噬细胞可合成并分泌大量NGF[3-4];此外,IL-1β、TNF-α等炎症因子也可通过多种途径上调NGF及其受体p75NTR的表达[13],从而促进交感神经轴突延伸、生长,并导致交感神经过度增生及重构。在本实验中,我们选取IL-1β、TNF-α作为炎症指标,发现心肌梗死后心肌中IL-1β、TNF-α相应的mRNA表达均有不同程度的上调,同时NGF含量也显著增加,我们的结果进一步证实MI后NGF表达与炎症反应密切相关,炎症反应的程度直接影响着心肌梗死后心脏交感神经重构的过程。
近年来,有氧运动被认为是多种心血管疾病的有效治疗及康复手段。业已证实,MI早期适宜强度的有氧运动可通过逆转心肌重构[14]、增加每搏输出量及射血分数[15]、改善左室收缩功能[16]等发挥心脏保护作用。此外,一系列临床研究表明,长期有氧运动可降低心脏交感神经张力,从而减少室性心律失常的发生[17-18];Hautala等[19]在校正受试者年龄、训练时间等因素后发现,每周进行3次30 min预计最大心率60%至80%强度范围的有氧运动,并持续四周以上,可显著增强心脏迷走神经张力。但目前关于有氧运动调节心脏自主神经支配平衡的机制尚无分子学方面的合理解释。Adamopoulos等[20]的研究表明,有氧运动可减少心衰患者外周血液中的炎症因子的表达,且有氧运动对心脏的保护作用与其抗炎作用密切相关。因此,在本实验中,我们将“有氧运动—炎症—NGF—神经再生”为研究主线,结果显示,8周有氧运动可显著下调心肌中IL-1β、TNF-α的水平,降低心肌中NGF表达并有效改善MI后心脏交感神经再生及重构。因此,我们认为,有氧运动可通过减轻心肌局部炎症反应以抑制心脏交感神经过度再生,这也可能是有氧运动降低交感神经张力、增强迷走神经张力的可能机制之一。此外,有研究证实,迷走神经兴奋释放的乙酰胆碱可作用于诸多炎症细胞上的α7烟碱型乙酰胆碱受体,激活JAK2/STAT3通路,抑制促炎因子释放,从而发挥“迷走神经抗炎作用”[21]。在本实验中我们尚无法明确有氧运动是直接抑制炎症反应,抑或通过兴奋迷走神经间接抑制炎症反应,但我们的研究已初步证实有氧运动可通过减轻MI后心脏炎症反应,从而改善心肌梗死后交感神经重构,该研究结果也为有氧运动对心肌梗死后心源性猝死的有效防治提供了理论依据。
4 结论
8周有氧运动可减轻心肌梗死后心肌局部炎症反应,下调梗死灶周组织NGF表达,抑制交感神经过度再生,从而改善心肌梗死后交感神经重构。
参考文献:
[1]Myerburg RJ, Junttila MJ: Sudden cardiac death caused by coronary heart disease [J]. Circulation,2012,125:1043-1052.
[2] Mahmoud KD, de Smet BJ, Zijlstra F, Rihal CS, Holmes DR, Jr.: Sudden cardiac death: Epidemiology, circadian variation, and triggers [J]. Curr Probl Cardiol,2011,36:56-80.
[3]Hasan W, Jama A, Donohue T, Wernli G, Onyszchuk G, Al-Hafez B, Bilgen M, Smith PG: Sympathetic hyperinnervation and inflammatory cell ngf synthesis following myocardial infarction in rats[J]. Brain Res,2006,1124:142-154.
[4]Wernli G, Hasan W, Bhattacherjee A, van Rooijen N, Smith PG: Macrophage depletion suppresses sympathetic hyperinnervation following myocardial infarction[J]. Basic research in cardiology,2009,104:681-693.
[5]Gleeson M, Bishop NC, Stensel DJ, Lindley MR, Mastana SS, Nimmo MA: The anti-inflammatory effects of exercise: Mechanisms and implications for the prevention and treatment of disease [J]. Nature reviews Immunology,2011,11:607-615.
[6]Mathur N, Pedersen BK: Exercise as a mean to control low-grade systemic inflammation[J]. Mediators Inflamm,2008,109502.
[7]El-Helou V, Proulx C, Gosselin H, Clement R, Mimee A, Villeneuve L, Calderone A: Dexamethasone treatment of post-mi rats attenuates sympathetic innervation of the infarct region[J]. Journal of applied physiology,2008,104:150-156.
[8]Kemi OJ, Haram PM, Loennechen JP, Osnes JB, Skomedal T, Wisloff U, Ellingsen O: Moderate vs. High exercise intensity: Differential effects on aerobic fitness, cardiomyocyte contractility, and endothelial function[J]. Cardiovascular research,2005,67:161-172.
[9]Cao JM, Fishbein MC, Han JB, Lai WW, Lai AC, Wu TJ, Czer L, Wolf PL, Denton TA, Shintaku IP, Chen PS, Chen LS: Relationship between regional cardiac hyperinnervation and ventricular arrhythmia[J]. Circulation,2000,101:1960-1969.
[10]Oh YS, Jong AY, Kim DT, Li H, Wang C, Zemljic-Harpf A, Ross RS, Fishbein MC, Chen PS, Chen LS: Spatial distribution of nerve sprouting after myocardial infarction in mice[J]. Heart Rhythm,2006,3:728-736.
[11]Kimura K, Ieda M, Fukuda K: Development, maturation, and transdifferentiation of cardiac sympathetic nerves[J]. Circulation research,2012,110:325-336.
[12]Zhou S, Chen LS, Miyauchi Y, Miyauchi M, Kar S, Kangavari S, Fishbein MC, Sharifi B, Chen PS: Mechanisms of cardiac nerve sprouting after myocardial infarction in dogs[J]. Circulation research,2004,95:76-83.
[13]Blasing H, Hendrix S, Paus R: Pro-inflammatory cytokines upregulate the skin immunoreactivity for ngf, nt3, nt4 and their receptor, p75ntr in vivo: A preliminary report[J]. Arch Dermatol Res,2005,296:580-584.
[14]Kraljevic J, Marinovic J, Pravdic D, Zubin P, Dujic Z, Wisloff U, Ljubkovic M: Aerobic interval training attenuates remodelling and mitochondrial dysfunction in the post-infarction failing rat heart[J]. Cardiovascular research,2013,99:55-64.
[15]Marshall KD, Muller BN, Krenz M, Hanft LM, McDonald KS, Dellsperger KC, Emter CA: Heart failure with preserved ejection fraction: Chronic low-intensity interval exercise training preserves myocardial o2 balance and diastolic function[J].J Appl Physiol (1985),2013,114:131-147.
[16]Giallauria F, Acampa W, Ricci F, Vitelli A, Torella G, Lucci R, Del Prete G, Zampella E, Assante R, Rengo G, Leosco D, Cuocolo A, Vigorito C: Exercise training early after acute myocardial infarction reduces stress-induced hypoperfusion and improves left ventricular function[J]. Eur J Nucl Med Mol Imaging,2013,40:315-324.
[17]Martinez DG, Nicolau JC, Lage RL, Toschi-Dias E, de Matos LD, Alves MJ, Trombetta IC, Dias da Silva VJ, Middlekauff HR, Negrao CE, Rondon MU: Effects of long-term exercise training on autonomic control in myocardial infarction patients[J]. Hypertension,2011,58:1049-1056.
[18]Ribeiro F, Alves AJ, Teixeira M, Miranda F, Azevedo C, Duarte JA, Oliveira J: Exercise training enhances autonomic function after acute myocardial infarction: A randomized controlled study[J].Portuguese journal of cardiology : an official journal of the Portuguese Society of Cardiology,2012,31:135-141.
[19]Hautala AJ, Makikallio TH, Kiviniemi A, Laukkanen RT, Nissila S, Huikuri HV, Tulppo MP: Cardiovascular autonomic function correlates with the response to aerobic training in healthy sedentary subjects[J]. American journal of physiology,2003,285:H1747-1752.
[20]Adamopoulos S, Parissis J, Kroupis C, Georgiadis M, Karatzas D, Karavolias G, Koniavitou K, Coats AJ, Kremastinos DT: Physical training reduces peripheral markers of inflammation in patients with chronic heart failure[J]. European heart journal,2001,22:791-797.
[21] [JP3]Pavlov VA, Tracey KJ: The cholinergic anti-inflammatory pathway[J]. Brain, behavior, and immunity,2005,19:493-499.
