奶粉中残留兽药的QuEChERS方法应用研究
2015-08-10宓捷波许迪明李淑静林安清许泓
宓捷波,许迪明,李淑静,林安清,许泓
(1.天津出入境检验检疫局动植物与食品检测中心,天津300461;2.宁波出入境检验检疫局,浙江宁波315000)
奶粉中残留兽药的QuEChERS方法应用研究
宓捷波1,许迪明2,李淑静1,林安清1,许泓1
(1.天津出入境检验检疫局动植物与食品检测中心,天津300461;2.宁波出入境检验检疫局,浙江宁波315000)
通过萃取溶剂和盐析剂等优化,改进了QuEChERS技术。建立了奶粉中22种兽药残留检测的简捷、快速、特异性的QuEChERS-超高效液相色谱-串联质谱分析方法。该方法通过EDTA和缓冲体系优化了磺胺、喹诺酮和四环素类药物的萃取检测过程,使磺胺、喹诺酮和四环素的检测低限达到1、5 μg/kg和50 μg/kg,添加回收率为70%~102%,RSD小于15%。
QuEChERS;奶粉;兽药残留
自三聚氰胺事件以来,我国对奶粉及相关奶制品的检测的严格程度达到了前所未有的高度,仅牛奶和奶粉相关的国家标准就制定发布了31项之多,范围涉及近百种兽药,为保障奶粉类食品的安全提供了完备的检测依据。然而,面对近百种的在用兽药,大量的奶制品需要做兽药残留分析,检验任务既繁重又时间紧迫。而上述31项关于牛奶和奶粉中残留检测的国家标准,基本上都采用了目前较为流行的前处理模式,即溶剂提取+固相萃取(SPE)柱净化,这一模式相对于原先的液液萃取而言,可以避免乳化,较为快速,但在具体操作过程中,由于奶粉含有较多的脂肪和蛋白质,SPE柱的净化过程通常需要加压或负压方式进行,速度受到极大的限制。尤其在样品量较多的情况下,整个前处理过程就会变得十分冗长。因此加强样品前处理技术的研究,提高对食品样品中残留兽药的提取效率,在保证检测精度的基础上减少前处理的操作步骤,发展快速、高效、灵敏、简捷的兽药残留检测方法对于保障国家的食品安全、环境质量、人体健康具有重大意义。
QuEChERS是基于分散固相萃取建立起来的一种多残留快速(Quick)、简单(Easy)、便宜(Cheap)、高效(Effective)、耐用(Rugged)和安全(Safe)的分析方法。自2003年提出以来[1],QuEChERS方法已在全球获得了广泛的应用。尤其在农药残留检测上取得了极大的成功,在蔬果已可以实现近百种的多残留检测,如Banerjee K等[2]在葡萄基质中对82种农药进行了萃取;Cajka T等[3]则在蔬果中对100种农药实现萃取。近年来经过一些改进,也可用于谷物、坚果、土壤、蜂蜜等样品[4-8],但基本局限于农药的提取,对于食品样品中残留的兽药的QuECHERS萃取研究很少[9-10],并且在动物源性食品中的应用也很少。本研究以奶粉为研究基质,对现有的QuEChERS方法的提取环境和萃取剂等进行研究改进,建立适合于奶制品中多类兽药残留检测的快速方法。
1 材料与方法
1.1 仪器
超高效色谱-质谱/质谱仪Agilent1290-API4000+(Agilent公司/AB SCiex公司,美国),配备RRHD E-clipse Plus C18色谱柱;离心机Avanti J-26 XPI(贝克曼公司,美国),氮吹仪N-EVAP112(Organomation Associates公司,美国)。
1.2 试剂
磺胺恶喹啉、磺胺苯吡唑、磺胺多辛,磺胺二甲异恶唑、磺胺甲噻二唑、磺胺甲氧哒嗪、磺胺噻唑、磺胺嘧啶、磺胺二甲基嘧啶、西诺沙星、丹诺沙星、洛美沙星、氟罗沙星、恩诺沙星、环丙沙星、氧氟沙星、诺氟沙星、培氟沙星标准品以及13C6-磺胺二甲嘧啶、D5-诺氟沙星均购自Dr.Ehrenstorfer GmbH公司(德国)。伯仲胺(PSA)、氨基(NH2)和强阴离子交换(SAX)吸附材料均购自安捷伦公司(美国)乙腈、冰乙酸和甲酸均为色谱纯(Merck公司,德国),无水硫酸镁、无水硫酸钠、乙酸钠和乙二胺四乙酸(EDTA)均为分析纯,实验用水为去离子水。
1.3 方法
1.3.1 QuEChERS萃取
称取1 g奶粉样品于50 mL离心管中,加入10 mL水溶解,混合均匀后加入10 mL 1%乙酸乙腈和10 mL 0.1 mol/L EDTA溶液,振摇1 min,加入8 g无水硫酸钠和1 g乙酸钠,振摇充分,3 500 r/min离心5 min,取上清过无水硫酸钠层于15 mL离心管中,40℃氮气吹干,用1 mL0.1%甲酸水/乙腈(9∶1)溶解,过0.22 μm尼龙滤膜,进行液相色谱串联质谱检测。
1.3.2 测定
线条表面平滑而呈黑色,这种腹中线没有腹壁断裂,只是体质原因导致黑色素沉积而已,并非孕妇特有,未孕育人群也可发生。
1.3.2.1 超高压液相色谱条件
Eclipse Plus C18色谱柱(2.1×50 mm;1.8 μm),流速0.5 mL/min,进样量5 μL,流动相A为0.1%甲酸的水,流动相B为乙腈,采用梯度洗脱程序如表1。

表1 液相色谱的梯度洗脱程序Table 1The gradient elution program of LC
1.3.2.2 质谱条件
ESI+模式,碰撞气流量(CAD):12L/h,气帘气(CUV):2.06×105Pa;辅助气1:4.83×105Pa;辅助气2:4.48× 105Pa;喷雾电压(IS):5500V;离子源温度(TEM):600℃。采用多反应检测(MRM,multiple reaction monitoring),每种兽药选择两对离子对进行检测,其中一对为定量离子,另一对为定性离子,具体如表2所示。

表2 22种兽药的保留时间、监测离子对(*定量离子)以及质谱参数Table 2Retention time,monitor ion pairs and MS conditions of twety two drugs(*quantification ions)
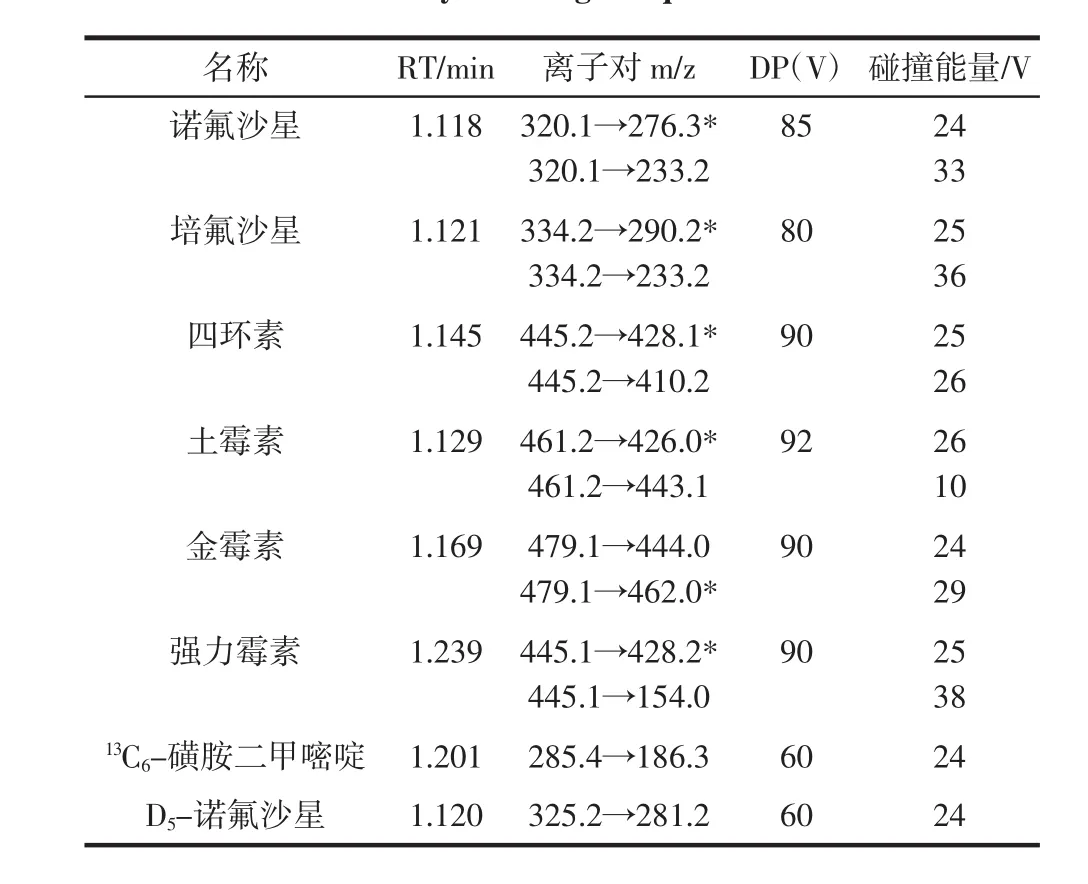
续表2 22种兽药的保留时间、监测离子对(*定量离子)以及质谱参数Continue table 2Retention time,monitor ion pairs and MS conditions of twety two drugs(*quantification ions)
1.3.2.3 UPLC-MS/MS测定
根据22种兽药的类别,磺胺类药物和喹诺酮类药物分别以13C6-磺胺二甲嘧啶和D5-诺氟沙星作为内标,以内标法定量,而四环素类药物则以空白基质稀释标准曲线进行外标法定量。
2 结果与分析
2.1 EDTA的选择
2.2 缓冲液的选择
在国内外的文献研究[12-13]中,QuEChERS的提取过程中也常常使用缓冲体系确保某些对pH敏感药物的提取效率。本研究所涉及的四类药物中,磺胺和喹诺酮都属于两性物质,在1%乙酸乙腈和乙酸钠构成的缓冲体系中均成离子状态,易于被乙腈萃取[11]。试验中我们比较了乙酸钠添加与否的情况,结果显示,在缓冲溶液的提取下,目标药物大都提取效率提高,如恩诺沙星,我们可以发现应用缓冲体系后,恩诺沙星的峰高相应提高了50%左右,故我们选择在提取溶液中添加乙酸钠,利用缓冲体系提高兽药在QuEChERS方法中的萃取率。
2.3 盐析试剂的选择
在QuEChERS过程中,盐析试剂的加入主要是为了去除有机相中的部分水分,改变水溶液的极性,促使目标物更多地从水相转移到有机相,同时利用无水硫酸镁吸水同时所产生的热量,促进某些药物的萃取[1]。由于无水硫酸镁的吸水性能在一系列盐类中是较高的,所以其一直是QuEChERS方法中常用的盐析剂。但由于本研究中四环素类药物易与Mg2+发生螯合反应,尽管EDTA溶液可以抑制反应的比例,但仍然有一部分四环素会与硫酸镁反应,所以本研究对无水硫酸镁和无水硫酸钠分别充当盐析剂进行了比较研究。图1显示了奶粉中四环素、土霉素、金霉素和强力霉素在不同盐析剂作用下的提取效果。

图1 奶粉中分别使用无水Na2SO4和无水Mg2SO4作为盐析剂时四环素类药物的峰强度比较Fig.1 The comparison of the peak intensity of tetracyclines using anhydrous Na2SO4and anhydrous Mg2SO4as salting-out agent respectively in the matrix of milk powder.
从图1可以发现,使用无水硫酸钠时四环素类药物的提取效率优于无水硫酸镁。但在溶液分层效果上,无水硫酸镁常常可以得到界面清晰的有机相层,而无水硫酸钠则有时出现乳化层。为了改变这种现象,我们每次实验前均对无水硫酸钠进行500℃~600℃烘烤16 h以上的处理,则乳化现象得到了有效的抑制。所以最终本研究的盐析试剂选择为无水硫酸钠。
2.4 净化材料的比较
在QuEChERS方法中,用PSA进行分散固相萃取(dSPE)净化主要是利用伯仲胺键的极性作用和阴离子交换作用去除来自基质的共萃物中的脂质和糖类等[1]。但由于奶粉和牛奶中基质成分与植物产品等有较大的区别,故试验中我们对多种不同的净化材料进行了比较。

图2 奶粉中添加5 ng/g典型兽药后采用不同净化材料进行QuEChERS提取的效果Fig.2 The effect of QuEChERS extraction of typical veterinary drugs at the concentration of 5 ng/g spiked in milk powder using different d-SPE materials
从图2中可以发现,除了酸性氧化铝净化时,回收率小于80%之外,其余吸附材料的净化效果与不使用吸附剂净化(no-dSPE)的区别不大,回收率均在80%~120%之间。这一结果说明在本研究所选择的检测方法——串联质谱法对于特异性检测而言十分有效,进一步的去杂净化对于质谱检测的结果并没有明显的影响,所以考虑到简化前处理步骤的需要,本研究不作d-SPE处理,直接氮吹、复溶、过膜检测。
2.5 标准曲线的测定以及检测低限的确定
以0.1%甲酸水/乙腈(9∶1)配制磺胺和喹诺酮的系列混合标准溶液,浓度分别为0、0.5、1.0、5.0、10.0、50.0、100.0 ng/mL,其中每个点的13C6-磺胺二甲嘧啶含量为50 ng/mL,D5-诺氟沙星的含量均为100 ng/mL。另外以空白奶粉和牛奶进行QuEChERS提取,制备基质提取溶液,并以该溶液配置四环素类药物的系列混合标准溶液,浓度分别为0、25.0、50.0、100.0、200.0、500.0 ng/mL。依次进行超高效液相色谱-串联质谱测定,计算标准曲线。结果显示标准曲线线性良好,相关系数均大于0.99。
根据标准溶液在仪器上的响应(3S/N)和样品中的基质效应以及目前国内外对上述兽药的残留限量,本研究将方法的定量限(LOQ)定为磺胺类药物为1μg/kg,喹诺酮类药物为5 μg/kg,四环素类药物为50 μg/kg。
2.6 添加回收实验
分别在脱脂奶粉和全脂奶粉中添加LOQ和5倍LOQ添加量的混合标准物质,即1.0、2.0μg/kg的9种磺胺标准,5.0、10.0μg/kg的9种喹诺酮和50.0、100.0μg/kg的四环素标准,按照上述优化结果进行QuEChERS提取检测。
在具体实验过程中,全脂奶粉的脂肪并未对实验操作造成明显的影响,只要无水硫酸钠经过500℃~600℃的预处理,液液分层的效果与脱脂奶粉并无差别。结果见表3。

表3 全脂奶粉和脱脂奶粉中添加LOQ及5×LOQ的混合标准溶液的回收Table 3 Recovery of mixed standard at the concentration of LOQ and 5xLOQ spiked in full cream milk powder and skimmed milk powder.

续表3 全脂奶粉和脱脂奶粉中添加LOQ及5×LOQ的混合标准溶液的回收Continuetable3 RecoveryofmixedstandardattheconcentrationofLOQand5×LOQspikedinfullcreammilkpowderandskimmedmilkpowder
当添加量为上述值时,22种兽药的回收率为71.05%~102.8%,RSD为3.69%~11.57%,满足分析要求(70%~110%,RSD<17%)。
3 结论
从上述实验结果可知,由经过优化的QuEChERS处理技术在脱脂奶粉和全脂奶粉中均可以较好地完成磺胺、喹诺酮以及四环素等3大类22种兽药的提取,其检测低限分别可达1 μg/kg(磺胺)、5 μg/kg(喹诺酮)和50 μg/kg(四环素),回收率及精密度均符合分析要求。与常规的QuEChERS方法相比,本研究所改进的方法增加了EDTA和缓冲体系的组合提取过程,扩展了QuEChERS方法所能适应的兽药种类,实现了不同类别兽药的多残留QuEChERS提取。并且,由于d-SPE步骤的省略,进一步简化了QuEChERS方法的操作步骤,使牛奶和奶粉中QuEChERS方法提取兽药的过程更加简捷,具有更大的应用性。
本研究验证了改进后的QuEChERS方法对奶制品中多类兽药的提取有效性,建立了奶粉中残留兽药(磺胺、喹诺酮和四环素)的QuEChERS提取-超高效液相色谱-串联质谱检测技术,其在兽药残留分析中有着较大的应用前景。
[1]Anastassiades M,Lehotay S J,Stajnbaher D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J].J AOAC INT,2003,86(2):412-431
[2]Banerjee K,Oulkar D P,Dasgupta S,et al.Validation and uncertainty analysis of a multi-residue method for pesticides in grapes using ethyl acetate extraction and liquid chromatography–tandem mass spectrometry[J].J Chromatogr A,2007,1173(1/2):98-109
[3]Cajka T,Hajslova J,Lacina O,et al.Rapid analysis of multiple pesticide residues in fruit-based baby food using programmed temperature vaporizer injection-low pressure gas chromatography-high resolution time-of-flight mass spectrometry[J].J Chromatogr A,2008, 1186(1/2):281-294
[4]Moreno J L F,Frenigh A G,Bolanos P P,et al.Multiresidue method for the analysis of more than 140 pesticide residues in fruits and vegetables by gas chromatography coupled to triple quadrupole mass spectrometry[J].Journal of Mass Spectrometry,2008,43(9):1235-1254
[5]Thanh D N,Yun M Y,Lee G H.A multiresidue method for the determination of 118 pesticides in vegetable juice by gas chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry,2009, 57(21):10095-10101
[6]Lesueur C,Gartner M,Mentler A,et al.Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatographyion trap-mass spectrometry[J].Talanta,2008,75(1):284-293
[7]Nguyen T D,Lee B S,Lee B R,et al.A multiresidue method for the determination of 109 pesticides in rice using the Quick Easy Cheap Effective Rugged and Safe(QuEChERS)sample preparation method and gas chromatography/mass spectrometry with temperature control and vacuum concentration[J].Rapid Communications in Mass Spectrometry,2007,21(18):3115-3122
[8]Plössl F,Giera M,Bracher F.Multiresidue analytical method using dispersive solid-phase extraction and gas chromatography/ion trap mass spectrometry to determine pharmaceuticals in whole blood[J].J Chromatogr.A,2006,1135(1):19-26
[9]董静,宫小明,张立,等.QuEChERS-高效液相色谱法同时检测动物组织中的克球酚、地克珠利和磺胺类药物残留量[J].中国卫生检验杂志,2008,18(1):26-28
[10]Karageorgou E G,Samanidou V F.Development and validation according to European Union Decision 2002/657/EC of an HPLCDAD method for milk multi-residue analysis of penicillins and amphenicols based on dispersive extraction by QuEChERS in MSPD format[J].Journal of Separation Science,2011,34(15):1893-1901
[11]岳振峰.食品中兽药残留检测指南[M].北京,中国标准出版社, 2010
[12]Frenich A G,Aguilera-Luiz M D,Vidal J L M,et al.Comparison of several extraction techniques for multiclass analysis of veterinary drugs in eggs using ultra-high pressure liquid chromatographytandem mass spectrometry[J].Analytica Chimica Acta,2010,661 (2):150-160
[13]Frenich A G,Romero-Gonzalez R,Gomez-Perez M L,et al.Multimycotoxin analysis in eggs using a QuEChERS-based extraction procedure and ultra-high-pressure liquid chromatography coupled to triple quadrupole mass spectrometry[J].J Chromatogr A,2011, 1218(28):4349-4356
Applied Research on QuEChERS Using to Determine Veterinary Drugs Residues in Milk Powder
MI Jie-bo1,XU Di-ming2,LI Shu-jing1,LIN An-qing1,XU Hong1
(1.Animal&Plant&Foodstuffs Inspection Center,Tianjin Import&Export Inspection and Quarantine Bureau,Tianjin 300461,China;2.Ningbo Import&Export Inspection and Quarantine Bureau,Ningbo 315000,Zhejiang,China)
QuEChERS was modified by the optimization of extract solution and salting-out agents.A simple,fast and selective method was developed to determine 22 veterinary drugs in milk powder by ultra-high pressure liquid chromatography coupled to tandem quadrupole mass spectrometry.The extraction of sulphonamides,quinolones and tetracyclines was optimized by using EDTA and buffer system.The limits of detection of sulphonamides,quinolones and tetracyclines were 1,5 μg/kg and 50 μg/kg.When the standards mixture was spiked,the recovery was 70%-102%and the RSD was less than 15%.
QuEChERS;milk powder;veterinary drug residues
2013-09-24
10.3969/j.issn.1005-6521.2015.02.030
天津检验检疫科技计划项目(TK005-2011)
宓捷波(1978—),男(汉),高级工程师,博士研究生,从事食品及农兽药残留分析。
