五味子乙素通过NOS/NO 系统预防BaP所致HTR8-SVneo细胞氧化损伤
2015-08-10章艳燕侯海燕陈晓梁婧陈亚琼
章艳燕,侯海燕,陈晓,梁婧,陈亚琼
(武警后勤学院附属医院,天津 300162)
自由基大量堆积是造成细胞氧化损伤的主要原因。流行病学研究表明苯并(a)芘(BaP)在体内代谢过程中能产生大量氧自由基,造成细胞氧化损伤[1]。五味子乙素(Sch B)是五味子的提取物,可以诱导细胞的抗氧化反应[2]。本研究以人绒毛膜滋养层细胞HTR8-SVneo 为载体,探讨一氧化氮合酶(NOS)/一氧化氮(NO)系统在Sch B 预防BaP 致HTR8-SVneo细胞氧化损伤中的作用及可能机制。
材料与方法
一、材料
1.细胞系:人绒毛膜外滋养层细胞系(HTR8-SVneo)由加拿大Graham 教授惠赠。
2.试剂:五味子乙素(Sch B)(中国药品生物制品检定所),苯并(a)芘(BaP)(Sigam,美国),RNA逆转录试剂盒(北京天根生化)、内皮型一氧化氮合酶(eNOS)酶联免疫分析试剂盒(上海蓝基生物),NO 测试试剂盒、总一氧化氮合酶(TNOS)测定试剂盒(南京建成)。
3.仪器:MODEL680 型酶标仪(BIO-RAD,美国),水平电泳仪、垂直电泳仪及转膜系统(北京六一仪器),电泳凝胶成像系统(FUGI,日本)。
二、研究方法
1.HTR8-SVneo 细胞培养和预处理:HTR8-SVneo细胞培养于含10%胎牛血清、120U/mL 青钠霉素的RPMI1640培养基中,置于37℃、5%CO2饱和湿度培养箱内。待细胞贴壁并长满皿底85%左右时开始给药。实验分为3组,BaP组、Sch B 组和空白对照组。BaP组:先用仅含有10%胎牛血清的1640培养液培养6h,再更换至含有20μmol/L BaP的培养液中继续培养24h;Sch B组:根据培养基中Sch B的浓度不同,又分为3组,各组先分别用含有不同浓度Sch B 的培养液(浓度分别为0.1、0.5 或2 μmol/L)培 养 细 胞6 h,再 换 成 含 有20μmol/L BaP的培养液继续培养24h;空白对照组:用仅含有10%胎牛血清的1640培养液培养细胞6h,再更换为相同成分的培养液继续培养24h。每组实验重复3次。收集细胞制成细胞裂解液,同时将收集的细胞培养液离心待用。
2.MTS法检测细胞存活率:选取对数生长期细胞接种于96孔板中,每孔100μl细胞悬液(含1×104个细胞),待细胞贴壁并长满皿底85%左右时行如上预处理,BaP 孵育24h 后弃去药物及培养液,每孔加入120μl MTS溶液,37℃孵育150min。使用MODEL680酶标仪选择波长为490nm,检测各孔的吸光光度值(OD),以空白对照组为参照,计算其平均值。
3.细胞培养液中NO 及TNOS含量检测:采用还原酶法检测细胞培养液中NO 及TNOS 含量。收集细胞培养液后离心,取上清,按照NO 测试试剂盒和TNOS测定试剂盒说明书步骤进行检测。
4.细胞内诱导型一氧化氮合酶(iNOS)、eNOS的mRNA水平检测:利用Pubmed-Blast设计目的基因 引 物。iNOS 上 游 引 物 序 列:5’-CGGTGCTGTATTTCCTTACGAGGCGAAGAA-3’,下游引物序列: 5’-GGTGCTGCTTGTTAGGAGGTCAAGTAAAGG-3’;eNOS 上 游 引 物 序 列:5’-TCACATCTGTCCAGAGGCTG-3’,下游引物序列:5’-CTGGCACAGTCCCTTATGGT-3’;内参GAPDH 上游引物序列:5’-AGGGGTCTACATGGCAACTG-3’,下游引物序列:5’-CGACCACTTTGTCAAGCTCA-3’。
细胞经药物处理后,用Trizol法提取RNA 并逆转录为cDNA。对逆转录生成的cDNA 模板用iNOS、eNOS 引物进行RT-PCR 扩增,以GAPDH作为内参。RT-PCR 扩增体系(2×Tap PCR Master MIX 6μl,上游引物1μl,下游引物1μl,RNA底物1μl,ddH2O 3μl)。反应循环参数:95 ℃变性5min;95℃30s、56℃45s、72℃1min,共34个循环;最后72℃延伸10 min。取8μl扩增后产物行1.5%琼脂糖凝胶电泳,紫外灯下进行成像分析,得到待测DNA 扩增产物与内参GAPDH 扩增产物的光密度值,计算二者的比值,即为目的DNA 的相对表达量。
5.细胞eNOS蛋白表达量测定:选取对数生长期细胞接种于6孔板中,每孔2ml细胞悬液(含5×105个细胞),待给药处理后,按照eNOS 酶联免疫分析试剂盒说明,吸取细胞培养液,离心5min后收集上清,酶标板上加样,再加入酶标记溶液,37℃反应1h。弃液、洗涤5次,拍干。每孔依次加入显色剂A 和显色剂B,37℃避光显色15min。每孔加入终止液,终止反应。置于酶标仪上450nm 测量各孔吸光光度值,重复测量3次。
三、统计学分析
采用SPSS 21.0 软件进行统计分析。计量数据均以(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
一、细胞存活率比较
BaP组细胞存活率(72.2±0.9)%明显低于空白对照组,差异有统计学意义(P<0.05);0.1、0.5或2 μmol/L Sch B+20μmol/L BaP各组的细胞存活率分别为(78.2±1.5)%、(86.5±0.6)%、(93.4±1.0)%,显著高于Bap组(P<0.05)(图1、2)。

图1 光镜下细胞生长图片 ×200

图2 各组细胞存活率比较
二、细胞NO 及TNOS含量比较
BaP组细胞培养液中NO、TNOS 含量分别为(4.21±0.20)μmol/L、(8.78±0.38)U/ml,均显著高于空白组[分别为(1.82±0.15)μmol/L 和(6.08±0.68)U/ml],差异有统计学意义(P<0.05);而与BaP 组相比,给予Sch B 干预的组别中NO、TNOS含量随着Sch B 剂量的增加逐渐下降,0.1、0.5或2μmol/L Sch B+20μmol/L BaP各组NO、TNOS含量分别为(3.90±0.18)μmol/L、(3.22±0.15)μmol/L、(2.81±0.15)μmol/L 和(7.51±0.55)U/ml、(7.45±0.48)U/ml、(6.19±0.50)U/ml(P<0.05)(图3)。
三、细胞内iNOS、eNOS mRNA 表达量
BaP组中iNOS、eNOS mRNA 表达量均高于空白组,分别为空白组的3.60和1.88倍,差异有统计学意义(P<0.05),而与BaP 组相比,不同剂量Sch B 组 中iNOS、eNOS mRNA 表 达 量 均 显 著 下降,分 别 为BaP 组 的0.80、0.49、0.50 倍 和0.71、0.73、0.57倍,差异有统计学意义(P<0.05)(图4)。
四、细胞内eNOS蛋白表达量
eNOS酶联免疫结果显示,BaP 组中eNOS 蛋白表达量为(5.67±0.66)ng/ml,是空白组表达量[(3.16±0.86)ng/ml]的1.79倍(P<0.05);而与BaP组相比,不同剂量的Sch B 组中eNOS蛋白表达 量 显 著 下 降,0.1、0.5 或2 μmol/L Sch B+20μmol/L BaP各组eNOS蛋白含量分别为(4.34±0.39)ng/ml、(4.44±0.39)ng/ml和(3.20±0.88)ng/m,分别为BaP组的0.77、0.78和0.56倍(P<0.05)(图5)。
讨 论
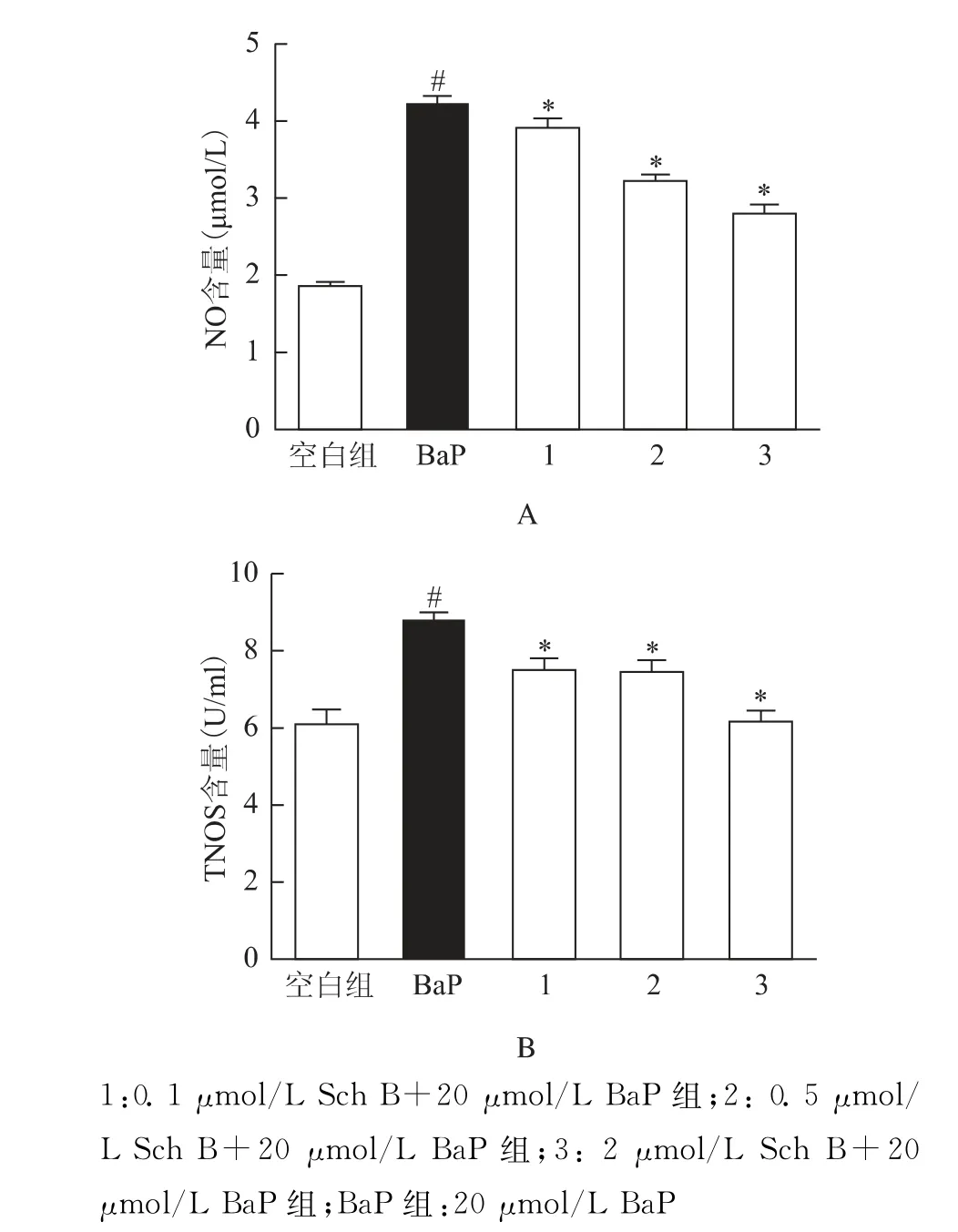
图3 各组培养液中NO(A)、TNOS(B)含量比较
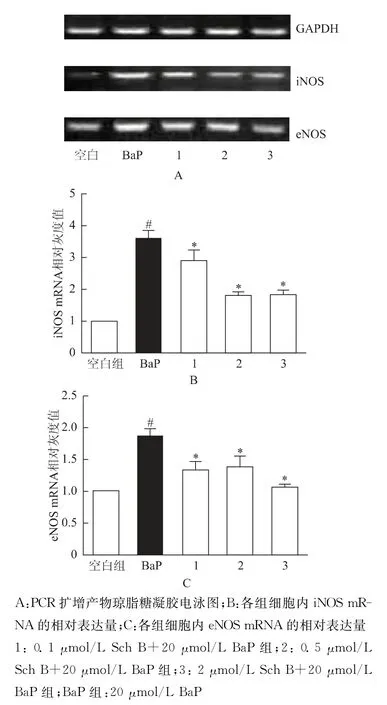
图4 各组细胞内iNOS、eNOS的mRNA 相对表达量

图5 各组细胞内eNOS蛋白表达量
多环芳烃类化合物是常见空气污染物,大量研究表明多环芳烃类化合物可以通过胎盘屏障与胎儿血液中的血红蛋白结合形成DNA 加合物,导致低出生体重、胎儿生长受限及出生缺陷等不良妊娠结局[3-4]。BaP是多环芳烃类污染物中最具代表性的一种,具有致畸、致癌、致突变作用。流行病学研究表明BaP在体内代谢过程中可以产生大量的氧自由基,对机体和组织细胞产生氧化损伤,造成组织细胞氧化应激反应。胚胎发育早期对环境致畸物较敏感,如果这一时期较多地暴露于Bap 甚至可导致胚胎发育停止[5-8]。
氧自由基诱导的细胞功能失调是胚胎体外发育受阻的一个重要因素,NO 就是其中之一。NO 作为一种自由基性质的生物活性气体分子,普遍存在于机体各组织细胞中,具有非常重要的生理调节作用。近年来许多研究表明NO 在体内外早期胚胎发育中具有重要的调节作用。NO 代谢水平可作为检测胚胎发育是否正常的一项重要指标[9]。NO 在组织和细胞中发挥其生物学作用的机理之一是通过激活鸟苷酸环化酶,引起环磷酸鸟苷(cGMP)水平升高。许多实验证明cAMP/cGMP 比例对胚胎的生长发育和分化具有重要的调节作用[10]。NO 是cAMP/cGMP比例的主要调节者。故适量浓度的NO 是正常胚胎发育所必需,当其浓度失衡时则可能导致胚胎发育阻滞或胚胎死亡[11-12]。Fábregues等[13]的研究估计了NO 供体对小鼠胚胎体外发育和体内种植的研究,结果表明高浓度的NO 既能抑制小鼠胚胎的体外发育亦能抑制胚胎的体内种植。本研究结果表明BaP能刺激HTR8-SVneo细胞产生大量的NO,造成细胞损伤,而Sch B 能明显减少NO 的生成,从而预防BaP对细胞产生的氧化损伤。
NOS是NO 合成过程中的限速酶,NOS 其同功酶主要有3 种亚型:eNOS、iNOS 和神经元型一氧化氮合酶(nNOS)。由于NO 半衰期非常短且极其不稳定,大多数关于NO 的研究都是以研究NOS的调控为基础。大量研究表明NOS在许多哺乳类动物早期胚胎发育中均有不同程度的表达,在胚胎发育过程中起着重要作用。本研究结果显示BaP组细胞培养液中TNOS含量明显增加,而TNOS的活性增强能促进NO 的大量生成,致使高浓度NO对细胞产生损伤。而Sch B 能抑制TNOS 的大量增加,减少细胞损害。
流行病学研究表明正常妊娠期妇女整个妊娠期间羊膜及绒毛膜间质的纤维细胞均有iNOS表达,胎盘组织中亦有广泛分布的iNOS,其与某些免疫因子相互作用,维持胎盘屏障的正常生理功能。iNOS生理状态下处于不表达或低表达状态,当机体受到急性损伤时,其表达被激活,产生过量NO 并聚积,高水平的NO 可损伤细胞线粒体、干扰能量代谢以及DNA 合成,还可使高剂量的超氧化物歧化酶(SOD)丧失保护作用,导致细胞死亡[14]。夏革清等[15]研究表明,iNOS表达与滋养细胞凋亡相关,在滋养细胞凋亡明显的部位,iNOS的表达量增加,同时iNOS在自然流产滋养细胞中的表达水平明显高于正常妊娠滋养细胞中的表达水平。Ogando 等[16]的研究亦表明,由iNOS 催化底物生成的高浓度NO 具有细胞毒性作用,引起胚胎损伤。同时还有研究表明可以通过抑制iNOS的表达降低NO 生成从而减少细胞损伤及凋亡[17]。本研究结果显示,空白对照组细胞内iNOS mRNA 呈低表达状态,而BaP组中iNOS mRNA 表达明显上调,提示iNOS催化合成的过量NO 在BaP 对细胞产生的损伤中起促进作用。而不同剂量Sch B组中iNOS mRNA的表达量相比BaP组明显减少,说明Sch B 可通过抑制iNOS的表达,减少NO 生成,减轻对细胞的损伤。
生理条件下内皮细胞在低表达eNOS催化下产生一定量的NO,通过细胞内cGMP 途径调节平滑肌细胞的张力、舒张血管等。然而在某些条件下,如组织的缺血再灌注等过程中,eNOS 也能产生大量有损伤作用的NO[18]。许雅君等[19]研究表明乙醇能够从基因和蛋白水平诱导胚胎组织eNOS表达的增加,继而对组织造成氧化损伤,而乙醇导致胚胎细胞内NO 含量的增加可能也与eNOS的表达上调有关。本研究结果表明BaP 组eNOS mRNA 和蛋白水平的表达量均明显增加,而Sch B 组中eNOS mRNA 和蛋白水平的表达量均显著减少。进一步说明BaP可以通过上调eNOS活性,刺激细胞产生大量NO,从而对细胞产生氧化损伤,而Sch B 可以有效预防这种损伤。
综上所述,BaP可能通过改变NOS活性,导致NO 代谢紊乱,诱发细胞的氧化损伤。Sch B则可以有效预防BaP所致的HTR8-SVneo细胞氧化损伤,其机制可能与NOS/NO 系统的平衡有关。
[1] 连立芬,陈亚琼,侯海燕.苯并芘的生殖毒性机制研究进展[J].国际生殖健康/计划生育杂志,2013,32:450-453.
[2] 梁婧,侯海燕,兰晓霞,等.五味子乙素的药理作用及其分子机制的研究进展[J].中国现代应用药学,2014,31:506-510.
[3] Madhavan ND,Naidu KA.Polycyclic aromatic hydrocarbons in placenta,maternal blood,umbilical cord blood and milk of Indian women[J].Hum Exp Toxicol,1995,14:503-506.
[4] Perera FP,Tang D,Rauh V,et al.Relationships among polycyclic aromatic hydrocarbon-DNA adducts,proximity to the World Trade Center,and effects on fetal growth[J].Environ Health Perspect,2005,113:1062-1067.
[5] Timme-Laragy AR,Van Tiem LA,Linney EA,et al.Antioxidant responses and NRF2in synergistic developmental toxicity of PAHs in zebrafish[J].Toxicol Sci,2009,109:217-227.
[6] Wu J,Hou H,Ritz B,et al.Exposure to polycyclic aromatic hydrocarbons and missed abortion in early pregnancy in a Chinese population[J].Sci Total Environ,2010,408:2312-2318.
[7] 侯海燕,陈亚琼,王丹,等.天津地区大气颗粒物质与妊娠早期稽留流产的关系[J].国际妇产科学杂志,2012,39:609-612.
[8] Hou HY,Wang D,Zou XP,et al.Does ambient air pollutants increase the risk of fetal loss?A case-control study[J].Arch Gynecol Obstet,2014,289:285-291.
[9] 汪涛,刘宇,黄群山,等.一氧化氮对动物生殖机能的影响[J].动物医学进展,2006,27;27-30.
[10] Dey SK,Kimura F,Mukherjee A,et al.Cyclic AMP and cyclic GMP in rabbit blastocysts[J].J Reprod Fertil,1978,52:235-237.
[11] Kim BH,Kim CH,Jung KY,et al.In volvement of nitric oxide during in vitro fertilization and early embryonic developpment in mice[J].Arch Pharm Res,2004,27:86-93.
[12] Sengoku K,Takuma N,Horikawa M,et al.Requirement of nitric oxide for murine oocyte maturation,embryo development,and trophoblast outgrowth in vitro[J].Mol Reprod Dev,2001,58:262-268.
[13] Fábregues F,Balasch J,Manau D,et al.Circulating levels of nitric oxide in successful and unsuccessful implantation after in vitro fertilization and embryo transfer.Relationship to ertradiol and progesterone[J].Acta Obstet Gynecol Scand,2000,79:564-569.
[14] 郑杨.一氧化氮的生物化学及其生理和药理效应[J].化学教育,2000,2:1-5.
[15] 夏革清,孙永玉.细胞凋亡与诱导型一氧化氮合酶在早期自然流产绒毛滋养细胞的表达[J].生殖医学杂志,2001,10:34-37.
[16] Ogando DG,Paz D,Cella M,et al.The fundamental role of increased production of nitric oxide in lipopolysaccharideinduced embryonic resorption in mice[J].Reproduction,2003,125:95-110.
[17] Yang LY,Shen SC,Cheng KT,et al.Hispolon inhibition of inflammatory apoptosis through reduction of iNOS/NO production via HO-1 induction in macrophages[J].J Ethnopharmacol,2014,156:61-72.
[18] Matheis G,Sherman MP,Buckberg GD,et al.Role of Larginine-nitric oxide pathway in myocardial reoxygenation injury[J].Am J Physiol,1992,262:H616-620.
[19] 许雅君,李勇.乙醇对小鼠胚胎内皮型一氧化氮合酶表达影响[J].中国公共卫生,2007,23:960-961.
