芦丁通过调控TG 代谢途径抑制肝细胞脂肪变性的作用机制研究*
2015-08-10胡林峰张福利谢璐帆窦晓兵
潘 然,丁 滨,胡林峰,张福利,丁 蕾,方 波,谢璐帆,窦晓兵
(浙江中医药大学生命科学学院,浙江 杭州310053)
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)是多病因引起的以肝细胞内脂质蓄积及肝细胞脂肪变性为特征的临床病理综合征,包括单纯性非酒精性脂肪肝(Nonalcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(Nonalcoholic steatohepatitis,NASH),进一步可发展为肝纤维化,甚至肝癌。肝脏能利用甘油、糖、脂肪酸和甘油一酯为原料,经过磷脂酸途径和甘油一酯途径合成甘油三酯(Triacylgycerol,TG);同时TG 也能在一系列脂肪酶的作用下,分解生成甘油和脂肪酸,并释放入血供其它组织利用[1]。已知与TG 代谢相关的蛋白中二脂酰甘油酰基转移酶(DGAT)和肉毒碱棕榈酰转移酶(CPT)分别是甘油三酯合成代谢、脂肪酸合成及分解代谢途径中的限速酶。以上3 个蛋白的异常表达,直接导致肝脏细胞TG 聚积,促进NAFLD 的发生和发展。而过氧化物酶体增殖剂激活受体α(Peroxisome proliferators activated receptor α,PPAR-α)是调控基因表达的核内受体转录因子超家族成员之一,具有调控脂肪酸氧化等多种生物学效应。因此,本研究以芦丁对3 个限速酶转录的调控及PPAR-α 调控因子表达的影响,探索芦丁预防肝细胞中油酸诱导的TG 聚积的分子机制。
芦丁属黄酮类化合物,又称芸香苷、维生素P、紫槲皮苷,存在于芸香叶、荞麦花等多种植物中,具有抗炎、抗病毒作用,对脂肪浸润的肝脏有祛脂作用,临床上多用于治疗脑溢血、高血压、视网膜出血、紫瘢和急性出血性肾炎[2-4]。在非酒精性脂肪性肝病的中药单药研究中发现,以芦丁为主要成分之一的黄酮类化合物有着突出的临床表现[5],具有降血糖、降血脂、保肝等作用[6-7]。已有动物实验研究表明,芦丁能通过降低甘油三酯,改善微循环,疏通肝内血液瘀滞以及抗氧化作用,调节机体脂代谢[8-10]进而达到防治NAFLD 的目的。但是芦丁治疗NAFLD的分子机制尚不清楚,因此用现代生物技术进一步揭示芦丁治疗NAFLD 的作用机制及靶点,对于拓展芦丁应用的领域,探索有效预防NAFLD 的新思路具有积极科学意义。
1 材料和方法
1.1 材料
1.1.1 细胞
人肝细胞株HepG2 购自中科院上海细胞库。
实验用PPAR-α 抗体购自BOSTER(H1712),β-Actin 抗体购自Santa(B1914)。LDH 检测试剂盒(317674)、BioEasy Master Mix (SYBR Green)(BSB25L1)均购自Thermo。BCA 试剂盒购自北京鼎国生物(BCA-01),Trizol 购自Invitrogen(103205)。芦丁购自上海瑞永生物科技(RW95247Q301,纯度≥95%),配成10mmol/L 原液待用。引物由上海生工合成,其他化学试剂购自Sigma-Aldrich 公司。
1.2 方法
1.2.1 细胞培养及模型建立
人肝细胞株HepG2 用含10%胎牛血清、青霉素100U/mL、链霉素100μg/mL 的DMEM 培养液培养,37℃,5% CO2条件下培养。当培养瓶中的细胞长成80%时即可进行传代培养[11]。
制备单细胞悬液,细胞按2×105个/mL 密度接种于24 孔培养板内,每孔1mL,将HepG2 细胞分成4 组:①空白对照组(UT):不作任何药物处理;②芦丁组(Rutin):仅用芦丁处理;③OA 组(OA):仅用OA 处理;④芦丁+OA 组(Rutin+OA):芦丁预处理后加入OA 处理。以上4 组每组设3 个重复组,芦丁预处理2h 后向③、④组加入0.5mmol/L OA 培养箱中培养过夜。
1.2.2 HepG2 细胞油红O 染色
PBS 清洗2 遍,4%多聚甲醛500μL/孔固定30min;稀释油红储存液:油红∶去离子水=3 ∶2,滤纸过滤后室温放置10min;用过滤后的油红O 染液500μL/孔染色10min;用60%异丙醇漂洗脱色,除去多余的染料;40 倍光学显微镜观察、拍照。
1.2.3 HepG2 细胞内TG 含量测定
向油红O 染色后的培养板内加入4% NP40 覆盖底面,待颜色稳定后吸取200μL 上清用于测定吸光度。
从小到大,陶小西的自行车后座只有温衡坐过,他带她去海边驱赶潮汐蟹,带她去香蕉林偷香蕉,或者偷偷爬上顶楼看日出。谊爱路的居民们没有人不认识他们,总是看见他们骑着自行车呼啸而过,笑他们两小无猜。
1.2.4 LDH 测定
根据LDH 检测试剂盒说明测定细胞培养液中LDH 活性,分析各组间的细胞毒性作用。
1.2.5 实时荧光定量PCR
根据Trizol 试剂盒一步法提取细胞和组织总RNA,完成逆转录和实时荧光定量PCR。所用引物如表1 所示(β-actin 为内参对照)。

表1 引物序列
1.2.6 Western Blot
用裂解法提取总蛋白,用BCA 试剂盒测定浓度。将各组调整至相同蛋白浓度后,取20μg 样本经SDS-PAGE 电泳、转移电泳、抗体免疫(一抗分别为抗PPAR-α 蛋白、抗β-actin 蛋白)、ECL 显影、曝光等步骤检测蛋白表达情况(β-actin 做内参对照)。
1.3 统计学处理
利用SPSS17.0 统计软件,数据以均数±标准差(x±s)表示,组间均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 芦丁抑制OA 诱导的HepG2 细胞内TG 的积聚
用20μmol/L 芦丁预处理HepG2 细胞2h,再加入0.5mmol/L OA 孵育过夜,LDH 结果显示,OA 组、Rutin 组、Rutin+OA 组这3 个处理组细胞活性与UT组相比无明显差异(P>0.05),见图1。OA 组细胞内TG 含量是UT 组的1.63 倍(P<0.05),而与OA 组相比,Rutin+OA 组TG 含量显著降低,见图2。该试验结果与油红O 染色观察到的现象相符:OA 作用16 h 后,各组细胞边缘清晰,油红O 染色后镜下观察空白对照组和芦丁组细胞内几乎无红色脂滴;UT和Rutin 组细胞内几乎无红色脂滴;而OA 组和Rutin+OA 组细胞内红色脂滴明显增加,分布在靠近细胞膜的区域,呈现密集小滴状;但与OA 模型组相比,Rutin+OA 组脂滴量则相对较少,见图3。
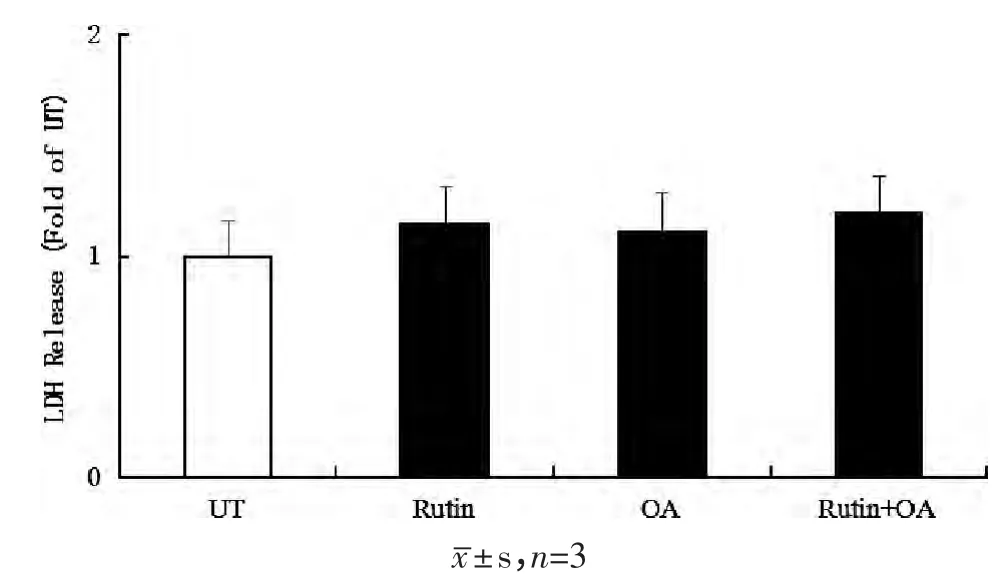
图1 对比分析芦丁对脂肪变性HepG2 细胞毒性的影响
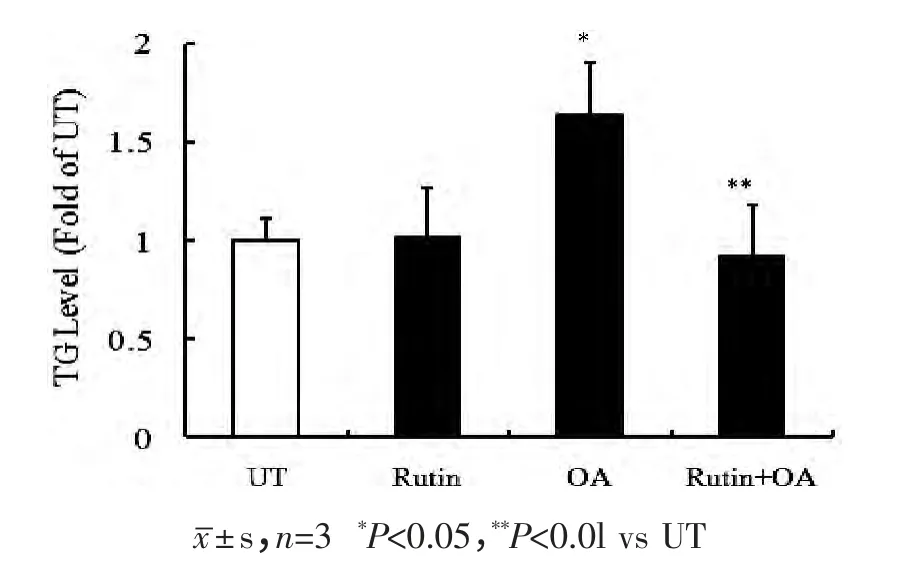
图2 对比分析芦丁对脂肪变性HepG2 细胞中TG 含量的影响

图3 光学显微镜下(200×)观察各实验组脂肪变性HepG2 细胞TG 含量的影响
2.2 芦丁对PPAR-α 转录及翻译的影响
首先利用Real-time PCR 方法对比研究PPAR-α 在不同研究组中转录水平的差异。结果显示,如图4A,与UT 组比较,OA 组细胞内PPAR-α mRNA 表达量为62.4%,呈显著降低(P<0.05),而Rutin+OA 组中PPAR-α 的mRNA 表达量为284%,呈明显增加(P<0.05)。为了进一步探究芦丁对PPAR-α 蛋白表达水平的影响,利用两种不同浓度处理细胞,Western blotting 结果如图4B,与UT 组相比,OA 组中PPAR-α 蛋白表达变化不明显,而在两个不同Rutin+OA 组中,该蛋白的表达增加,且与芦丁浓度正相关。

图4 芦丁对脂肪变性HepG2 细胞中PPAR-α在转录水平和翻译水平上的调控
2.3 芦丁对各组细胞中CPT 和DGAT 基因转录的影响
CPT 是脂肪酸β 氧化途径中的限速酶,我们首先对各试验组中该酶的mRNA 表达情况对比分析,结果如图5A 所示,与UT 组相比,OA 组中CPT 的两个亚型(CPT1a 和CPT2)mRNA 表达量显著降低(P<0.05);而Rutin+OA 组中两个亚型的mRNA 表达量显著高于OA 组(P<0.05)。
芦丁对预防TG 聚积的影响,即可能是促进TG的分解也可能是抑制TG 的合成(与DGAT 相关)。Real-time PCR 结 果 显 示,OA 组 中DGAT1 和DGAT2 的mRNA 相对表达量分别是UT 组的3.75倍和3.94 倍(P<0.05)。而Rutin+OA 组中DGAT 两个亚型的mRNA 表达量虽未恢复到正常水平但与OA 组相比已显著降低,见图5B。
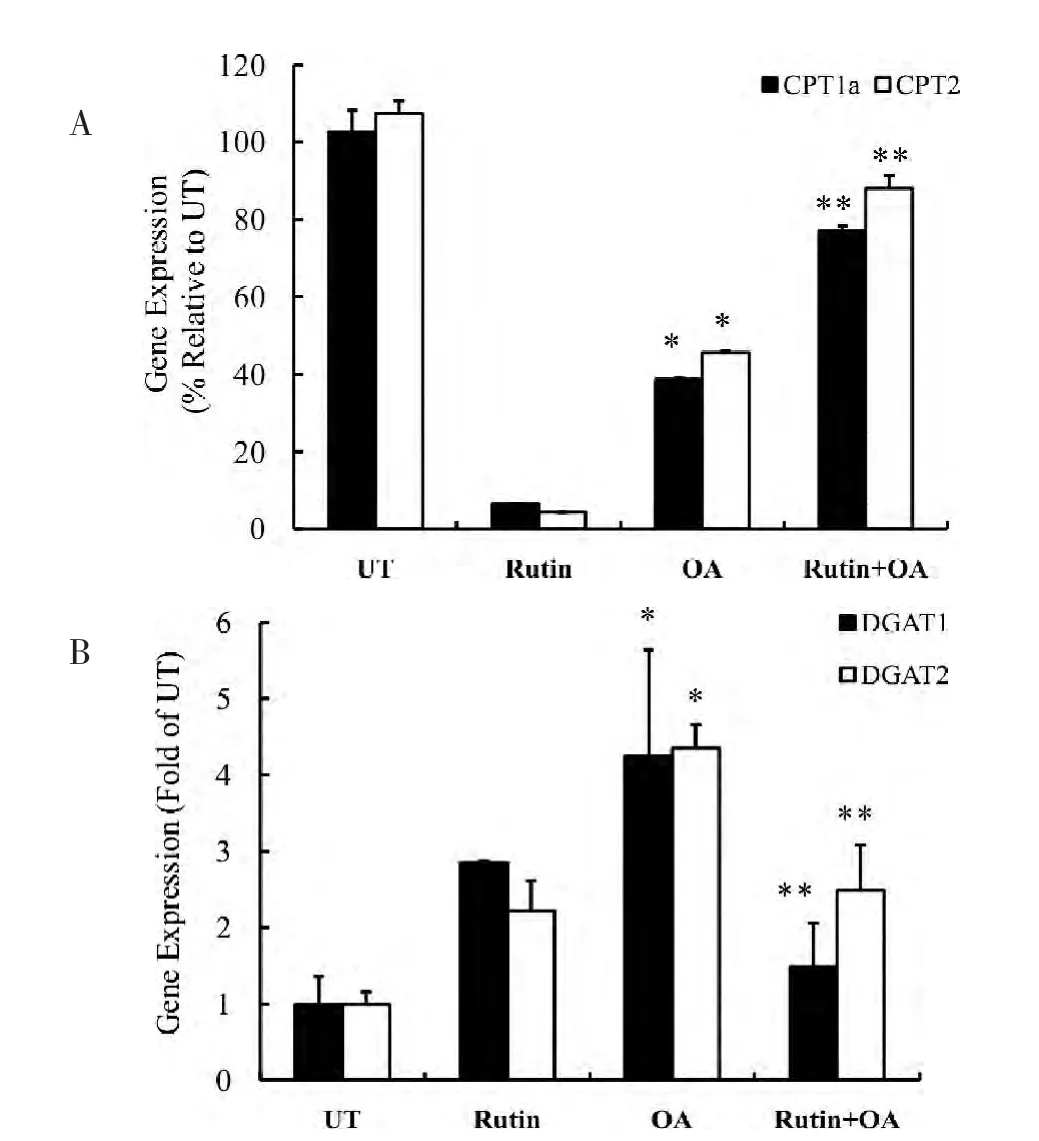
图5 芦丁对脂肪变性HepG2 细胞中CTP 及DGAT在转录水平的调控
3 讨论
随着生活水平的日益提高,NAFLD 患病率不断升高,并呈低龄化发病趋势,在发达国家,NAFLD 已成为慢性肝病及血清氨基酸转移酶升高的首要原因,在我国仅次于病毒性肝炎[12]。NAFLD已成为全球备受关注的一大公共卫生问题,严重威胁着人类的生命健康。NAFLD 发病机制复杂,目前公认的是Day 的“二次打击学说”[13],其中“二次打击”以脂质过氧化、内质网应激和线粒体功能损伤为主。已有多篇文献报道,PPAR-α 的表达量与NAFLD 存在一定的关联[14-17]:肝脏脂肪酸水平的增高激活PPAR-α 后,诱导脂肪酸氧化的基因转录,增加对脂肪酸氧化的能力,进而降低脂质在肝脏的沉积,在调节细胞脂肪酸代谢的各个环节中占有重要地位[18-21]。Ying Cai 等人[22]的研究发现,芦丁能够显著减少db/db 小鼠肝细胞内脂滴的积聚,降低TG 的含量,同时在小鼠的肌肉组织检测到高浓度的PPAR 族蛋白。Cheng-Hsun W[23]等人报道,芦丁能够通过减少脂质积累和氧化应激反应来降低HepG2 细胞内TG 的积累。本研究也在细胞水平证明了这一结果,并且还进一步发现芦丁能够促进PPAR-α 在转录和翻译水平上的表达,提示其可能通过PPAR-α 来调控细胞内脂肪酸代谢,进而降低TG 在肝细胞内的积聚。CPT 是线粒体内脂肪酸β-氧化反应的限速酶,分CPT1 和CPT2 两类。CPT1 位于线粒体内膜外侧,催化长链脂肪酸从酰基辅酶A 转移到肉毒碱上进而从胞浆进入线粒体内部,并且进一步在位于线粒体内膜上的CPT2 催化下进行β 氧化[24-27]。我们推测芦丁通过PPAR-α 激活CPT 的转录。为证实我们的推测,我们检测了芦丁对细胞内CPT 转录的影响。发现仅用芦丁处理反而会抑制CPT 的转录,且其抑制效率较OA 更强。但同时加入芦丁和OA 处理的细胞中CPT 的转录又得以恢复。体现出中医中以毒攻毒,否极泰来的用药理念。然而与我们的预测不同,芦丁仅仅通过PPAR-α 恢复了原有受抑制的CPT 的转录。
除了降解途径,影响肝脏内TG 含量的另一个因素是脂肪酸以及TG 的合成。DGAT 是TG 合成的限速酶,分DGAT1 和DGAT2 两种亚型,能催化二酰甘油和脂肪酸酰基生成三酰甘油的反应,在TG合成中起到了至关重要的作用。该酶在细胞中的浓度与脂肪代谢、脂类在脂肪中的沉积、血浆中TG 的浓度有很大关系。Kong L[28]、Charles A[29]等实验证明DGAT 在肝脏中的过表达能使细胞溶质中积累脂质,并利用内源性的单不饱和脂肪酸合成TG[30-31]。在我们的研究中检测了各试验组细胞中DGAT 的mRNA 表达量,发现芦丁能够显著抑制油酸诱导的细胞内DGAT1 和DGAT2 的基因转录,从而抑制了OA 诱导的TG 的合成。
综上所述,芦丁能够降低脂肪变性HepG2 细胞TG 含量,在转录和翻译水平上增加细胞内PPAR-α的表达。并且能够激活脂肪酸代谢途径中CPT 的表达,同时抑制TG 合成过程途径中DGAT 的表达。我们推测芦丁是通过增加细胞内PPAR-α 的表达,恢复脂肪变性肝细胞中脂肪酸的正常氧化代谢、抑制脂肪酸的合成,进而减缓OA 诱导的肝细胞中TG的积累。同时芦丁通过抑制DGAT 的转录,减缓了脂肪变性感细胞中TG 过量的合成。可见,芦丁对脂肪变性肝细胞脂质代谢的影响并不是单一的,可能涉及多种方式多条通路,具体机制还有待在后续的研究中阐明。
[1] Lettieri Barbato D,Aquilano K,Baldelli S,et al. Proline oxidase-adipose triglyceride lipase pathway restrains adipose cell death and tissue inflammation [J]. Cell Death Differ.2014,21(1):113-123.
[2] 韩淑英,张宝忠,朱丽莎,等. 荞麦花总黄酮对实验性大鼠Ⅱ型糖尿病高脂血症的防治作用[J]. 中国药理学通报,2003,19(4):477-478.
[3] Niture NT,Ansari AA,Naik SR. . Anti-hyperglycemic activity of Rutin in streptozotocin-induced diabetic rats:An effect mediated through cytokines,antioxidants and lipid biomarkers [J]. Indian Journal of Experimental Biology.2014,52(7):720-727.
[4] Lettieri Barbato D,Aquilano K,Baldelli S,et al. Proline oxidase-adipose triglyceride lipase pathway restrains adipose cell death and tissue inflammation [J]. Cell Death Differ.2014,21(1):113-123.
[5] 朱丹,吕文良,陈兰羽. 非酒精性脂肪性肝病的中药单药研究[J]. 中华中医药学刊,2014,32(4):783-785.
[6] Gao M,Ma Y,Liu D. Rutin Suppresses Palmitic Acids-Triggered Inflammation in Macrophages and Blocks High Fat Diet-Induced Obesity and Fatty Liver in Mice [J]. Pharm Res,2013,30(1):2940-2950.
[7] Lee CC,Shen SR,Lai YJ. Rutin and quercetin,bioactive compounds from tartary buckwheat,prevent liver inflammatory injury[J]. Food and Function. 2013,4(5):794-802.
[8] 李光民,储金秀,韩淑英. 荞麦花叶中芦丁调解糖脂代谢的作用及机制[J]. 华西药学杂志,2010,25(4):425-428.
[9] Molina M F,sanchez-Reus I,Iglesias I,et al. Quercetin,a flavonoid antioxidant,prevents and protects against ethanolinduced oxidative stress in mouse Liver [J]. Biological &Pharmaceutical Bulletin,2003,26(10):1398-1402.
[10] 王敏,魏益民,高锦明. 苦荞黄酮的抗脂质过氧化和红细胞保护作用研究[J]. 中国食品学报,2006,6(1):278-283.
[11] Yin J,Luo Y,Deng H,et al. Human Qingzhi medication ameliorates hepatic steatosis by activating AMPK and PPARα pathways in L02 cells and HepG2 cells [J]. J Ethnopharmacol. 2014,154(1):229-239.
[12] 李瑜元. 非酒精性脂肪性肝病的研究进展[J]. 世界华人消化杂志,2013,21(2):109-115.
[13] Day CP,James OF. Steatohepatitis:a tale of two “hits”[J].Gastroenterology,1998,114(4):842-845.
[14] Li Q,Li L,Wang F,et al. Dietary capsaicin prevents nonalcoholic fatty liver disease through transient receptor potential vanilloid 1-mediated peroxisome proliferator-activated receptor-σ activation[J]. Pflügers Archiv-European Journal of Physiology,2013,9(465):1303-1316.
[15] Donqiovanni P,Rametta R,Fracanzani AL,et al. Lack of association between peroxisome proliferator-activated receptors alpha and gamma2 polymorphisms and progressive liver damage in patients with non-alcoholic fatty liver disease:a case control study [J]. BMC Gastroenterology.2010,10:102.
[16] Ziamajidi N,Khaghani S,Hassanzadeh G,et al. Amelioration by chicory seed extract of diabetes-and oleic acid-induced non-alcoholic fatty liver disease(NAFLD)/non-alcoholic steatohepatitis(NASH)via modulation of PPARα and SREBP-1[J]. Food Chem Toxicol. 2013,58:198-209.
[17] Hsu WH,Chen TH,Lee BH,et al. Monascin and ankaflavin act as natural AMPK activators with PPARα agonist activity to down-regulate nonalcoholic steatohepatitis in high-fat diet-fed C57BL/6 mice[J]. Food Chem Toxicol. 2014,64:94-103.
[18] Ducheix S,Podechard N,Lasserre F. A systems biology approach to the hepatic role of the oxysterol receptor LXR in the regulation of lipogenesis highlights a cross-talk with PPARα[J]. Biochimie. 2013,95(3):556-567.
[19] Guzmán C,Benet M,Pisonero-Vaquero S,et al. The human liver fatty acid binding protein(FABP1)gene is activated by FOXA1 and PPARα;and repressed by C/EBPα:Implications in FABP1 down-regulation in nonalcoholic fatty liver disease[J]. Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids. 2013,1831(4):803-818.
[20] Shi LJ,Shi L,Song GY,et al. Oxymatrine attenuates hepatic steatosis in non-alcoholic fatty liver disease rats fed with high fructose diet through inhibition of sterol regulatory element binding transcription factor 1(Srebf1)and activation of peroxisome proliferator activated receptor alpha(Pparα)[J]. Eur J Pharmacol,2013,714(1-3):89-95.
[21] Cai Y,Fan C,Yan J,et al. Effects of Rutin on the Expression of PPARγ in Skeletal Muscles of db/db Mice[J].Planta Med,2012,78(9):861-865.
[22] Kong L,Ren W,Li W,et al. Activation of peroxisome proliferator activated receptor alpha ameliorates ethanol induced steatohepatitis in mice [J]. Lipids Health Disease,2011,10:246.
[23] Wu CH,Lin MC,Wang HC,et al. Rutin Inhibits Oleic Acid Induced Lipid Accumulation via Reducing Lipogenesis and Oxidative Stress in Hepatocarcinoma Cells[J]. Journal of Food Science,2011,76(20):65-72.
[24] 张艳芳. CPT1 基因对猪脂肪沉积的影响及其调控机制的研究[D]. 杭州:浙江大学,2010.
[25] Orly J,Schramm M. Fatty acids as modulators of membrane functions:catecholamine-activated adenylate cyclase of the turkey erythrocyte[J]. Proceedings of the National Academy of Sciences,1975,72(9):3433-3437.
[26] Shinitzky M,Barenholz Y. Fluidity parameters of lipid regions determined by fluorescence polarization[J]. Biochimica et Biophysica Acta(BBA)-Reviews on Biomembranes,1978,515(4):367-394.
[27] McGarry JD,Brown NF. The mitochondrial carnitine palmitoyltransferase system. From concept to molecular analysis[J]. Eur J Biochem,1997,244(1):1-14.
[28] Harris CA,Haas JT,Streeper RS,et al. DGAT enzymes are required for triacylglycerol synthesis and lipid droplets in adipocytes [J]. Journal of Lipid Research. 2011,52(4):657-667.
[29] Yamazaki T,Sasaki E,Kakinuma C,et a1. Increased very low density lipoprotein secretion and gonadal fat mass in mice over -expressing liver DGAT1 [J]. Biol Chem,2005,280(22):2l506-21514.
[30] Man WC,Miyazaki M,Chu K,et a1. Colocalization of SCD1 and DGAT2 implying preference for endogenous monounsaturated fatty acids in triglyceride synthesis [J]. J Lipid Res,2006,47(9):1928-1939.
[31] Houde C,Wong KK,Wang SP,et al. Impact of Hepatic GPAT1 or DGAT2 Deficiency on Plasma Lipids and MTP Inhibitor-Induced Elevation of Liver Triglycerides in Mice[J]. Circulation,2011,21:A9565.
