血浆miRNA-155和miRNA-625用于非小细胞肺癌诊断的临床评价
2015-08-08费玲李坚朱立欢林杰何清
费玲,李坚,朱立欢,林杰,何清
(1.江苏大学附属医院呼吸内科,江苏镇江212001;2.解放军101医院检验科,江苏无锡214001)
血浆miRNA-155和miRNA-625用于非小细胞肺癌诊断的临床评价
费玲1,李坚1,朱立欢1,林杰2,何清2
(1.江苏大学附属医院呼吸内科,江苏镇江212001;2.解放军101医院检验科,江苏无锡214001)
目的:探讨测定患者血浆miRNA-155和miRNA-625表达水平用于非小细胞肺癌(non-small cell lung cancer,NSCLC)临床诊断的可行性。方法:应用荧光定量RT-PCR法检测49例NSCLC患者及55例肺部良性疾病患者血浆中miRNA-155和miRNA-625的表达水平。构建受试者工作特征(ROC)曲线,根据这两个miRNAs的ROC曲线下面积判断其诊断NSCLC的效能,并与血清癌胚抗原比较,评价它们在NSCLC诊断中的临床价值。结果:NSCLC患者血浆中miRNA-155的表达水平明显高于肺良性疾病患者(P=0.000),miRNA-625的表达水平则明显低于肺良性疾病患者(P=0.000)。NSCLC患者血浆miRNA-155和miRNA-625的表达水平与肿瘤的临床分期明显相关(P=0.008,0.025),miRNA-625亦与患者性别相关(P=0.024),而与其他临床特征无明显相关性。根据ROC曲线取miRNA-155和miRNA-625用于诊断NSCLC的临界值分别为2.736和0.699,获得诊断的敏感性分别为75.5%和73.4%,特异性分别为74.5%和70.9%。血清癌胚抗原含量诊断NSCLC的敏感性低于血浆miRNA-155和miRNA-625(P=0.004,0.007),特异性相似。结论:血浆miRNA-155和miRNA-625可作为分子标志物用于临床诊断NSCLC。
非小细胞肺癌;miRNA-155;miRNA-625;血浆;诊断
肺癌是导致全球癌症死亡的最主要原因,每年因肺癌死亡的人数超过100万,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占80%以上,包括腺癌、鳞癌和大细胞癌。尽管近年来在肺癌影像学检查及靶向治疗等方面取得了较大进展,但NSCLC5年总生存率仍不足15%[1]。缺乏有效的早期诊断是NSCLC预后不佳的主要原因。多数患者在临床确诊时已属中晚期,失去了根治性手术的机会。胸片和CT等检查特异度低,而现有的血液肿瘤标志物对于肺癌诊断的敏感度较低,缺乏早期诊断的效能。因此,探寻高敏感度和高特异度的标志物成为肺癌早期诊断及治疗的迫切需求。近来研究表明,一些特定的microRNAs(miRNAs)与肺癌的发生发展密切相关,在肺癌的发生过程中起促癌或抑癌作用,可作为肺癌诊断和治疗的靶点。
miRNA是长度为21~25 nt的RNA分子,可特异性识别靶mRNA并调控编码基因的表达,通过促进mRNA降解或抑制基因转录进而影响mRNA在转录和转录后水平的表达。miRNA参与调节多种生物学过程,如细胞分化、增殖、代谢和凋亡等[2-3]。研究发现,不同的肿瘤具有不同的miRNA表达谱,某些miRNAs还可在某一种肿瘤中特异性表达[4]。此外,机体的各种体液中,包括血浆、痰液、胸液等等,有大量可检测的细胞外miRNAs,其稳定存在且不易被RNA酶降解,使得miRNA作为肺癌的诊断和预后评估的分子标志物成为可能[5]。
本研究结合肺癌组织中miRNA表达的相关文献报道,采用实时荧光定量PCR法测定49例NSCLC患者及55例肺部良性疾病患者血浆中miRNA-155及miRNA-625的表达,并评价其诊断NSCLC的临床价值。
1 对象和方法
1.1 研究对象
选择2012年6月至2014年6月在江苏大学附属医院及解放军第101医院呼吸内科住院的NSCLC患者,共49例,均为未接受过任何抗肿瘤治疗的新发初诊病例,肺部转移性肿瘤患者除外。所有入选患者均经病理组织学(组织标本取自纤维支气管镜活检、经皮肺穿刺针吸活检、淋巴结活检以及手术切除)检查确诊为NSCLC。其中,鳞癌23例,腺癌26例;男41例,女8例;年龄38~81岁,平均年龄63岁。依据国际抗癌联盟(UICC)2002年制定的TNM分期标准,Ⅰ期7例、Ⅱ期5例、Ⅲ期18例、Ⅳ期19例。另选择同期住院的55例肺部良性疾病者作为对照,包括肺炎24例,慢性阻塞性肺病10例,支气管扩张7例,肺结核4例,间质性肺病4例,肺囊肿2例,支气管哮喘、炎性假瘤、肺神经鞘瘤和肺脓肿各1例。为评价研究结果的稳定性,同时选取健康志愿者21例血标本作为对照(样本miRNA校对值)。
1.2 方法
1.2.1 标本收集 用枸橼酸钠抗凝管收集患者外周血4 mL,4℃放置不超过4 h,2 500 r/min离心10 min,留取血浆。用去核酸酶的1.5 mL EP管分装,每管600μL,-80℃长期冻存。另将采集血标本的一部分送医院医学检验科测定血清癌胚抗原,根据试剂盒说明书标示,癌胚抗原的正常上限为5 μg/L。
1.2.2 RNA提取 采用美国Ambion公司的mir-VanaPARIS Kit(AM1556),按照说明书要求取600 μL血浆提取总RNA,用U-2800紫外分光光度仪测定其浓度及纯度,-80℃保存。
1.2.3 cDNA的合成 采用日本TaKaRa公司的反转录试剂盒(RR037A),按照锐博公司miRNA茎-环结构引物的使用说明书,取2μg总RNA(体积最大为9μL)、RT引物工作液2μL和无RNA酶水定容至11μL,混匀,瞬时离心,70℃放置10 min,冰上孵育2 min,再依次加入5×PrimeScript缓冲液7μL、PrimeScript反转录酶混合液Ⅰ1μL和无RNA酶水6μL,于PCR仪42℃孵育60 min,70℃孵育10 min,反应结束后立即将cDNA产物取出,冰上冷却,于-20℃保存备用。
1.2.4 实时荧光定量PCR 采用日本TaKaRa公司的实时荧光定量PCR试剂盒SYBR Premix Ex TaqTM(RR420A),按照锐博公司的miRNA茎-环结构引物的使用说明书,依次加入SYBR荧光染料混合液9μL、反转录产物2μL、ROX校正染料Ⅱ0.4 μL、上游引物和下游引物各0.8μL(miR-625各0.5 μL),最后用无RNA酶水配成20μL的PCR反应体系。循环参数:95℃20 s,95℃10 s,60℃20 s,共40个循环。以U6作为内参基因,用Mx3000p定量PCR仪得到Ct值。应用2-△△Ct的方法计算所测血浆标本miR-155和miR-625的相对表达量。
1.3 统计学分析
用SPSS 17.0软件进行统计学处理,所有计量数据均经正态性检验,以均数±标准差(±s)表示,两组间均数比较采用t检验。计数数据的比较采用χ2检验。P<0.05为差异有统计学意义。构建受试者工作特征(ROC)曲线,通过计算出的ROC曲线下面积评估两类血浆miRNAs水平对NSCLC的诊断效能,并通过计算敏感度、特异度、阳性预测值、阴性预测值及准确性来评价其在NSCLC诊断中的临床价值。
2 结果
2.1 血浆中miRNA-155和miRNA-625的表达水平
NSCLC患者血浆中miRNA-155相对表达量明显高于肺良性疾病患者,而miRNA-625的表达水平则明显低于肺良性疾病者(P均=0.000)。NSCLC患者血清癌胚抗原水平明显高于肺良性疾病者(P=0.002),见表1。
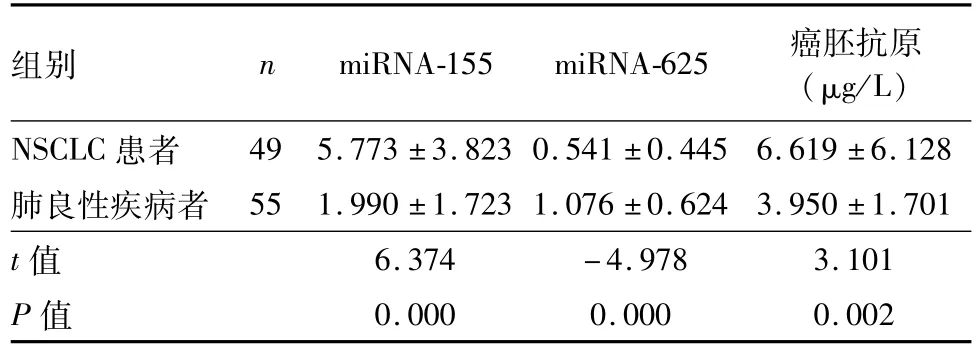
表1 两组患者血浆中不同标志物的表达水平
2.2 NSCLC患者血浆中miRNA-155和miRNA-625表达与临床病理特征的关系
Ⅲ期和Ⅳ期NSCLC患者血浆中miRNA-155的表达水平明显高于Ⅰ期和Ⅱ期患者(P=0.008),而miRNA-625的表达水平则明显低于Ⅰ期和Ⅱ期患者(P=0.025),表明两类分子标志物的水平与患者肿瘤的TNM分期相关。同时miRNA-625的表达水平与患者性别相关(P=0.024),但未发现与其他临床病理学特征存在相关性。miRNA-155的表达水平与患者的年龄、性别、吸烟状况、肿瘤的组织学类型及分化程度均无相关性,见表2。
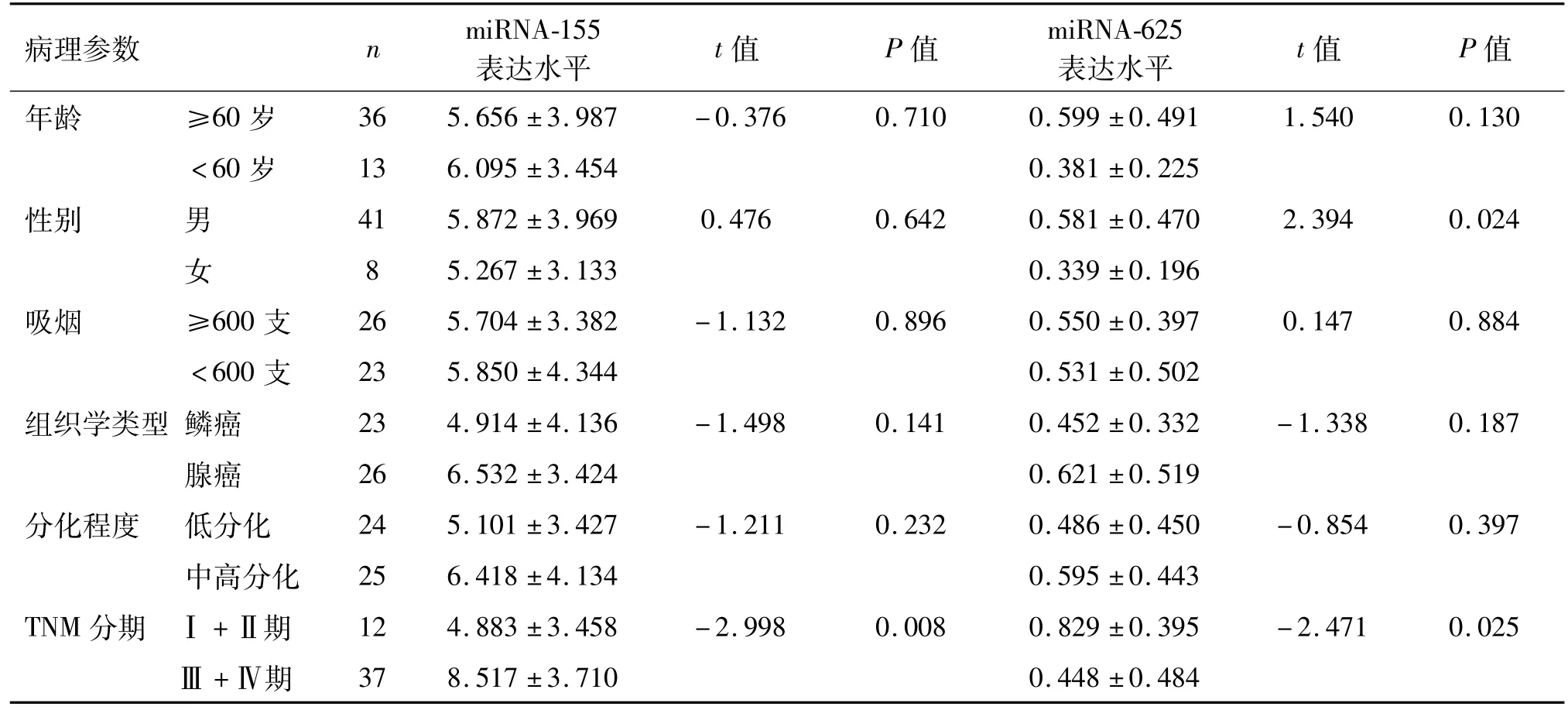
表2 NSCLC患者血浆m iRNA-155和m iRNA-625水平与临床病理特征的关系
2.3 血浆miRNA-155和miRNA-625检测对NSCLC的诊断效能
ROC曲线分析结果显示,血浆miRNA-155诊断NSCLC的曲线下面积(AUC)为0.835(SE=0.039,95%CI=0.759~0.911),取2.736为诊断NSCLC的临界值,其敏感度和特异度分别为75.5%和 74.5%。血浆miRNA-625诊断NSCLC的AUC为0.781(SE=0.046,95%CI=0.690~0.871),取0.699为miRNA-625诊断NSCLC的临界值,诊断敏感度和特异度分别为73.4%和70.9%。由此可见,这两类血浆miRNAs表达水平对NSCLC具有较高的诊断效能,见图1、图2。

图1 血浆m iRNA-155 ROC曲线

图2 血浆m iRNA-625 ROC曲线
2.4 血浆miRNA-155和miRNA-625检测与血清癌胚抗原检测的比较
由表3可见,血浆miRNA-155和miRNA-625诊断NSCLC的特异性与血清癌胚抗原相似,但诊断敏感性明显高于血清癌胚抗原(P=0.004,0.007)。联合血浆miRNA-155和miRNA-625的串行试验可提高诊断特异度,并行试验可提高诊断的敏感度。
3 讨论
肿瘤标志物的检测在肿瘤的普查、高危人群随访观察、早期诊断、评估疗效、判断病情预后和转归等方面有较大的应用价值。目前较常见的肿瘤标志物包括肿瘤抗原、酶类、激素类、多胺类、癌基因产物等,但因敏感性和特异性不高,临床应用效果还存在着明显不足。miRNA的研究是肿瘤分子生物学领域中发展最快的项目之一,其通过基因转录后水平调控,在细胞增殖、分化、凋亡及个体发育等生命过程中起重要作用。miRNA不仅在组织中表达,而且血浆或血清中的含量亦十分丰富,其以受保护的状态存在于血浆或血清中,且不易被RNA酶降解,故可直接从血浆或血清标本中检测出[4-5]。Chen等[6]发现NSCLC患者血清中miRNA表达谱与健康者存在较大差异,与健康对照者比较,NSCLC患者血清中有28种miRNAs缺失,但有63种新的miRNAs可测出。此外NSCLC患者的血清miRNA表达谱与血细胞明显不同,有57种miRNAs同时存在于血清和血细胞中,另有76种miRNAs仅存在于NSCLC患者血清中。而健康者血清miRNA表达谱与血细胞基本相同[7],因此,血标本miRNA检测在NSCLC诊断中的价值引起了人们的关注。
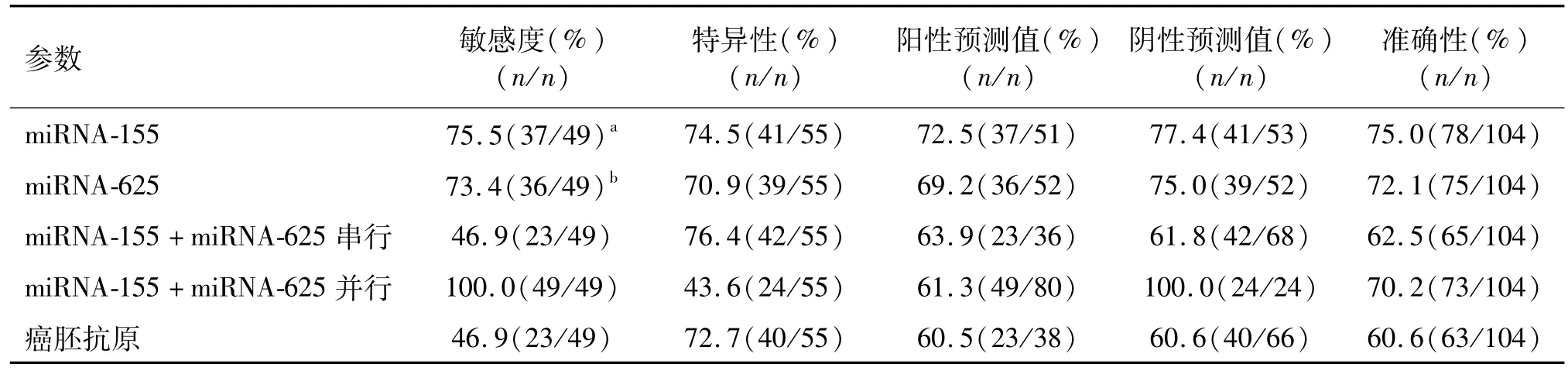
表3 血浆m iRNA-155、m iRNA-625和血清癌胚抗原检测诊断NSCLC的评价
miRNA-155位于人21号染色体上BIC基因的第3个外显子内。Lagos-Quintana等[7]在小鼠的mRNA克隆研究中发现,BIC转录本的小种系保守区域编码miRNA-155。miRNA-155在人B细胞淋巴瘤、胰腺癌、乳腺癌、肺癌、甲状腺癌等恶性肿瘤中高表达,常预示预后不良[8-11]。Yanaihara等[3]采用基因芯片微量测定法分析104对原发肺癌组织和肺癌旁正常组织标本,发现两组标本中有43种miRNA存在表达差异,miRNA-155在肺癌组织标本中表达上调;用荧光定量PCR法进一步分析miRNA-155表达与肺癌患者生存期的关系,结果显示miRNA-155高表达者的总生存期明显缩短,提示肺癌组织miRNA-155表达可作为肺癌诊断与预后判断的标志物。Wang[12]等采用纳米技术测定血浆中miRNA-155表达,发现肺癌患者血浆miRNA-155含量明显高于健康对照者。Zheng等[13]研究了一组肺癌(包括NSCLC、小细胞肺癌及类癌)患者血浆中miRs表达,结果显示miR-155、miR-197和miR-182在肺癌组织中呈高表达,在各期肺癌患者血浆中的水平均较无癌对照者明显升高。联合这3类血浆miRNAs测定鉴别诊断肺癌与无癌对照者的敏感度和特异度为81.33%和86.76%;研究同时发现合并有转移的肺癌患者血浆miR-155和miR-197水平明显高于无转移者,接受化疗后获临床效果者miR-155和miR-197水平明显下降。Roth等[14]研究发现,肺癌患者血清中miR-10b、miR-34a、miR-141、miR-155的表达水平高于良性肺病患者和健康对照者,其中miR-155鉴别肺癌患者与良性肺病者和健康对照者的AUC分别为0.823和0.858。本研究结果显示,NSCLC患者血浆miR-155水平明显高于良性肺病患者,鉴别两者的AUC为0.835,同时血浆miR-155水平与NSCLC患者临床分期呈相关性,Ⅲ、Ⅳ期患者表达水平明显高于Ⅰ、Ⅱ期患者,与上述报道结果相符。
刘楠启等[15]的研究显示结直肠癌组织中miRNA-625表达明显低于癌旁正常黏膜组织,其低表达与结直肠癌的淋巴结和肝转移密切相关,且5年生存率低于miRNA-625高表达者。Wang等[16]研究显示,与癌旁非肿瘤组织和正常胃黏膜上皮细胞株比较,胃癌患者肿瘤组织和胃癌细胞株中miRNA-625表达明显下降,且miRNA-625低表达患者淋巴结转移率高,进一步的体内外实验证明miRNA-625能抑制胃癌细胞的侵袭和转移能力。Roth等[17]研究发现肺癌患者血清miRNA-625水平明显低于良性肺病患者和健康对照者。此外,大细胞肺癌和吸烟患者血清中miRNA-625水平明显低于腺癌和不吸烟患者。本研究亦显示NSCLC患者血浆中miRNA-625水平明显低于良性肺病患者,用于诊断NSCLC的AUC为0.781,与Roth等[17]结果相似。本研究中miRNA-625的表达与患者临床分期及性别相关,而与年龄、吸烟、肿瘤组织学类型及分化程度无相关性。导致两个研究结果部分差异的原因尚不清楚,可能与入组病例不同(本研究组无大细胞肺癌)、标本类型、实验方法差异相关。
本研究同时比较了血浆miRNA-155、miRNA-625和血清癌胚抗原诊断NSCLC的敏感度和特异度,在特异度相似的前提下,miRNA-155和miRNA-625的敏感度明显高于癌胚抗原,提示这两类血浆miRs有可能成为诊断NSCLC新的标志物。此外,必须认识到诊断NSCLC的金标准仍是病理组织学和细胞学,血液肿瘤标志物尚不能作为确诊依据。然而,循环miRNA能够在出现临床症状或确诊之前在分子水平发出预警,可为进一步检查指明方向。高特异度及敏感度的肿瘤标志物结合影像学等检查,将进一步提高肺癌筛查和诊断的效果。
[1] Juergens RA,Brahmer JR.Adjuvant treatment in nonsmall cell lung cancer:Where are we now?[J].JNatl Compr Canc Netw,2006,4(6):595-600.
[2] He L,Hannon GJ.MicroRNAs:small RNAswith a big role in gene regulation[J].Nat Rev Genet,2004,5(7):522-531.
[3] Yanaihara N,Caplen N,Bowman E,et al.UniquemicroRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9(3):189-198.
[4] Barbarotto E,Schmittgen TD,Calin GA.MicroRNAs and cancer:profile,profile,profile[J].Int JCancer,2008,122(5):969-977.
[5] Ferracin M,Veronese A,Negrini M.Micromarkers:miRNAs in cancer diagnosis and prognosis[J].Expert Rev Mol Diagn,2010,10(3):297-308.
[6] Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[7] Lagos-Quintana M,RauhutR,Yalcin A,etal.Identification of tissue-specific microRNAs from mouse[J].Curr Biol,2002,12(9):735-739.
[8] Kluiver J,van den Berg A,de Jong D,et al.Regulation of pri-microRNA BIC transcription and processing in Burkitt lymphoma[J].Oncogene,2007,26(26):3769-3776.
[9] Nikiforova MN,Tseng GC,Steward D,et al.MicroRNA expression profiling of thyroid tumors:biological significance and diagnostic utility[J].JClin Endocrinol Metab,2008,93(5):1600-1608.
[10] Lee EJ,Gusev Y,Jiang J,etal.Expression profiling identifiesmicroRNA signature in pancreatic cancer[J].Int JCancer,2007,120(5):1046-1054.
[11] Habbe N,Koorstra JB,Mendell JT,et al.MicroRNA miR-155 is a biomarker of early pancreatic neoplasia[J].Cancer Biol Ther,2009,8(4):340-346.
[12] Wang Y,Zheng D,Tan Q,et al.Nanopore-based detection of circulatingmicroRNAs in lung cancer patients[J].Nat Nanotechnol,2011,6(10):668-674.
[13] Zheng D,Haddadin S,Wang Y,etal.PlasmamicroRNAs as novel biomarkers for early detection of lung cancer[J].Int J Clin Exp Pathol,2011,4(6):575-586.
[14] Roth C,Kasimir-Bauer S,Pantel K,etal.Screening for circulating nucleic acids and caspase activity in the peripheral blood as potential diagnostic tools in lung cancer[J].Mol Oncol,2011,5(3):281-291.
[15] 刘楠启,孟胜男,刘莹.结直肠癌中microRNA-625表达的临床意义[J].世界华人消化杂志,2013,21(29):3158-3162.
[16] Wang M,Li C,Nie H,et al.Down-regulated miR-625 suppresses invasion and metastasis of gastric cancer by targeting ILK[J].FEBS Lett,2012,586(16):2382-2388.
[17] Roth C,Stückrath I,Pantel K,etal.Low levels of cellfree circulating miR-361-3p and miR-625*as bloodbased markers for discriminating malignant from benign lung tumors[J].PLoSOne,2012,7(6):e38248.
Clinical utility of plasma m iRNA-155 and m iRNA-625 detection in the diagnosis of non-small cell lung cancer
FEILin1,LIJian1,ZHU Li-huan1,LIN Jie2,HE Qin2
(1.Department of Respiratory Medicine,the Affiliated Hospital of Jiangsu University,Zhenjiang Jiangsu 212001;2.Department of Clinical Laboratory,the Liberation Army 101 Hospital,Wuxi Jiangsu 214001,China)
Objective:To evaluate the clinical utility of plasmamiRNA-155 and miRNA-625 expression asmolecularmarkers in the diagnosis of non-small cell lung cancer(NSCLC).M ethods:Fluorescent quantitative RT-PCR was used to detect the expressions ofmiRNA-155 and miRNA-625 in plasma samples from 49 patientswith NSCLC and 55 patientswith benign lung disease(BLD).Receiver operating characteristics(ROC)curves of the twomiRNAs were constructed to assess diagnostic power for NSCLC.The sensitivity and specificity of plasma miRNA-155 and miRNA-625 expression for diagnosing NSCLC were calculated,and compared with serum carcinoembryonic antigen(CEA).Results:The plasma miRNA-155 levels in NSCLC patientswere significantly higher than those in BLD patients(P=0.000),whereas the plasmamiRNA-625 levels in NSCLC patientswere significantly lower than those in BLD patients(P=0.000).For patientswith NSCLC,the plasmamiRNA-155 and miRNA-625 expression levelswere significantly correlated with tumor clinical(TNM)stage(P=0.008 and P=0.025,respectively).In addition,plasma miRNA-625 levelswere also correlated with NSCLC patient gender(P=0.024).No correlation was found between the plasmamiRNA-155 and miRNA-625 levels and other clinicopathologic characteristics.According to the ROC curve analysis,cut-off values of plasmamiRNA-155 and miRNA-625 levels in differentiating NSCLC from BLD were defined as2.736 and 0.699,respectively.For the diagnosis of NSCLC,the sensitivity andspecificity was 75.5%and 74.5%formiRNA-155,73.4%and 70.9%for miRNA-625,respectively.The sensitivity of CEA was inferior tomiRNA-155 and miRNA-625(P=0.004 and P=0.007),although the CEA specificity was similar to the twomiRNAs for diagnosing NSCLC.Conclusion:PlasmamiRNA-155 and miRNA-625 expression might be used as themolecularmarkers for the diagnosis of NSCLC.
non-small cell lung cancer;miRNA-155;miRNA-625;plasma;diagnosis
R734.2 [文献标志码] A [文章编号] 1671-7783(2015)03-0236-05
10.13312/j.issn.1671-7783.y150002
费玲(1983—),女,硕士研究生;李坚(通讯作者),教授,主任医师,博士生导师,E-mail:lijian541226@163.com
2015-01-06 [编辑] 刘星星
