非编码RNA AsrC对巨噬细胞中伤寒沙门菌生存能力的影响
2015-08-08张琪杨如月徐蓉严蓉于佳慧印赟翟培珺张盈黄新祥
张琪,杨如月,徐蓉,严蓉,于佳慧,印赟,翟培珺,张盈,黄新祥
(江苏大学医学院生物化学研究室,江苏镇江212013)
非编码RNA AsrC对巨噬细胞中伤寒沙门菌生存能力的影响
张琪,杨如月,徐蓉,严蓉,于佳慧,印赟,翟培珺,张盈,黄新祥
(江苏大学医学院生物化学研究室,江苏镇江212013)
目的:研究伤寒沙门菌非编码RNA AsrC对其在巨噬细胞中生存能力的影响及机制。方法:用AsrC高表达菌株和空质粒对照株分别感染巨噬细胞12,24 h,检测伤寒沙门菌在感染细胞中的生存能力;qRT-PCR检测asrC、rseC、rpoE mRNA的表达水平;蛋白质印迹检测自噬标志蛋白LC3的表达。结果:与空质粒对照株相比,AsrC高表达菌株感染巨噬细胞12,24 h后在巨噬细胞中的生存能力明显下降(P均<0.01),asrC mRNA表达水平增加(P均<0.05),对侧靶基因rseC mRNA的表达水平增高(P均<0.05),而rpoE mRNA的表达水平无明显变化(P>0.05);AsrC高表达菌株自噬标志蛋白LC3的表达与空质粒对照株间的差异无统计学意义(P>0.05)。结论伤寒沙门菌非编码RNA AsrC高表达可降低其在巨噬细胞中的生存能力,可能与自噬无直接关系。
伤寒沙门菌;非编码RNA;AsrC;胞内生存;自噬
在沙门菌侵入过程中,巨噬细胞作为机体重要的免疫细胞迅速作出反应,通过多种杀伤机制杀灭沙门菌;与此同时,沙门菌通过致病岛2编码的Ⅲ型分泌系统分泌一系列效应蛋白发挥调节作用从而得以在巨噬细胞中存活[3]。
自噬是机体的一种正常生理机制,作为一种新的细胞程序性死亡,在胞内病原菌感染中的作用受到广泛关注[4]。伤寒沙门菌侵入宿主细胞后,一部分在含沙门菌的囊泡(Salmonella-containing vacuoles,SCVs)中进行复制,一部分破坏SCVs后进入细胞质,与泛素化蛋白协同复制,还有一部分迅速被自噬系统识别,形成自噬溶酶体从而被杀死。损坏的SCV也有一个特殊的溶酶体修复机制,进入其中的病原菌最终也被杀死。自噬可限制病原菌在宿主细胞中的生长和增殖,保护宿主免受病原菌的感染[5]。目前,关于自噬与胞内病原菌感染关系的研究还比较少。
近来发现病原菌中许多非编码RNA(non-coding RNA,ncRNA)在致病过程中起重要作用[6-7],大部分是通过与靶mRNA形成碱基配对来发挥调节作用[8-9]。最近,我们通过高通量深度测序技术在伤寒沙门菌中初步发现了一个顺式编码的反义RNA,长893 nt,位于rseC的互补链上,将其命名为AsrC。本文旨在研究AsrC对伤寒沙门菌胞内生存能力的影响及相关机制。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 伤寒沙门菌野生株S.Typhi GIFU 10007由日本岐阜大学医学院微生物学教研室馈赠,高表达载体pBAD/Myc-His A购自Invitrogen公司。空质粒对照株和AsrC高表达菌株由本实验室制备保存。
1.1.2 主要试剂 L-阿拉伯糖、DNA酶Ⅰ、RNA酶抑制剂、PrimeScript®反转录试剂盒、SYBR®荧光定量试剂盒均为TaKaRa公司(大连)产品;Trizol试剂购自美国Invitrogen公司;氨苄西林、庆大霉素、佛波乙酯、ECL显色液购自Sigma公司;胎牛血清、RPMI 1640培养基购自Gibco公司;LC3、β-肌动蛋白抗体购自Cell Signaling公司;特异性引物由上海生工生物工程技术服务有限公司合成。
1.1.3 主要仪器 PCR扩增仪:Mastercycler Personal(Eppendorf公司);凝胶成像系统:GENE GENIUSBIO IMAGING SYSTEM;实时荧光定量PCR仪:C1000 Thermal Cycler(Bio-Rad公司)。
[14]Le Hong Hiep,Living next to the Giant: the Political Economy of Vietnam’s Relations with China under Doi Moi, Singapore: ISEAS Publishing, 2017, p.10.
1.2 方法
1.2.1 引物合成 实时定量RT-PCR(qRT-PCR)所用引物均由上海生工生物技术公司合成,相关序列见表1。
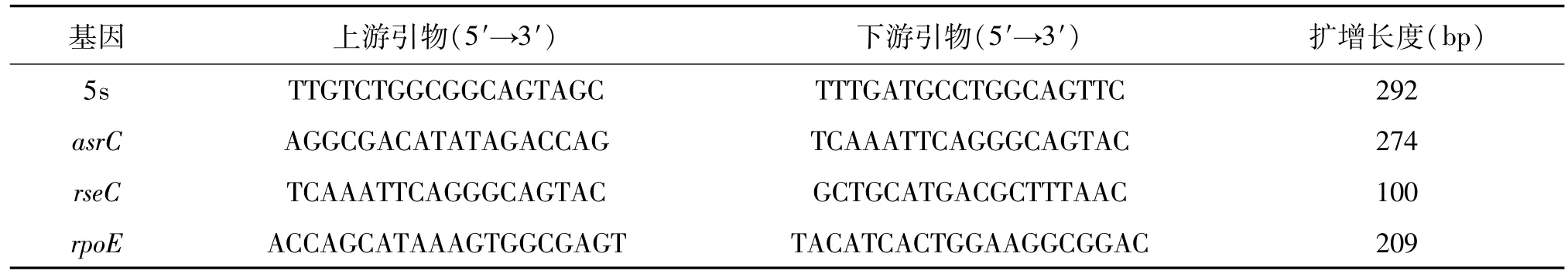
表1 qRT-PCR所用引物
1.2.2 巨噬细胞胞内生存实验 将巨噬样细胞按5×105/mL接种于24孔细胞培养板中,加入15μL佛波乙酯稀释液(150 ng/mL)诱导分化48 h,贴壁细胞即为巨噬细胞,诱导率约为70%。挑取AsrC高表达菌株和空质粒对照株的单克隆分别接种于2 mL LB液体培养基中,37℃、250 r/min培养过夜;次日按1∶100转接到20 mL新鲜LB液体培养基,以同样条件培养细菌至对数期[D(600 nm)=0.4];加入200μL阿拉伯糖(200 mg/mL)继续诱导1 h;向细胞中加入AsrC高表达菌或空质粒对照菌(MOI为10),3.5×105/孔,于37℃、5%CO2培养箱内培养1 h;加入100μg/mL庆大霉素作用1 h以杀死胞外菌,PBS洗3次。一部分细胞加入0.5%Triton(v/v)裂解,反应10 min后涂于LB平板,过夜培养后计算单克隆数,以T0表示基础细菌吞噬水平;另一部分细胞继续培养12或24 h,以相同方法计算单克隆数,以T12或T24表示胞内细菌增殖水平。
1.2.3 总RNA提取和反转录 AsrC高表达菌株和空质粒对照株按照巨噬细胞胞内生存实验作用细胞0,2,12 h,用Trizol法分别提取总RNA,DNA酶Ⅰ消化残余DNA(37℃,30 min),核酸检测仪检测RNA,确定其浓度,取10μg RNA样品反转录为cDNA。
1.2.4 qRT-PCR 以反转录后cDNA为模板,参照文献[10],检测相应基因,以5S rRNA为内参,用于相应基因表达水平的相对定量。
1.2.5 蛋白质印迹法检测LC3蛋白 AsrC高表达菌株和空质粒对照株分别作用细胞1,3,5,18 h,细胞裂解液裂解,收集细胞总蛋白,核酸检测仪检测蛋白浓度,以相同的总蛋白量煮沸变性后进行SDS-聚丙烯酰胺凝胶电泳、转膜、封闭后孵育抗体,化学发光仪曝光,检测自噬标志蛋白LC3的表达。
1.3 统计学分析
采用SPSS 16.0软件对所有数据进行统计分析,两组间均数比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 巨噬细胞胞内生存实验
感染细胞12,24 h后,空质粒对照株胞内细菌水平分别为初始水平的12.7倍,7.5倍;AsrC高表达菌株胞内细菌水平分别为初始水平的9.8倍和5.5倍(图1)。与空质粒对照株相比,感染12,24 h时,AsrC高表达菌株的细菌水平明显降低(t= 6.57,5.02,P均<0.01)。空质粒对照株和AsrC高表达菌株在感染细胞24 h后,胞内细菌水平均较12 h降低(t=11.59,9.14,P均<0.01)。结果表明,AsrC的高表达可减弱伤寒沙门菌在巨噬细胞内的生存和增殖能力。
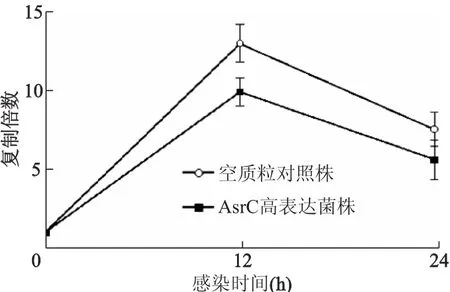
图1 伤寒沙门菌在巨噬细胞内的生存力比较
2.2 AsrC高表达菌株感染后巨噬细胞内asrC mRNA的表达
将空质粒对照株感染细胞0 h时asrC mRNA水平设为初始水平,用1表示,其感染巨噬细胞2,12 h后,asrC mRNA水平分别是初始水平的2.8和0.9倍;AsrC高表达菌株感染巨噬细胞0,2,12 h后,asrC mRNA水平分别是初始水平的5.2,3.9和3.9倍。感染0,2,12 h时,AsrC高表达菌株中asrC mRNA水平较空质粒对照株明显增加(t=38.26,4.17,16.45,P均<0.05)。由此说明,AsrC的高表达在巨噬细胞内持续发挥效应。见图2。

图2 不同菌株感染后细胞内asrC mRNA的表达水平
2.3 AsrC高表达菌株感染巨噬样细胞后对rseC mRNA和rpoE mRNA稳定性的影响
将空质粒对照株感染细胞0 h时rseC mRNA水平设为初始水平,用1表示,其感染巨噬细胞2,12 h后,rseC mRNA水平分别为初始水平的0.9倍和0.7倍,AsrC高表达菌株在感染巨噬细胞0,2,12 h后rseC mRNA的水平为初始水平的2.5,2.9和2.2倍。在感染巨噬细胞0,2,12 h时,与空质粒对照株比较,AsrC高表达菌株rseC mRNA表达明显上调(t =25.27,32.81,11.06,P均<0.001)。见图3。
将空质粒对照株感染细胞0 h时rpoE mRNA水平设为初始水平,用1表示,其感染细胞2,12 h后,rpoE mRNA水平分别为初始水平的0.89倍和0.93倍,AsrC高表达菌株在感染细胞0,2,12 h后,rpoE mRNA水平分别为初始水平的0.91,1.15,0.88倍。在感染巨噬细胞0,12 h时,空质粒对照株rpoE mRNA表达与AsrC高表达菌株间的差异无统计学意义(t=1.72,0.47,P>0.05)。在感染2 h时AsrC高表达菌株rpoE表达较空质粒对照株上调(t=6.71,P<0.001)。结果表明,随着感染时间的延长,巨噬细胞内AsrC的高表达可增加对侧靶基因rseC mRNA的表达,而对rpoE mRNA的表达无明显影响。见图4。
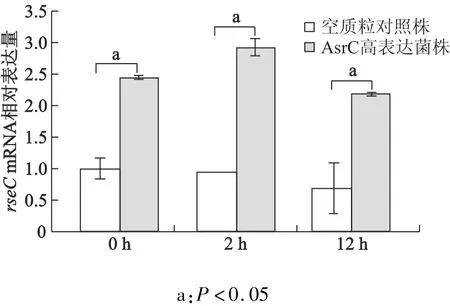
图3 不同菌株感染后细胞内rseC mRNA的表达水平

图4 不同菌株感染后细胞内rpoE mRNA的表达水平
2.4 AsrC对LC3蛋白表达的影响
AsrC高表达株与空质粒对照株在相同感染时间LC3-Ⅱ的表达差异均无统计学意义(t1=1.41,t3=0.88,t5=2.77,t18=2.71,P均>0.05),说明AsrC高表达后,伤寒沙门菌空质粒对照株和AsrC高表达菌株在巨噬细胞内生存能力的差异与自噬无相关性。见图5。

图5 自噬标志蛋白LC3在不同菌株中的表达
3 讨论
致病菌在受到各种环境应激时,通过上调一系列相关的基因和调节子(包括许多非编码RNA)的转录和表达,使得自身在千变万化的环境中得以生存。迄今为止,已在致病菌中鉴定出许多非编码RNA,其在基因表达调控方面起重要作用[11]。
沙门菌在感染宿主细胞过程中,会遭受低pH、营养缺乏和氧应激等不同的压力环境应激,其通过大量复制以抵抗环境压力而存活,此为其致病的主要途径。本研究结果显示,AsrC高表达菌株在巨噬细胞内的生存及增殖较空质粒对照株明显降低,可能是沙门菌感染致部分细胞死亡并裂解,胞内的沙门菌释放到胞外被庆大霉素杀死所致。在巨噬细胞内,位于致病岛Ⅱ上的编码基因的转录水平升高,有利于沙门菌的生存和增殖,而与鞭毛合成、趋化性、铁转运系统有关的基因和其他一些致病岛Ⅰ上的编码基因转录水平下调[12]。本研究结果显示,非编码RNA AsrC高表达可降低细菌在巨噬细胞内的存活和复制。
qRT-PCR结果显示,随着感染时间的延长,非编码RNA AsrC在巨噬细胞内持续高表达,说明AsrC高表达在巨噬细胞内持续发挥效应。对侧靶基因rseC mRNA的水平也明显增加,表明rseC反义链的表达可提高rseC mRNA的稳定性,进而促进翻译。与靶mRNA结合调控目的基因的表达,是细菌小RNA发挥作用最为普遍的一种形式。其中,顺式编码的反义RNA位于靶基因的反义链上,通过与靶基因完全互补发挥作用;反式编码的RNA位于靶基因的远端,通过与靶基因不完全的碱基配对发挥作用。有文献报道,许多正义-反义配对体起正向的协同调节表达作用,反义RNA很可能参与维持顺式编码基因mRNA的稳定[13]。本研究中小RNA AsrC的高表达可提高对侧靶基因rseC mRNA的稳定性,与以上报道的正向协同调节表达作用一致。因此,本研究中伤寒沙门菌反义RNA AsrC高表达后影响其在巨噬细胞内的生存能力很可能是rseC mRNA表达增加而引起的。
研究表明RseC高表达增加σE的转录活性,即RseC可正向调控σE的活性[14]。σE参与伤寒沙门菌对高渗透压应激和氧应激等环境应激的应答,进而启动相关基因的转录,对伤寒沙门菌的存活有重要意义[15]。由此推测,AsrC高表达降低伤寒沙门菌在巨噬细胞内的生存能力可能与σE相关。本文结果显示,AsrC高表达对rpoE mRNA的表达无影响,只在感染2 h后有微弱上调作用,表明AsrC高表达降低伤寒沙门菌在巨噬细胞内的生存能力与σE的活性无直接关系,可能与其他生存和复制相关基因的转录变化有关。
自噬在胞内病原菌感染中具有双重性,一方面,自噬作为机体的非特异性免疫防御屏障的重要组成部分,活化后可有效清除病原体;另一方面,某些病原体可修饰或干扰自噬,为自身在宿主细胞内的存活及增殖创造有利条件[16]。因此,我们猜测AsrC高表达降低伤寒沙门菌在巨噬细胞内的生存能力与自噬增强有关。本研究结果显示,空质粒对照株与AsrC高表达株的自噬标志蛋白LC3的表达无明显差别,提示伤寒沙门菌在巨噬细胞内的生存能力可能与自噬无关或无直接相关。
本研究发现伤寒沙门菌非编码RNA AsrC高表达可降低其在巨噬细胞内的生存能力,并且AsrC高表达可增加胞内rseC mRNA的表达水平,胞内生存能力可能与自噬无直接相关,其生存机制有待于进一步研究。
[1] House D,Bishop A,Parry C,et al.Typhoid fever:pathogenesis and disease[J].Curr Opin Infect Dis,2001,14(5):573-578.
[2] Jones BD,Falkow S.Salmonellosis:host immune responses and bacterial virulence determinants[J].Annu Rev Immunol,1996,14:533-561.
[3] Ochman H,Soncini FC,Solomon F,et al.Identification of a pathogenicity island required for Salmonella survival in host cells[J].Proc Natl Acad Sci U S A,1996,93(15):7800-7804.
[4] Yano T,Kurata S.Intracellular recognition of pathogens and autiphagy as innate immunity host defence[J].J Biochem,2011,150(2):143-149.
[5] He C,Klionsky DJ.Regulation mechanisms and signaling pathways of autophagy[J].Annu Rev Genet,2009,43:67-93.
[6] Dadzie I,Xu S,Ni B,et al.Identification and characterization of a cis-encoded antisense RNA associated with the replication process of Salmonella enterica serovar Typhi[J].PLoSOne,2013,8(4):e61308.
[7] Dadzie I,Ni B,Gong M,etal.Identification and characterization of a cis antisense RNA of the parC gene encoding DNA topoisomeraseⅣof Salmonella enterica serovar Typhi[J].Res Microbiol,2014,165(6):439-446.
[8] Brantl S.Regulatorymechanisms employed by cis-encoded antisense RNAs[J].Curr Opin Microbiol,2007,10(2):102-109.
[9] Aiba H.Mechanism of RNA silencing by Hfq-binding small RNAs[J].Curr Opin Microbiol,2007,10(2):134-139.
[10] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTMethod[J].Methods,2001,25(4):402 -408.
[11] Rivas E,Klein RJ,Jones TA,et al.Computational identification of noncoding RNAs in E.coli by comparative genomics[J].Curr Biol,2001,11(17):1369-1373.
[12] Lostroh CP,Lee CA.The Salmonella pathogenicity island-1 typeⅢsecretion system[J].Microbes Infect,2001,3(14/15):1281-1291.
[13] Chinni SV,Raabe CA,Zakaria R,et al.Experimental identification and characterization of 97 novel npcRNA candidates in Salmonella enterica serovar Typhi[J].Nucleic Acids Res,2010,38(17):5893-5908.
[14] Missiakas D,Mayer MP,Lemaire M,etal.Modulation of the Escherichia coliσE(RpoE)heat-shock transcription-factor activity by the RseA,RseB and RseC proteins[J].Mol Microbiol,1997,24(2):355-371.
[15] 杜鸿,倪斌,王敏,等.高渗应激早期伤寒沙门菌RpoE调节因子对基因表达的影响[J].中华预防医学杂志,2011,45(6):564-566.
[16] Glick D,Barth S,Macleod KF.Autophagy:cellular and molecular mechanisms[J].J Pathol,2010,221(1):3-12.
Effect of non-coding RNA AsrC on the intracellular survival of Salmonella enterica serovar Typhi in macrophage
ZHANGQi,YANG Ru-yue,XU Rong,YAN Rong,YU Jia-hui,YIN Yun,ZHAIPei-jun,ZHANG Ying,HUANG Xin-xiang
(Department of Biochemistry,School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To investigate the influence of the non-coding RNA AsrC on the intracellular survival of Salmonella enterica serover Typhi in macrophage and itsmechanism.M ethods:Themacrophages intracellular survival assay was performed in AsrC overexpressing strain and the control strain;qRT-PCR was carried out to determine the transcriptional variation of asrC,rseC,rpoE;the expression of LC3 was detected by Western blotting.Results:Compared with the control strain,infected in 12,24 h,the AsrC in overexpressing strain showed lower intracellular survival in macrophage(both P<0.01),higher levels of asrCmRNAand rseC mRNA(P<0.05),but had no influence on rpoE(P>0.05);Western blot analysis revealed that the expression of LC3 had no significant difference between AsrC overexpressing strain and the control strain(P>0.05).Conclusion:Overexpression of AsrC might decrease the bacterial intracellular survival in macrophage,which might not be dependent on autophagy.
Salmonella enterica serovar Typhi;non-coding RNA;AsrC;intracellular survival;autophagy
R378.22 [文献标志码] A [文章编号] 1671-7783(2015)03-0185-05
10.13312/j.issn.1671-7783.y150070
国家自然科学基金资助项目(81371780);国家自然基金青年科学基金资助项目(31400125);江苏省自然科学基金资助项目(BK20130504)
张琪(1988—),女,硕士研究生;黄新祥(通讯作者),教授,博士生导师,E-mail:huxinx@ujs.edu.cn
2015-03-26 [编辑] 刘星星
