TGF-β1介导NF-κB信号通路抑制横纹肌肉瘤的肌分化
2015-08-08姜珍陈枉枉曹丹黄封博房建凯孙莉孙茂民王守立
姜珍,陈枉枉,曹丹,黄封博,房建凯,孙莉,孙茂民,王守立
(苏州大学医学部1.解剖学教研室暨细胞神经生物学研究室;2.实验动物中心;3.病理学与病理生理学系,苏州江苏215123)
TGF-β1介导NF-κB信号通路抑制横纹肌肉瘤的肌分化
姜珍1,2,陈枉枉1,2,曹丹3,黄封博3,房建凯3,孙莉1,2,孙茂民2,王守立3
(苏州大学医学部1.解剖学教研室暨细胞神经生物学研究室;2.实验动物中心;3.病理学与病理生理学系,苏州江苏215123)
目的:探讨TGF-β1介导NF-κB信号通路抑制横纹肌肉瘤肌分化的分子机制。方法:将构建的TGF-β1siRNA质粒表达系统转染横纹肌肉瘤RD细胞株,通过免疫荧光染色法检测Caspase-3的表达;TUNEL试剂盒检测RD细胞的凋亡;透射电镜检测RD细胞的分化情况;细胞免疫荧光法检测外源性TGF-β1对RD细胞中NF-κB家族成员p65、p50、p52和RelB表达水平的影响;免疫组化S-P法分别检测横纹肌肉瘤石蜡组织中NF-κB家族成员的表达水平。结果:与对照组比较,TGF-β1沉默RD细胞中Caspase3的表达和TUNEL法检测的阳性细胞数量明显增加(P<0.05);电镜结果显示肌丝结构明显增加;在外源性TGF-β1(2 ng/mL)作用6 h后,RD中p65、p50的阳性率和阳性强度均明显高于对照组(P<0.05);p65、p50的表达率在TGF-β1高表达横纹肌肉瘤石蜡组织中明显高于TGF-β1低表达组(P<0.05)。结论:横纹肌肉瘤的分化抑制可能与TGF-β1介导的NF-κB家族成员p65、p50上调有关。
横纹肌肉瘤;TGF-β1;NF-κB;肌分化
横纹肌肉瘤细胞可以产生多种生长因子,如转化生长因子-β1(transforming growth factors-β1,TGF-β1)、胰岛素样生长因子Ⅱ(insulin-like growth factorⅡ,IGFⅡ)、碱性纤维母细胞生长因子和内皮生长因子等,并表达相应受体。其中,TGF-β1与横纹肌肉瘤分化障碍的关系最为密切。本课题组前期的研究结果显示[1],沉默TGF-β1不仅能抑制人横纹肌肉瘤RD细胞的生长,而且能诱导RD细胞分化,外源性TGF-β1不但能刺激其下游分子Smad4表达增高,也能刺激细胞外信号调节激酶(extracellular signalregulated kinase,ERKs)的表达增高[2],提示横纹肌肉瘤高分泌TGF-β1可能通过非Smad途径参与肌分化障碍调控。
根据上述研究基础和近年来关于2-酮戊二酸依赖的双加氧酶超家族(Egl nine homolog 3,EGLN3)等外源性信号激活核转录因子(nuclear factor,NF)-κB的信号通路能抑制成肌细胞分化的研究报道[3-4],我们推测横纹肌肉瘤的分化障碍可能与TGF-β1介导NF-κB信号通路有关。本研究观察了TGF-β1沉默后RD细胞的分化程度与NF-κB家族成员表达水平的相关性,以及横纹肌肉瘤石蜡组织中TGF-β1表达和NF-κB家族成员的表达水平的相关性,以为TGF-β1信号通路参与横纹肌肉瘤分化障碍的形成提供理论依据。
1 材料与方法
1.1 材料
转染介质Lipofectamine 2000(Invitrogen公司);Trizol试剂(Sigma公司);p65、p50、p52、RelB等抗体(Santa Cruz公司);兔抗Caspase-3多克隆抗体和FITC标记山羊抗兔IgG(武汉博士德生物技术公司);一步法TUNEL细胞凋亡检测试剂盒(碧云天生物技术研究所);免疫组织化学S-P试剂盒及DAB显色试剂盒(北京中杉金桥生物技术有限公司);胎牛血清和DMEM分化培养基(Gibico公司);TGF-β1siRNAs表达载体由苏州大学医学部分子病理实验室构建[5];人横纹肌肉瘤RD细胞株(美国ATCC);53例胚胎型横纹肌肉瘤石蜡组织(四川大学华西医学院和苏州大学附属医院)。
1.2 方法
1.2.1 TGF-β1沉默RD细胞系的建立 RD细胞常规培养至细胞生长达到对数期,制备浓度为1× 106/mL RD细胞悬液,以每孔200μL接种于24孔培养板中,再加完全培养基800μL,24 h细胞贴壁后,待其细胞单层铺满80%左右,转染TGF-β1siRNA,37℃,5%CO2常规培养6 h后,更换新鲜完全培养基。
转染的细胞培养24 h后,将G418浓度分别设定为100,200,300,400,500,600,700,800,900和1 000 g/mL,每个浓度重复3个孔。以1周内致使细胞全部死亡的G418最低浓度筛选上述载体转染的RD细胞,2周后挑取细胞克隆于24孔板中扩增,即获得稳定转染的细胞系。
1.2.2 免疫荧光染色法检测TGF-β1沉默RD细胞的凋亡
1.2.2.1 细胞免疫荧光法检测TGF-β1沉默RD细胞中Caspase-3的表达 将上述TGF-β1沉默RD细胞系在分化培养基中培养至细胞达到对数期后,制备细胞悬液(4×104/mL),500μL/孔接种于加有小圆玻片的24孔培养板中。细胞爬片后,取出小圆玻片用预冷的PBS漂洗5 min×3次,4%低聚甲醛4℃固定15 min,0.3%TritonX-100 PBS漂洗5 min,PBS洗5 min×3次,5%BSA封闭30 min。抗体(Caspase-3,1∶150稀释度)滴于Parafilm膜上,夹出玻片正面朝下,倒扣于抗体上,4℃孵育过夜。PBS洗玻片5 min,滴加FITC标记山羊抗兔IgG(1∶100),37℃孵育1 h,PBS洗3×5 min,将小圆玻片倒扣于滴有抗荧光淬灭封片液的载玻片上,封片,荧光显微镜随机视野观察,每张玻片至少观察200个细胞,计数FITC阳性细胞,每次实验都设对照组,并重复3次。
1.2.2.2 TUNEL试剂盒检测RD细胞的凋亡 将上述TGF-β1沉默RD细胞系培养于加有小圆玻片的24孔培养板中,细胞爬片后,取出玻片,PBS洗涤1次,室温晾干,用4%低聚甲醛固定细胞30 min,用PBS洗涤1次,加入含0.1%Triton X-100的PBS,冰浴孵育2 min,用PBS洗涤2次,按照说明书配制适量的TUNEL检测液,充分混匀,在每个小圆玻片上分别加50μL TUNEL检测液(TdT酶2μL,荧光标记液48μL),37℃避光孵育60 min,PBS洗涤3次,用抗荧光淬灭封片液封片后荧光显微镜下观察。每一玻片至少观察200个细胞,计数FITC阳性细胞,每次实验都设对照组,并重复3次。
1.2.3 透射电镜观察RD细胞的肌分化 将上述TGF-β1沉默RD细胞系在分化培养基中培养1周后收集细胞,3%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水,Epon812包埋,超薄切片,醋酸铀及枸橼酸铅双重染色,透射电镜(日立H600型)观察肌丝结构。
1.2.4 免疫荧光检测外源性TGF-β1对NF-κB家族各成员核内表达的影响 将RD细胞接种于含有TGF-β1(2 ng/mL)的DMEM中,6 h后用免疫荧光法检测核内p65、p50、p52和RelB的表达情况,并与对照组比较。具体方法参照“1.2.2.1”。观察NF-κB家族各成员的阳性率和阳性强度,重复3次取均数,应用统计软件分析数据。
1.2.5 免疫组化S-P法检测NF-κB家族各成员蛋白表达水平 根据前期70例横纹肌肉瘤石蜡组织中TGF-β1表达水平的研究结果[6-7],将其中53例胚胎型横纹肌肉瘤分为31例TGF-β1高表达组和22例低表达组。分别检测NF-κB家族成员的蛋白表达,并分析这些蛋白表达与TGF-β1表达的相关性。p65,p50,p52以及RelB抗体的工作浓度为1∶100。具体步骤:将石蜡组织切片脱蜡水化,3%过氧化氢溶液阻断内源性过氧化物酶,枸橼酸缓冲液高压抗原修复,5%正常羊血清封闭非特异性抗原抗体反应,加一抗,37℃孵育30 min,加生物素标记的二抗(1∶200),37℃,30 min,加链霉亲和素 过氧化物酶复合物(1∶200),37℃,30 min,DAB显色,苏木素复染,中性树胶封片。按照每张切片的阳性细胞比例及着色深浅计分,行半定量分析。阳性细胞所占比例判断标准:无细胞着色为0分,1/3以下细胞着色为1分,1/3~2/3细胞着色为2分,2/3以上细胞着色为3分。阳性强度:无着色0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。两项积分相乘:0分为-,1~3分为+,4~6分为++,7~9分为+++;将-、+视为低表达,++、+++视为高表达。
1.3 统计学方法
采用SPSS 10.0软件,两样本率的比较使用χ2检验,两样本均数比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1沉默后RD细胞凋亡明显增加
与对照组比较,TGF-β1基因沉默后的RD细胞中Caspase-3的表达和TUNEL实验的阳性细胞数量明显增加(P<0.05和P<0.01)。见图1。
2.2 TGF-β1沉默RD细胞在分化培养过程中肌丝结构逐渐形成
透射电镜观察结果显示,对照组RD细胞胞质未见明显肌丝结构,而TGF-β1沉默RD细胞在分化培养基中1周后胞质出现明显的肌丝结构(位于细胞核附近),见图2。
2.3 外源性TGF-β1促进RD细胞核内p65、p50的表达
细胞免疫荧光检测结果显示,RD细胞在外源性TGF-β1的刺激下,p65、p50的阳性率和阳性强度均比对照组明显增加(P<0.05),而外源性TGF-β1对RelB、p52的表达无明显影响。见图3。
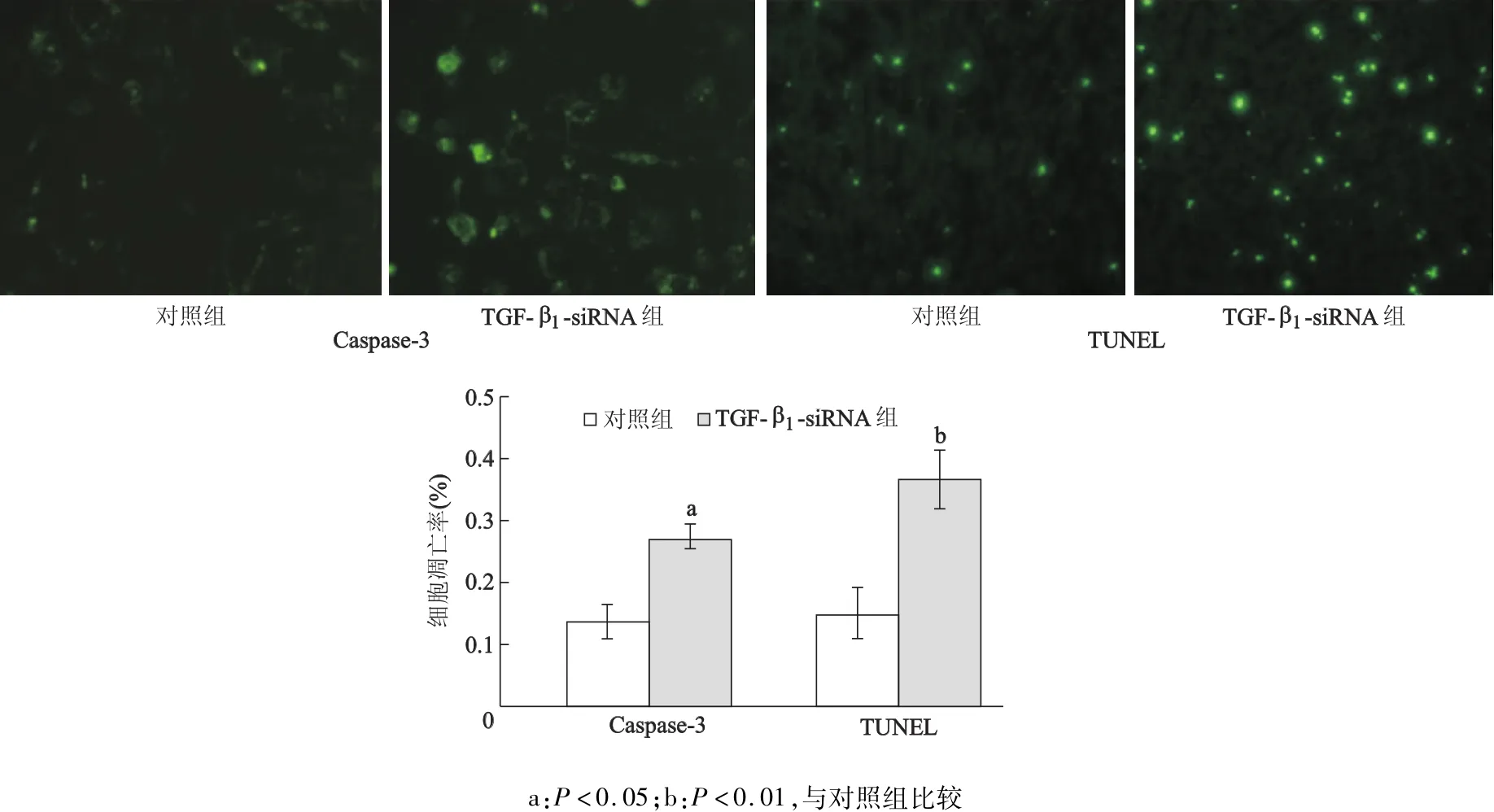
图1 TGF-β1 siRNA促进RD细胞凋亡
2.4 横纹肌肉瘤石蜡组织中NF-κB家族成员蛋白的表达
p65、p50表达率在31例TGF-β1高表达组中分别为71.0%和61.3%,均明显高于22例TGF-β1低表达横纹肌肉瘤标本(27.3%和22.7%)。而RelB和p52蛋白水平在两组中无明显差异(P>0.05),见表1。
3 讨论
横纹肌肉瘤是较常见的软组织恶性肿瘤。形态学或分子遗传学研究都表明,各类型横纹肌肉瘤来自于原始间叶细胞的分化,尽管都不同程度地表达肌转录因子MyoD家族,却不能完成终末分化。由于横纹肌肉瘤低分化类型多见,不仅难以与其他小圆细胞肿瘤相鉴别,而且生长迅速,早期即可发生血道转移,手术治疗往往难以根治。近年来,虽然多种治疗手段的综合应用使得横纹肌肉瘤的治愈率大大提高,但术后肢体的功能限制及化疗药物的毒副作用,大大降低了生存者的生活质量[8-9],寻找新的治疗靶点已成为迫切任务[10]。深入探讨横纹肌肉瘤分化障碍的机制有望为开辟新的治疗途径提供理论依据。
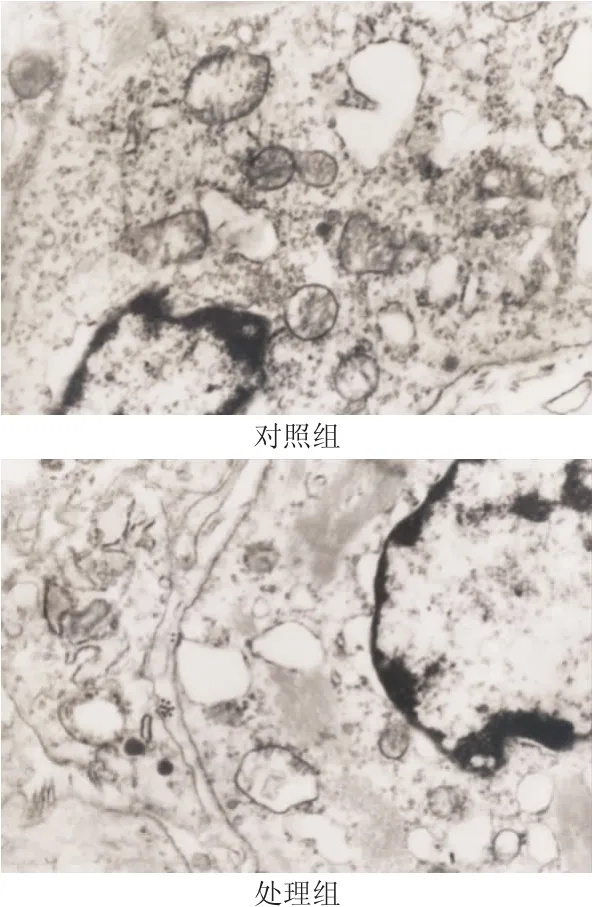
图2 TGF-β1 siRNA促进RD细胞肌分化(电镜×6 000)
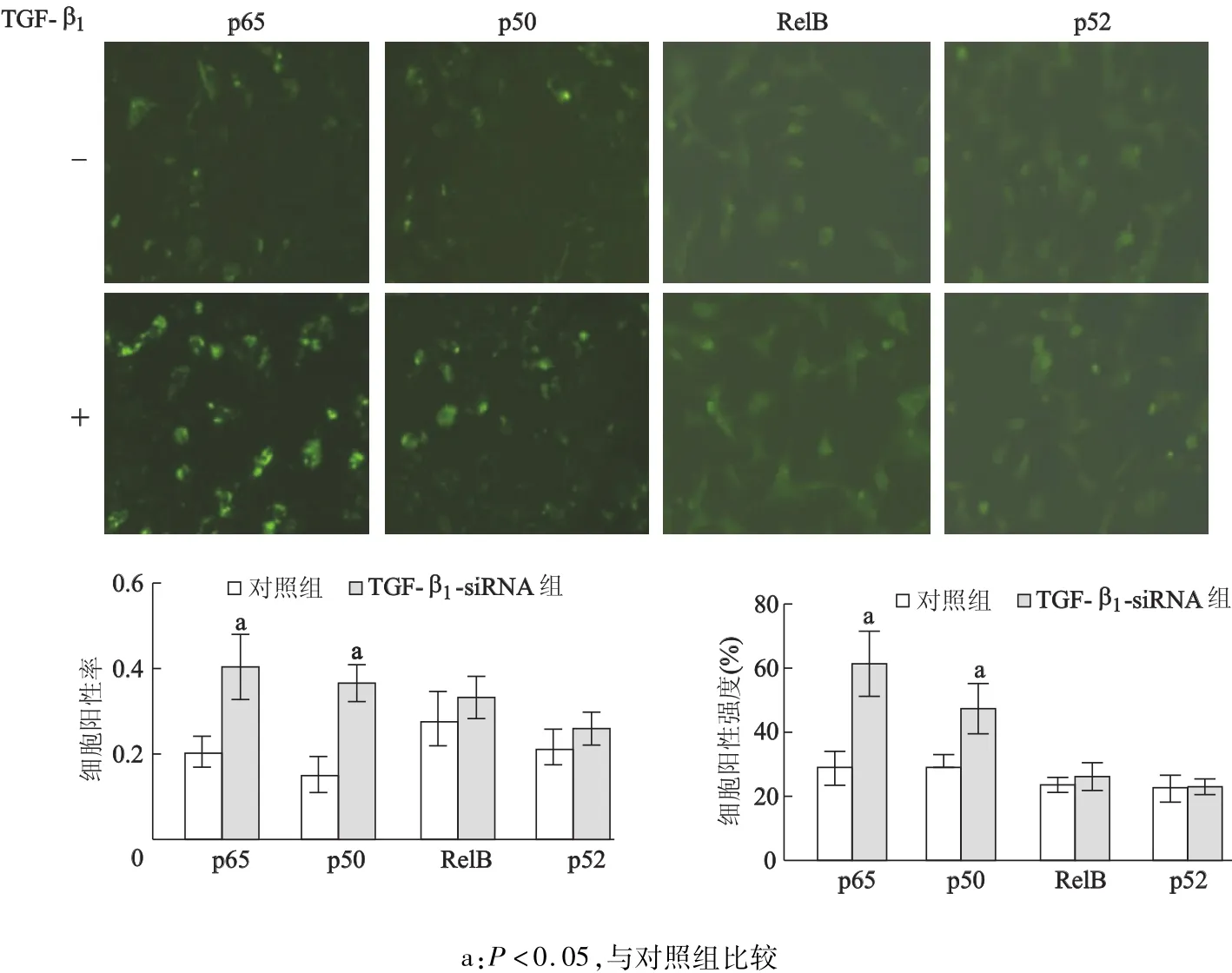
图3 外源性TGF-β1对RD细胞中NF-κB家族成员细胞核内表达的影响
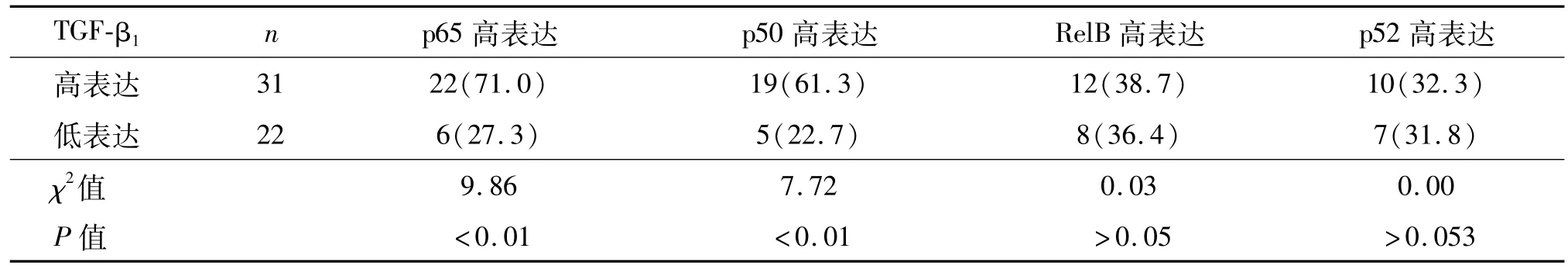
表1 横纹肌肉瘤组织中NF-κB家族各成员高表达与TGF-β1蛋白表达的相关性 例(%)
横纹肌肉瘤细胞可以产生多种生长因子并表达相应受体。若通过佛波醇(TPA)影响TGF-β1的激活,阻断其信号转导可以诱导胚胎型横纹肌肉瘤RD细胞的肌分化[11]。TGF-β1是多肽类生长因子,依细胞类型、生理环境不同,可表现出不同的生物学作用。运用TGF-β1反义寡核苷酸能有效抑制横纹肌肉瘤RD细胞的体内成瘤性[12],提示在横纹肌肉瘤中存在TGF-β1信号通路并可能参与肌分化的调控。本研究的结果显示,TGF-β1沉默后的RD细胞在分化培养1周后Caspase-3的表达和细胞阳性率明显增加,电镜观察可见肌丝结构增加,再次表明沉默TGF-β1可以促进RD细胞的分化。
肌细胞的分化取决于细胞外信号的刺激,如肌原调节蛋白(MyoD1)和肌细胞生成素(Myogenin)能根据成肌细胞所处的不同应激条件适应性调整分化状态[13]。通过脯氨酸羟化酶EGLN3等外源性信号激活NF-κB能抑制成肌细胞的分化[3]。Bakkar等[14]研究发现,NF-κB信号通路在肌分化的过程中可能起到一个分子开关的作用,由此推测横纹肌肉瘤很可能是通过激活NF-κB信号经典途径而抑制肌转录因子MyoD家族的合成,后者的变化导致肌分化相关microRNAs(如miR-29)的合成降低,从而导致肌分化障碍[15]。静息状态下,NF-κB二聚体与抑制性蛋白IκB结合而存在于胞质中,若在外源性信号刺激下通过信号转导激活IκB激酶(IKK)上游的激酶而使IKK活化,活化的IKK再使其底物IκB磷酸化,并进一步降解,NF-κB发生核移位,与靶基因的特异位点结合,从而调控靶基因的转录。TGF-β1可通过非Smad途径即肿瘤坏死因子受体相关因子TRAF-6介导JNK和p38途径的激活[16],而TRAF-6是介导NF-κB信号激活的关键因子[17],提示TGF-β1可能通过TRAF介导NF-κB信号经典通路的激活。最近的研究显示,TGF-β1能通过TAK1/ MEK/NF-κB通路促进骨母细胞的存活[18]。为证实横纹肌肉瘤中TGF-β1与NF-κB信号通路之间可能存在的关系,本研究检测了外源性TGF-β1对横纹肌肉瘤RD细胞株NF-κB信号的影响,结果显示在外源性TGF-β1(2 ng/mL)作用6 h后,RD中p65、p50的阳性率和阳性强度均明显高于对照组。进一步检测31例TGF-β1高表达和22例TGF-β1低表达横纹肌肉瘤石蜡组织,显示p65、p50的高表达率在TGF-β1高表达横纹肌肉瘤石蜡组织中明显高于TGF-β1低表达组,进一步证实了上述推测。
本实验结果表明,横纹肌肉瘤分化的抑制可能与TGF-β1介导NF-κB家族成员p65、p50上调有关,但TGF-β1/NF-κB信号通路与肌转录因子MyoD家族功能状态的关系尚需要进一步研究。
[1] Wang S,Guo L,Dong L,et al.TGF-β1signal pathway may contribute to rhabdomyosarcoma development by inhibiting differentiation[J].Cancer Sci,2010,101(5):1108-1116.
[2] Guo H,Zhang HY,Wang SL,et al.Smad4 and ERK2 stimulated by transforming growth factorβ1in rhabdomyosarcoma[J].Chin Med J(Engl),2007,120(6):515 -521.
[3] Acharyya S,Villalta SA,Bakkar N,et al.Interplay of IKK/NF-κB signaling in macrophages and myofibers promotes muscle degeneration in Duchenne muscular dystrophy[J].J Clin Invest,2007,117(4):889 -901.
[4] Fu J,Taubman MB.Prolyl hydroxylase EGLN3 regulates skeletal myoblast differentiation through an NF-κB-dependent pathway[J].J Biol Chem,2010,285(12):8927-8935.
[5] 张彪,郭凌川,董亮,等.转化生长因子-β1shRNA表达载体的构建与鉴定[J].苏州大学学报:医学版,2010,30(5):975-977.
[6] 王守立,杨光华,步宏,等.TGF-β1信号通路蛋白在横纹肌肉瘤中的表达[J].肿瘤,2004,24(5):440-443.
[7] 王守立,杨光华,步宏,等.转化生长因子β1及其受体和Smad2、Smad4蛋白在横纹肌肉瘤中的表达[J].中华病理学杂志,2004,33(2):160-161.
[8] Stevens MC.Treatment for childhood rhabdomyosarcoma:the cost of cure[J].Lancet Oncol,2005,6(2):77-84.
[9] Mansky P,AraiA,Stratton P,etal.Treatment late effects in long-term survivors of pediatric sarcoma[J].Pediatr Blood Cancer,2007,48(2):192-199.
[10] Kotilingam D,Lev DC,Lazar AJF,et al.Staging soft tissue sarcoma[J].CA:Cancer JClin,2006,56(5):282-291.
[11] BouchéM,CanipariR,Melchionna R,etal.TGF-βautocrine loop regulates cellgrowth andmyogenic differentiation in human rhabdomyosarcoma cells[J].FASEB J,2000,14(9):1147-1158.
[12] Wang SL,Yao HH,Guo LL,et al.Antisense oligonucleotide targeting TGF-β1abrogates tumorigenicity of rhabdomyosarcoma in vivo[J].Chin JClin Oncol,2008,5(4):258-262.
[13] Blais A,Tsikitis M,Acosta-Alvear D,et al.An initial blueprint for myogenic differentiation[J].Genes Dev,2005,19(5):553-569.
[14] Bakkar N,Wang J,Ladner KJ,etal.IKK/NF-κB regulates skeletalmyogenesis via a signaling switch to inhibit differentiation and promote mitochondrial biogenesisand promotemitochondrial biogenesis[J].JCell Biol,2008,180(4):787-802.
[15] Wang H,Garzon R,Sun H,etal.NF-κB-YY1-miR-29 regulatory circuitry in skeletalmyogenesis and rhabdomyosarcoma[J].Cancer Cell,2008,14(5):369-381.
[16] Yamashita M,Fatyol K,Jin C,et al.TRAF6 mediates Smad-independent activation of JNK and p38 by TGF-β[J].Mol Cell,2008,31(6):918-924.
[17] Jeong S,Cho IR,An WG,et al.STP-A11,an oncoprotein of Herpesvirus saimiri augments both NF-κB and AP-1 transcription activity through TRAF6[J].Exp Mol Med,2007,39(1):56-64.
[18] Gingery A,Bradley EW,Pederson L,et al.TGF-βcoordinately activates TAK1/MEK/AKT/NFκB and SMAD pathways to promote osteoclast survival[J].Exp Cell Res,2008,314(15):2725-2738.
M echanism of TGF-β1mediated NF-κB signal pathway inhibiting m yogenic differentiation of rhabdom yosarcoma
JIANG Zhen1,2,CHENWang-wang1,2,CAO Dan3,HUANG Feng-bo3,FANG Jian-kai3,SUN Li1,2,SUN Mao-min2,WANG Shou-li3
(1.Anatomy&Cellular Neurobiology Lab,2.Laboratory Animal Center,3.Department of Pathology,Medical School of Soochow University,Suzhou Jiangsu 215123,China)
Objective:To investigate the mechanism of TGF-β1mediated NF-κB signal pathway inhibitingmyogenic differentiation of rhabdomyosarcoma(RMS).M ethods:After transfected with TGF-β1siRNA-expressing plasmid system,the expression level of Caspase-3 were detected by immunohistochemical staining.The apoptosis of RD cellswas assessed by TUNEL assay,and myofilamentwere explored by transmission electron microscope(TEM).After co-culturing with exogenous TGF-β1,the expression level of nuclear factor-kappa B(NF-κB)familymembers such as p65,p50,p52 and RelB in RD cells were tested by immunofluorescence.The expression level of NF-κB family members in rhabdomyosarcoma paraffin tissues were determined by Immunohistochemistry.Results:Compared with the control group,the expression of Caspase-3 and the positive cells detected by TUNEL assay were increased significantly(P<0.05);TEM showed that structure ofmyofilament significantly increased in RD cells treated with TGF-β1siRNA-expressing plasmid system.After6 hours for co-culturing with exogenous TGF-β1(2 ng/mL),RD cells showed significantly higher positive rate and staining intensity of p65 and p50 than those in control group(P<0.05).The high expression rate of p65 and p50 was found in TGF-β1-high RMS than that in TGF-β1-low group(P<0.05).Conclusion:Differentiation inhibition of rhabdomyosarcomamay be related with the TGF-β1signal transduction mediated by p65 and p50,which is belong to themembers of NF-κB family.
rhabdomyosarcoma;TGF-β1;nuclear factor-κB;myogenic differentiation
姜珍(1989—),女,硕士研究生;陈枉枉(1989—),女,硕士研究生,共同第一作者;孙茂民(通讯作者),副教授,博士,硕士生导师,E-mail:sunmaomin@suda.edu.cn,王守立(共同通讯作者),教授,硕士生导师,E-mail:wangsoly112@hotmail.com
R738.7 [文献标志码] A [文章编号] 1671-7783(2015)03-0190-05
10.13312/j.issn.1671-7783.y140275
国家自然科学基金资助项目(81272738,81372867);江苏省自然科学基金资助项目(BK2011292);苏州市应用基础研究资助项目(SYS201207)
2014-10-21 [编辑] 陈海林
