石蒜碱对人胃癌细胞体外增殖的影响
2015-08-08刘希宇贺小英王凤梅马利兵
刘希宇, 贺小英,王凤梅,程 腾, 马利兵*
(1.内蒙古科技大学 数理与生物工程学院,内蒙古 包头 014010;2.包头轻工职业技术学院, 内蒙古 包头 014035)
0 引言
石蒜碱是中草药中具有显著药理活性的重要化学成分,研究发现石蒜碱具有抑制乙酰胆碱酯酶、催吐、镇静、阵痛及抗肿瘤等多种生物活性[1-3],且对多种癌细胞系以及人类白血病细胞系具有较强的抑制活性[4-6],Lamoral-Theys 等研究发现石蒜碱主要通过抑制肿瘤细胞生长发挥抗肿瘤作用,且对肿瘤细胞的抑制活性是正常细胞的15倍[7].然而,目前尚未见有关石蒜碱对人胃癌细胞(human gastric cancer cells, hGCCs)影响的报道.基于此,本研究观察与分析了石蒜碱对hGCCs体外增殖的影响.
1 材料与方法
1.1 试剂
EDTA、胎牛血清(fetal bovine serum,FBS)购于杭州四季青公司,青霉素、链霉素购于华北制药,石蒜碱购于西安玉泉生物科技有限公司,台盼蓝、胰蛋白酶购于Amresco公司,DMEM高糖培养基购于Gibco公司,凯基AnnexinV-FITC细胞凋亡检测试剂盒购于南京凯基生物科技发展有限公司,其余试剂均购于sigma公司.
1.2 hGCCs的体外培养及传代
hGCCs来自于本实验室液氮罐冻存.从液氮罐中迅速取出冻存的hGCCs,置于37 ℃水浴锅中3~5 min,至其完全溶解,随后,将细胞冻存液移至离心管中,1 000 r/min离心5 min,弃上清,随后,以细胞培养液(添加10% FBS的DMEM高糖培养液)洗涤细胞2~3次,接种于100 mm细胞培养皿中,置于37 ℃、5%CO2、饱和湿度的CO2培养箱(Galaxy S,购于Rs Biotech公司)中进行培养,每2~3 d更换一次培养液.待hGCCs达到80%~90%汇合时,倒掉培养液,用D-PBS洗涤细胞2~3次,采用消化液(添加体积份数0.25%胰蛋白酶和体积份数0.05%EDTA的D-PBS)消化细胞,经细胞培养液洗涤2~3次后,部分细胞冻存备用,部分细胞接种于60 mm培养皿中,其余细胞以1.2×105个/mL的密度接种于96孔培养板中,继续培养.
1.3 石蒜碱处理及细胞计数
向96孔培养板中的不同孔中添加石蒜碱,使其终摩尔浓度分别达到0、1.25、2.50及5.00 μmol/L,每24 h换液一次,并消化不同处理组一个孔中的细胞,经细胞培养液中和及台盼蓝染色后,采用细胞计数板计数死细胞数和活细胞数.不同处理组每次计数均重复4次,每24 h计数1次,连续计数9 d,绘制hGCCs的生长曲线图并利用公式(1)计算细胞活力.

(1)
1.4 石蒜碱处理及流式细胞技术检测
接种于60 mm培养皿中的hGCCs,分别以0、1.25、2.50、5.00 μmol/L浓度的石蒜碱处理48 h,按凯基AnnexinV-FITC细胞凋亡检测试剂盒操作步骤处理各组样品.处理后的样品采用流式细胞仪(BD FACSCanto TM II,购于BD公司)检测处于不同细胞周期的细胞比例.
1.5 数据分析
对细胞计数法统计得出的死细胞数、活细胞数及细胞活力进行数据处理,使用SPSS软件进行单因素方差分析,检验其差异是否显著,当p<0.05表示差异显著.
2 结果与分析
2.1 体外培养的hGCCs形态特征
在倒置显微镜下观察,hGCCs为贴壁依赖型细胞,培养24 h已处于贴壁状态,此时细胞形态为不规则多边形或三角形(见图1 A).随着培养时间延长,细胞逐渐呈上皮样或不规则多边形状,且体积有所变大,继续培养2~4 d后hGCCs在培养皿中排列密集,铺满培养皿底部,部分区域会呈现出层叠生长的现象(图1 B),表明hGCCs已失去接触抑制性,对其继续进行培养,hGCCs会出现堆砌生长,层叠数可以不断增加.
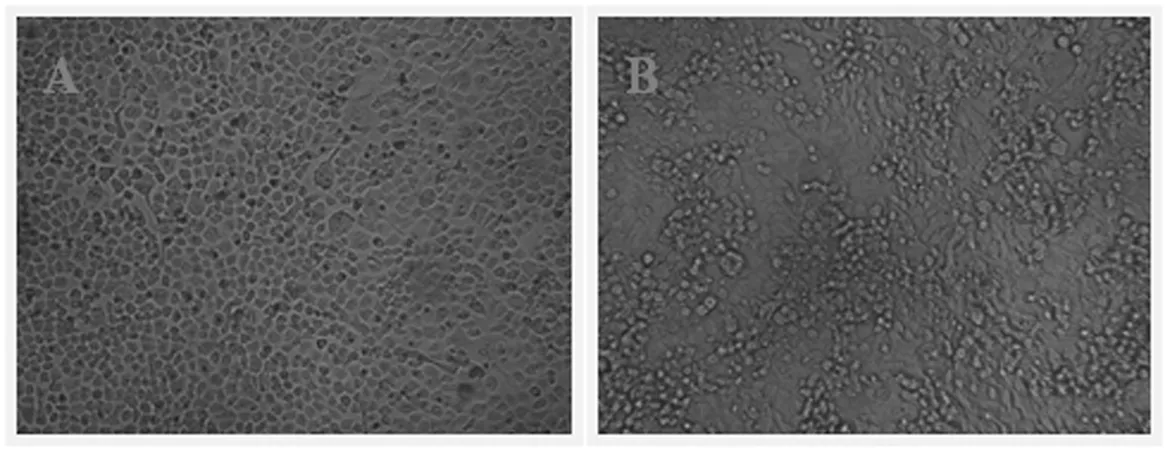
A. 贴壁后的hGCCs; B. 层叠生长的hGCCs图1 体外培养的hGCCsFig.1 hGCCs cultured in vitro
2.2 石蒜碱处理对hGCCs体外增殖的影响
为了定量研究不同浓度石蒜碱对体外培养的hGCCs生长的抑制作用,采用细胞计数法,对不同处理组、不同处理时间的hGCCs总数进行计数,绘制hGCCs体外增殖曲线图,结果见图2.
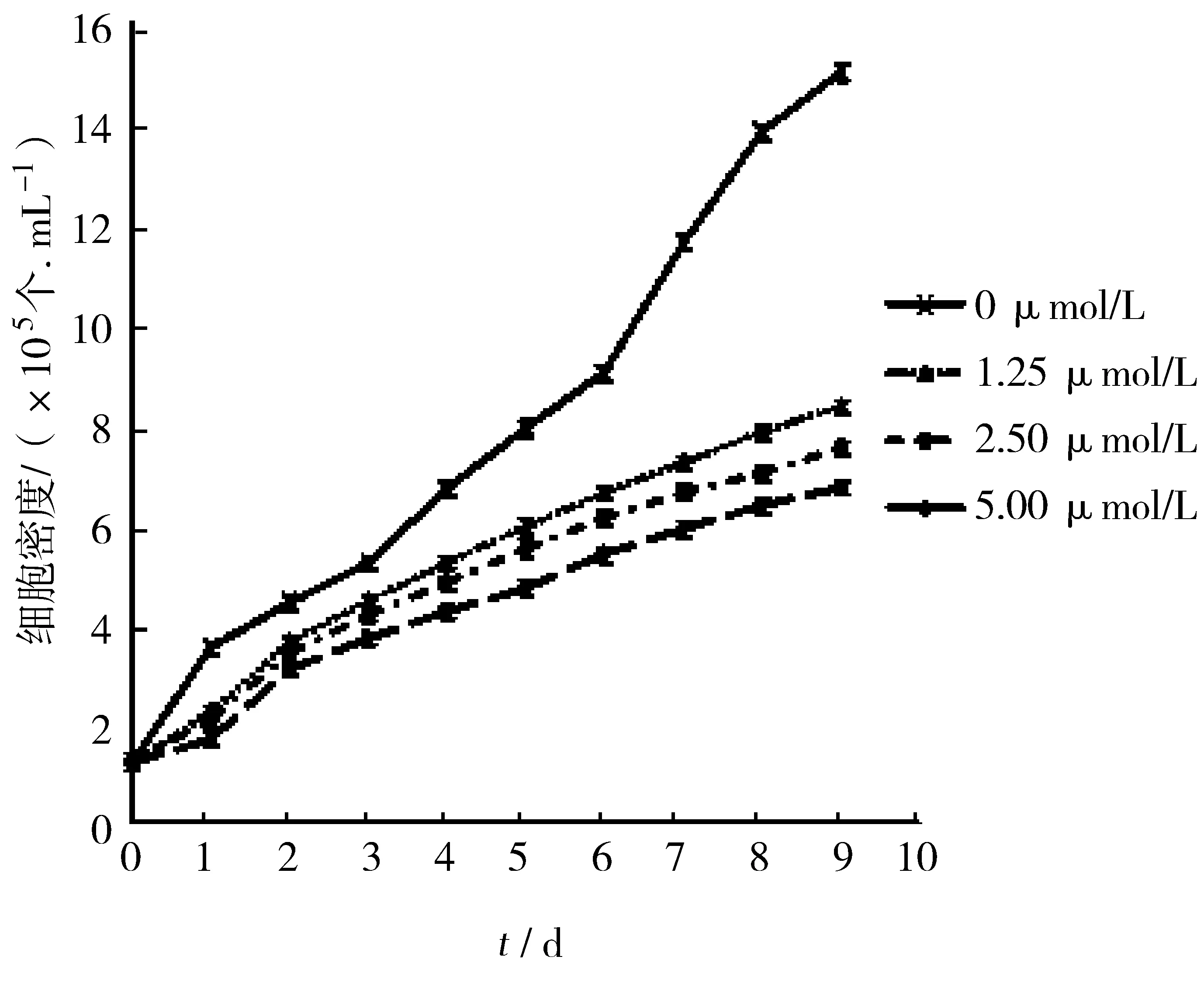
图2 不同浓度石蒜碱处理后hGCCs的生长曲线Fig.2 The growth curve of hGCCs after treatment with different concentration of lycorisradiata alkali
由图2可以看出,不同浓度的石蒜碱对hGCCs的体外生长均具有一定的抑制作用,且随着石蒜碱浓度的升高,抑制作用越发明显.
为了进一步探究石蒜碱抑制hGCCs体外增殖的机理,不同浓度石蒜碱处理4~7 d后的hGCCs,经台盼蓝染色后,采用细胞计数法统计死细胞数、活细胞数,并据此计算细胞活力,结果见表1和表2.
表1不同浓度石蒜碱处理后hGCCs死细胞数、活细胞数
Tab.1TheamountoflivingordeadhGCCsaftertreatmentwithdifferentconcentrationoflycorisradiataalkali
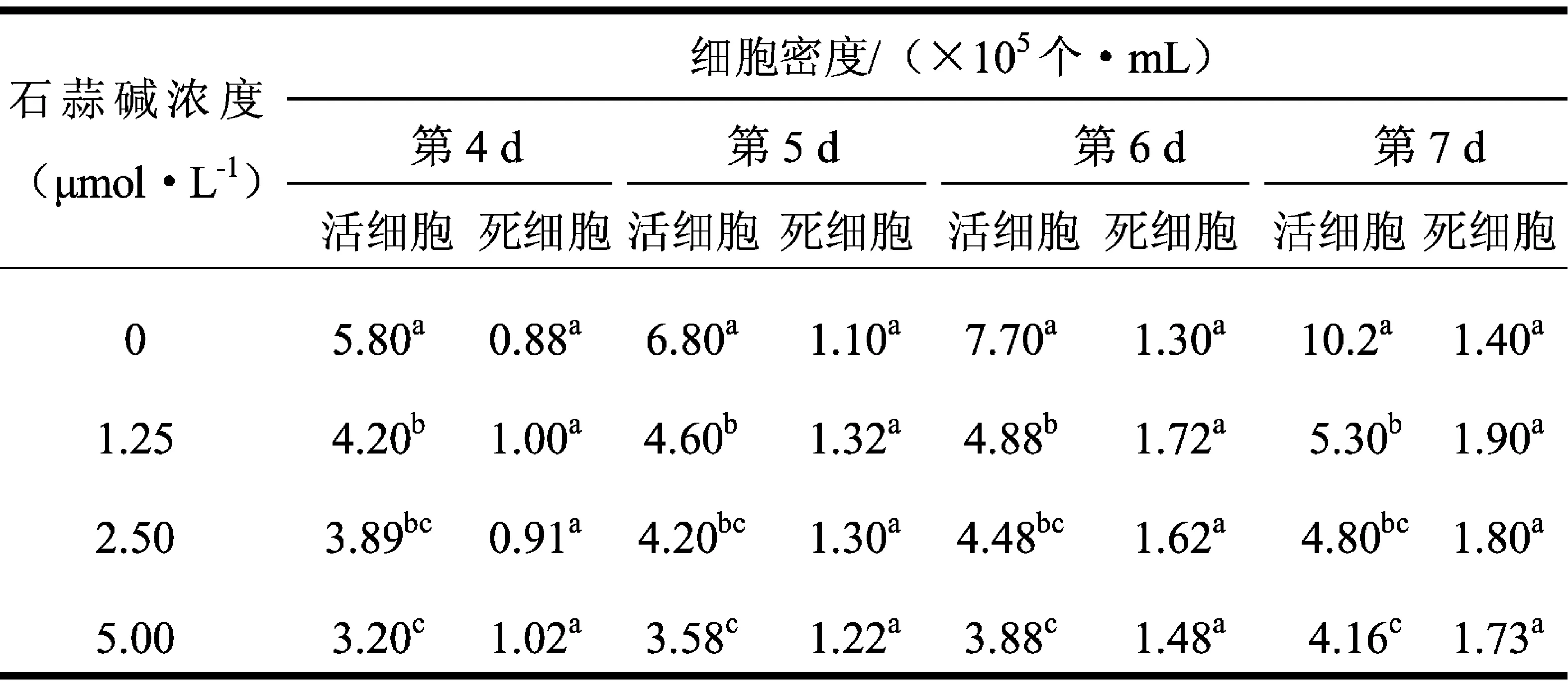
注:同一列中上标不同字母表示差异显著
由表1可以看出,不同浓度石蒜碱处理组的活细胞数显著(p<0.05)低于空白对照组的活细胞数,且这种差异随着石蒜碱浓度的增加、培养天数的延长而越发显著;同时,5.00 μmol/L处理组的活细胞数显著(p<0.05)低于1.25 μmol/L 处理组;而处理组与空白对照组在死细胞数上差异不显著.这一结果表明,石蒜碱对hGCCs的主要影响在于其抑制hGCCs的快速增殖,且随着石蒜碱浓度的升高,抑制作用增强.
由表2可以看出,随着石蒜碱浓度的增加及培养时间的延长,hGCCs的细胞活力显著(p<0.05)低于空白对照组的细胞活力,这一结果表明石蒜碱处理会一定程度导致细胞凋亡率上升.
2.3 石蒜碱处理对hGCCs细胞周期的影响
表2不同浓度石蒜碱处理后hGCCs活力
Tab.2ThevitalityofhGCCsaftertreatmentwithdifferentconcentrationoflycorisradiataalkali
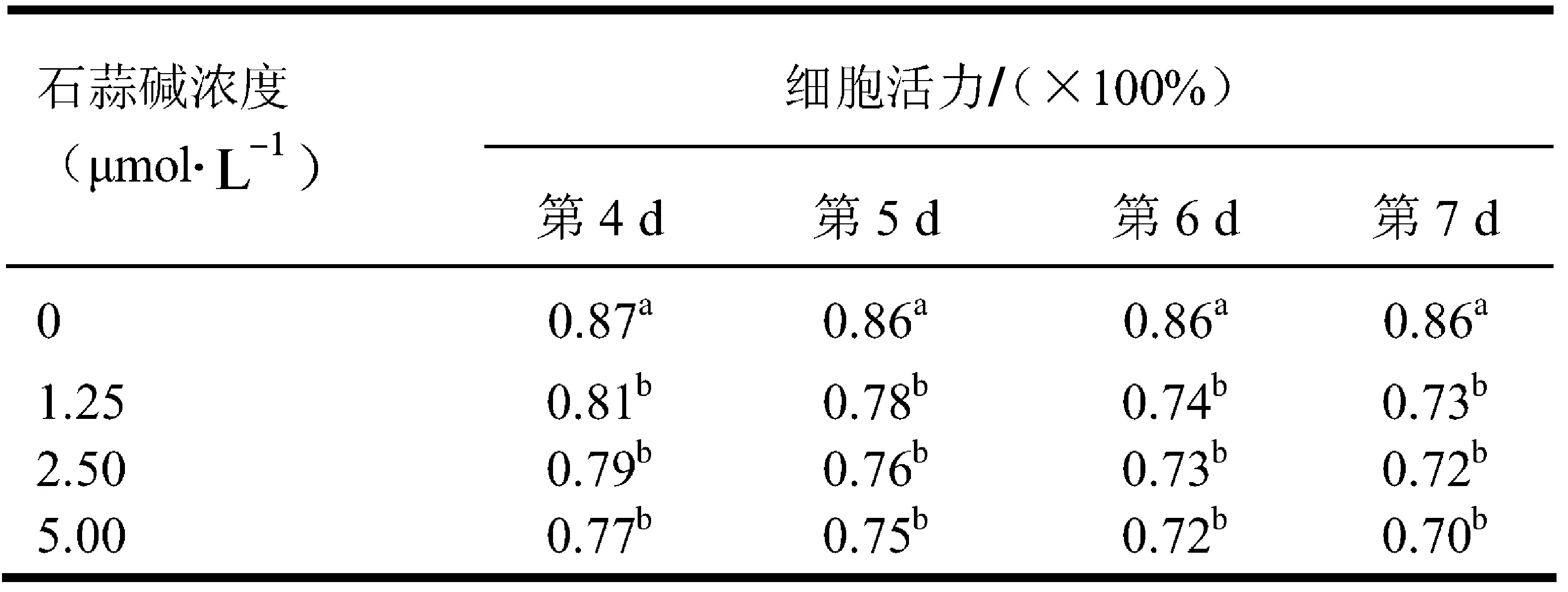
注:同一列中上标不同字母表示差异显著
为了探究石蒜碱抑制hGCCs快速增殖的机理,体外培养的hGCCs经不同浓度石蒜碱处理2 d后,经凯基AnnexinV-FITC细胞凋亡检测试剂盒预处理后,经流式细胞技术检测处于不同细胞周期的细胞比例,结果见图3.
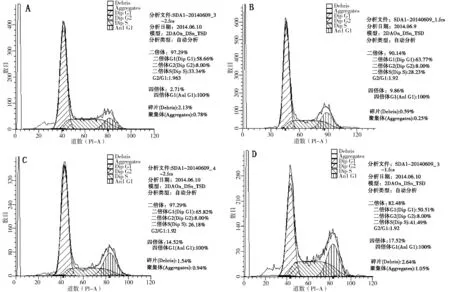
(A.空白组;B.1.25 μmol/L处理组,C.2.5 μmol/L处理组,D.5 μmol/L处理组)图3 石蒜碱处理后hGCCs中处于不同细胞周期的细胞比例Fig.3 The proportion of hGCCs in different cell cycles after treatment with different concentration of lycorisradiata alkali
由图3可以看出,经不同浓度石蒜碱处理2 d后的hGCCs,处于不同细胞周期的细胞比例明显不同.随着石蒜碱浓度的升高(分别为0、1.25、2.50、5.00 μmol/L),二倍体细胞的比例逐渐减低(分别为97.29%、90.14%、85.48%、82.48%),而四倍体细胞的比例逐渐升高(分别为2.71%、9.86%、14.52%、17.52%).这一结果表明,石蒜碱处理可抑制hGCCs由G2期向M期过渡,从而使细胞阻滞于G2期,最终导致hGCCs的快速增殖受到抑制.
3 讨论
癌症的难以治愈性主要表现在其可以无限繁殖,且不受生长空间的限制,和癌细胞的迁移漂变性[8-9].在控制癌细胞疯狂生长时,一方面要抑制其快速增殖,另一方面要控制其正常调亡.当癌细胞可以控制在正常调亡时,一段时间之后,癌症的病理特征就会减少,从而达到治疗的效果[10-11].石蒜碱作为抑制癌症细胞增殖的药物,主要作用机理是使癌细胞阻滞于G2期,从而导致其快速增殖受到抑制;同时对控制细胞正常凋亡的相关酶类的合成产生影响,从而达到细胞凋亡控制的效果.
本实验采用血球计数板计数法统计了不同浓度石蒜碱处理下的hGCCs细胞总数,并进一步计算出细胞活力,发现石蒜碱处理会抑制hGCCs的体外增殖,且较高浓度处理的hGCCs的活力最低,同时发现石蒜碱处理会一定程度导致细胞凋亡率上升.用流式细胞仪分析经PI染色后的细胞悬液,发现处理hGCCs的培养液中石蒜碱含量越大,hGCCs中二倍体细胞占有量越少,四倍体细胞占有量越多.细胞周期过程中,细胞分裂间期主要是正常的二倍体细胞,为细胞分裂复制DNA和合成蛋白质类酶类物质;分裂期的细胞会表现出短暂的四倍体细胞现象.正常情况下细胞间期时间远长于分裂期,从而使二倍体细胞数量多于四倍体细胞数量.检测结果显示hGCCs在细胞分裂期(M期)停留时间变长,表现hGCCs“四倍体”数目变多,hGCCs周期变长,hGCCs增殖速率随之变慢.
