高效液相色谱荧光检测法同时检测鸡组织中阿莫西林和氨苄西林残留
2015-08-08崔璐璐谢恺舟张小杰孙礼瑞刘建宇刘亚楠张跟喜戴国俊王金玉
崔璐璐,谢 星,谢恺舟,张小杰,孙礼瑞,刘建宇,高 强,刘亚楠,张跟喜,戴国俊,王金玉
(1.扬州大学动物科学与技术学院,江苏 扬州 225009;2.江苏省动物遗传繁育与分子设计重点实验室,江苏 扬州225009;3.南京农业大学动物医学院,江苏 南京 210095)
阿莫西林(AMO)和氨苄西林(AMP)属于β-内酰胺类抗生素,因其抗菌谱广、价格低廉及对哺乳动物毒性较小等特点,在畜牧业生产中得到广泛应用。然而,AMO和AMP的不合理使用会对敏感人群带来过敏反应和细菌耐药性等问题[1]。目前世界许多国家和组织如日本[2]和欧盟[3]均对兽药的最高残留限量做出了规定。我国农业部也于2003年颁布了235号公告[4],对家禽组织中的AMO和AMP最高残留限量(MRLs)做出了规定,且规定鸡组织中两种药物的MRLs不超过50 μg/kg体重。因此研发高效、灵敏的AMO、AMP残留检测方法具有重要意义。
目前国内外报道的AMO、AMP的检测方法主要有免疫分析法[5]、微生物法[6]、高效液相色谱法[7]、液质联用法[8]等。本试验旨在建立鸡组织中AMO和AMP同时检测的高效液相色谱荧光检测法,为AMO、AMP在鸡组织中残留检测标准的制定提供依据。
1 材料与方法
1.1 标准品和主要试剂 AMO、AMP标准品:纯度分别为98%、99%,德国Labor Dr.Ehrenstorfer Schaefers;乙腈:色谱纯,美国Sigma有限公司;磷酸二氢钾、磷酸二氢钠、二氯甲烷、三氯乙酸:分析纯,国药集团化学试剂有限公司;水杨醛:分析纯,Aladdin Chemistry Co.Ltd;超纯水:ELGA公司超纯水仪制备,电阻率为18.2 MΩ.cm。
AMO、AMP标准储备液:准确称取AMO、AMP标准品各10.2 mg、10.1 mg,分别置于10 mL棕色容量瓶中,用超纯水溶解并定容,配制成1 mg/mL的AMO、AMP标准贮备液,-34℃保存,可稳定保存2个月。
1.2 主要仪器 高效液相色谱仪(Waters515,配备两台515型高压泵、2475型荧光检测器等,美国Waters公司);荧光分光光度计(F-4500型,日本日立公司);台式高速冷冻离心机(5810型,德国Eppendof公司);组织匀浆机(ART MICCRA D-9型,德国ART-moderne Labortechnik e.k.公司)等。
1.3 色谱方法 色谱柱:Athena C18-WP柱,5 μm,4.6 mm(i.d)×250 mm;流动相:A为0.01 mol/L的KH2PO4溶液,pH值5.5;B为乙腈溶液;流速:1mL/min;激发波长358 nm,发射波长440 nm;梯度洗脱程序:0~10 min,65%A;11~18 min,40%A;19~22 min,65%A。流速为1 mL/min;进样体积:200μL;柱温:40℃。
1.4 试验方法
1.4.1 试验动物分组及样品采集 16周龄京海黄鸡36只,随机分成2组,每组18只(公、母各半),第1组为空白对照组,第2组为AMO、AMP混合试验组(作为同步检测用)。试验鸡均单笼饲养,试验前预饲1周,饲喂不含任何抗菌药物的全价饲料。试验组鸡给药剂量分别按30 mg/kg体重(AMO)和120 mg/kg体重(AMP)投药,连续投喂7 d。于停药后4 h、1 d、3 d、5 d、7 d屠宰采集样品,分别取两侧胸肌肌肉、全肝和全肾,于-34℃冰箱中保存待测。
1.4.2 样品的提取与净化 称取3 g剪碎后的鸡肌肉(或肝脏或肾脏)组织,置于50 mL的离心管中,加0.01 mol/L磷酸二氢钠溶液(pH值4.5)3 mL,17000 r/min匀浆30 s。加8 mL乙腈,振荡混匀,超声萃取15 min。10700 r/min(4℃)离心15 min,转移上清液至另一离心管中,重复提取,合并上清液。加5 mL用75%乙腈饱和的正己烷,振荡混匀,静置并去除上层溶液,重复去脂1次。加15 mL超纯水饱和的二氯甲烷溶液,振荡,10700 r/min离心5 min。转移上清液至10 mL玻璃管。
1.4.3 样品的衍生化 将玻璃管中收集的上清液置于真空干燥器中浓缩至干。向玻璃离心管中加入超纯水1 mL,分别加入20%三氯乙酸溶液200μL、水杨醛20μL,漩涡混匀20 s,100℃水浴加热30 min。反应后取出样品,水浴冷却,将样品转移到2 mL离心管中,并用磷酸二氢钾/乙腈(V:V=65∶35)混合溶液洗涤玻璃管两次,合并后定容至2 mL。12100 r/min离心15 min,取上清液供HPLC分析。
1.5 定量方法的确定
1.5.1 标准曲线的建立 分别将阿莫西林及氨苄西林标准储备液用空白基质提取液稀释成浓度分别为 25、50、100、150、250、500、1000 μg/kg的标准工作液。各个浓度点准确量取1 mL,按衍生化反应步骤衍生,得到系列浓度的混标衍生产物作HPLC分析,每个浓度重复4次,取平均值。以所得峰面积为纵坐标(A),标准溶液的质量浓度为横坐标(C),绘制标准曲线,并求出其回归方程和相关系数。
1.5.2 回收率及精密度的测定 取剪碎的空白组织样品,置于50 mL离心管中,添加适宜浓度的AMO与AMP混标溶液,使组织样品中AMO的药物浓度为13、25、50、100 μg/kg体重,AMP的药物浓度为10、25、50、100 μg/kg体重,室温下静置30 min,作为空白添加试样,每个浓度水平设置6个平行,经1.4.2、1.4.3的方法处理后,供HPLC测定,外标法定量,计算出回收率。将回收率检测剩余的样品按四个高低浓度合并成4份,得到4组不同药物浓度的样品。在1 d内不同时间和在1周内不同天重复测定4组药物浓度的样品,求得日内(批内)和日间(批间)精密度。
1.5.3 检测限和定量限的测定 分别用鸡空白组织按1.4.2、1.4.3步骤制取空白基质提取液。分别向其添加一定浓度的AMO和AMP标准溶液,进行HPLC分析,逐渐降低AMO和AMP的浓度,以样品检测时的信噪比(S/N)大于等于3和10分别作为药物在鸡组织中的检测限(LOD)和定量限(LOQ)。
2 结果与分析
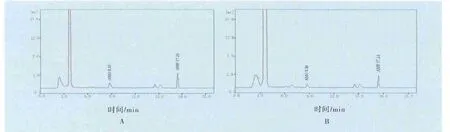
图1 鸡肌肉中A M O及A M P的高效液相色谱图
2.1 色谱分离 在优化的色谱条件下,测得鸡肌肉、肝脏、肾脏中AMO的保留时间分别约为8.85、8.99、8.88 min,AMP的保留时间分别约为17.26、17.41、17.35 min,色谱峰峰形较佳,均为基线分离峰。鸡肌肉、肝脏、肾脏空白提取液在上述时间均无干扰峰出现。以鸡肌肉色谱图为例,见图1。
2.2 标准曲线 以AMO、AMP的色谱峰面积(A)对进样前AMO、AMP的质量浓度(C,μg/kg体重)作图,分别得到其标准曲线。AMO和AMP在质量浓度25~1000μg/kg体重范围内线性关系良好。AMO在鸡肌肉、肝脏和肾脏中的线性回归方程分别为A=3.0779C+3.4088、A=2.8658C+2.3641和A=3.4725C+2.2965,相关系数分别为0.9996、0.9995和0.9997;AMP分别为A=1.6960C+1.8585、A=2.3563C+3.2586和A=3.8246C+1.4321,相关系数分别为0.9998、0.9994和0.9997。
2.3 添加回收率与精密度 AMO添加水平在13~100μg/kg体重时,鸡肌肉、肝脏、肾脏中AMO的平均回收率在68.65%~87.78%,相对标准偏差在5.13%~10.54%,日内相对标准偏差在4.92%~8.43%,日间相对标准偏差在9.39%~12.47%;AMP添加水平在10~100μg/kg体重时,鸡肌肉、肝脏、肾脏中AMP的平均回收率在71.23%~88.86%,相对标准偏差在4.78%~10.74%,日内相对标准偏差在4.21%~8.21%,日间相对标准偏差在9.23%~12.56%。
2.4 灵敏度 应用本试验建立的检测方法,测得鸡肌肉、肝脏、肾脏中AMO的检测限、定量限均分别为5、13μg/kg体重,AMP的检测限、定量限均分别为3.5、10μg/kg体重。表明该方法灵敏,能满足鸡组织中AMO、AMP同时检测的需要。
3 讨论
3.1 标准物质的稳定性分析 本试验配制了两组10 mg/L的AMO、AMP混合溶液,通过磷酸盐和氢氧化钠调pH值,建立9个梯度(pH值=3~11),分别在-34℃和4℃的冰箱中保存,每天在合适的色谱条件下进行HPLC检测,连续7 d。结果显示,在pH值在3和11时,降解最快,放置3 d后AMO的降解即超过50%,pH值在5时降解速率最慢,且-34℃下保存要比4℃保存时更稳定,这与Mitchell[9]等和Francesco[10]等的研究结果相似。
3.2 色谱条件的选择
3.2.1 检测器及检测波长的选择 AMO和AMP本身并没有专一的紫外发色基团,在最大吸收波长段200~235 nm之间选择性较差,背景干扰很严重。与紫外检测器相比,本试验选择荧光检测器在对AMO、AMP衍生产物的分析上,灵敏度与特异性都有很大优势。运用荧光光度计对衍生产物进行扫描,得到AMO的最佳激发、发射波长分别为358 nm、440 nm,AMP分别为327 nm、409 nm,由于AMO衍生物的荧光灵敏度略低于AMP衍生物的灵敏度,故本试验最终选取AMO的最佳激发、发射波长作为两种药物的共同检测波长。
3.2.2 流动相的选择及pH值的优化 参考相关文献[11],本试验选择磷酸盐-乙腈体系做流动相,各组分分离良好,峰形尖锐对称。AMO在水溶液中不稳定,酸性环境可以减小AMO的降解[12],结合标准物质稳定性试验,比较了不同pH值的流动相对AMO和AMP分离效果的影响。通过改变流动相A和磷酸盐溶液的pH值(4、4.5、5、5.5、6、6.5),结果发现,pH值为5.5时,AMO最稳定,且分离良好,峰形尖锐对称。
3.2.3 衍生剂选择及衍生条件的优化 常用的衍生化反应试剂有苯甲醛、甲醛、邻苯二甲醛、水杨醛等[13-15],醛基与β-内酰胺反应产生荧光基团。本试验对这4种试剂进行了比较,发现在本试验条件下,只有水杨醛能同时与AMO和AMP发生衍生反应并得到良好分离。因此,选择水杨醛为本试验衍生化试剂。此外本试验研究了不同的衍生时间,不同的衍生剂剂量,不同的三氯乙酸添加量以及不同的衍生温度对衍生结果产生的影响,最终确定衍生反应的最佳条件为20%的三氯乙酸溶液200μL、水杨醛20μL、100℃水浴加热60 min。
4 结论
建立了鸡组织中AMO、AMP同时提取和检测的高效液相色谱荧光检测法。AMO在鸡组织中的平均回收率均高于68.65%,相对标准偏差均小于10.54%;AMP在鸡组织中的平均回收率均高于71.23%,相对标准偏差均小于10.74%;AMO在鸡组织中的检测限和定量限均分别为5μg/kg体重和13μg/kg体重;AMP的检测限和定量限均分别为3.5μg/kg体重和10μg/kg体重,表明该方法灵敏、准确、快速,能满足鸡组织中AMO、AMP同时检测的需要。
[1]Macarov C A,Tong L,Martínez-huélamp M,et al.Multi residue determination of the penicillins regulated by the European Union in bovine porcine and chicken muscle by LC-MS/MS[J].Food Chemistry,2012,135(4):2612-2621.
[2]本书编委会.日本肯定列表制度-食品中农业化学品残留限量-药品卷[M]葛志荣译..北京:中国标准出版社,2006.
[3]Commission Regulation(EU)No 37/2010 of 22 December on pharmacologically active substances and their classification regarding maximum residue limits in food stuffs of animal origin[Z].2009.
[4]中华人民共和国农业部.动物性食品中兽药最高残留限量[S]//公告第235号(附录4).北京:农业部,2002.
[5]林 杰,张 佳,黄晓蓉,等.猪肉中青霉素类药物残留放射免疫法快速检测[J].中国饲料,2008,4(6):30-33.
[6]张可煜,王大菊,袁宗辉,等.猪和鸡可食性组织中氨苄青霉素残留的微生物学检测法[J].中国兽医学报,2004,24(5):470-473.
[7]于桂阳.阿莫西林在牛肉中残留的高效液相色谱检测及分析[J].食品科学,2008,29(4):331-334.
[8]李玮,艾连峰,郭春海,等.高效液相色谱-串联质谱法同时测定牛奶和奶粉中的青霉素类药物及其主要酶解代谢产物[J].色谱,2013,31(10):946-953.
[9]Mitchell S M,Ullman J L,Teel A L,et al.pH and temperature effects on the hydrolysis of threeβ-lactam antibiotics:ampicillin,cefalotin and cefoxitin[J].Science of the total environment,2014,466-467:547-555.
[10]Crea F,Cucinotta D,De Stefano C,et al.Modeling solubility,acid–base properties and activity coefficients of amoxicillin,ampicil⁃lin and(+)6-aminopenicillanic acid,in NaCl(aq)at different ionic strengths and temperatures[J].European Journal of Pharma⁃ceutical Sciences,2012,47(4):661-677.
[11]Luo W,Ang C Y W.Determination of Amoxicillin Residues in Animal Tissues by Solid-Phase Extraction and Liquid Chromatog⁃raphy with Fluorescence Detection[J].Journal of AOAC Interna⁃tional,2000,83(1):20-25.
[12]Freitas A,Barbosa J,Ramos F.Determination of Amoxicillin Sta⁃bility in Chicken Meat by Liquid Chromatography-Tandem Mass Spectrometry[J].Food Analytical Methods,2012,5(3):471-479.
[13]周建设,屠建中,卢晓阳,等.高效液相色谱衍生化法同时测人血清中阿莫西林和克拉维酸浓度[J].中国药学杂志,2004,39(7):538-539.
[14]Gamba V,Dusi G.Liquid chromatography with fluorescence detection of amoxicillin and ampicillin in feeds using pre-column derivatization[J].Analytica Chimica Acta,2003,483(1-2):69-72.
[15]李佳,陈冠华,郝庆红,等.邻苯二甲醛衍生荧光法测定牛奶中的苄青霉素残留[J].分析化学研究简报,2008,36(9):1285-1288.
