不同+Gz重复持续暴露对大鼠肝脏组织损伤及GRP78的表达影响
2015-08-07张洪义李文兵
胡 深,张洪义*,赵 刚,刘 垒,史 斌,李文兵,常 鹏
(1.安徽医科大学 空军临床学院, 安徽 合肥 230023; 2.中国人民解放军空军总医院 肝胆外科, 北京 100142;3.大连医科大学 研究生学院, 辽宁 大连 116044)
研究论文
不同+Gz重复持续暴露对大鼠肝脏组织损伤及GRP78的表达影响
胡 深1,张洪义1*,赵 刚2,刘 垒3,史 斌2,李文兵2,常 鹏1
(1.安徽医科大学 空军临床学院, 安徽 合肥 230023; 2.中国人民解放军空军总医院 肝胆外科, 北京 100142;3.大连医科大学 研究生学院, 辽宁 大连 116044)
目的探讨不同正加速度(+Gz)暴露下大鼠肝脏损伤及葡萄糖调节蛋白78(GRP78/Bip)在肝脏组织内分布和表达的变化。方法将SD大鼠24只,随机分为对照、+6Gz、+9Gz和+12Gz组,每组6只,峰值作用时间3 min,加速度增长率0.5 G/s,间隔30 min,重复间断连续5次。HE染色观察肝组织,并测定血浆天冬氨酸转氨酶(AST) 和丙氨酸转氨酶(ALT),用免疫组化法和Western blot测定肝脏组织中GRP78的表达。结果与对照组相比,+9Gz组、+12Gz组转氨酶水平均显著升高;且在ALT水平上,+12Gz组高于+9Gz组(P<0.05);HE染色显示正加速度组肝细胞排列紊乱,形态不规则,细胞间隙不清晰,空泡样改变,且随G值增长而加重。与对照组相比,GRP78/Bip表达分布主要集中在细胞胞质内;各实验组的GRP78表达均显著升高(P<0.05)。且+12Gz组明显高于+6Gz组和对照组(P<0.05),肝脏组织中GRP78/Bip蛋白表达水平随G值升高而升高;+12Gz组和+9Gz组都高于+6Gz组和对照组(P<0.05)。结论GRP78/Bip的表达可能在加速度引起的肝脏应激反应有着正相关的作用。
加速度;肝损伤;葡萄糖调节蛋白78;病理;免疫组化;蛋白质印迹
进入21世纪以来,随着高性能战机的装备使用,高+Gz的过载值、重视短距起降、发展超音速远程巡航作战能力和“隐身”能力成为各国空军的发展目标,也导致空勤人员所处的航空生理环境发生相应的变化。飞行员经常、反复地暴露于+Gz 环境中,身体各系统会产生应激反应。目前国内外关于+Gz对脑、心、肾等重要器官影响的研究报道很多,现已证实重复持续加速度对于大鼠模型心脏和大脑的病理生理改变有影响[1- 2],但关于+Gz对肝脏影响的研究较少。葡萄糖调节蛋白78(glucose regulated protein78,GRP78)又称为Bip,其定位于内质网,是内质网稳态的中心调节剂[3]。GPR78/Bip蛋白通过在内质网中协助多聚体蛋白质复合物的形成,起到保护和维持细胞正常代谢作用。最近10年内,有关GRP78/Bip的研究以氧化应激、内质网应激、创伤应激以及药物和营养物质缺乏应激居多。本研究通过离心机实验模拟重复持续性+Gz对大鼠肝脏影响,观察不同高+Gz下肝脏细胞的损伤变化,探讨其损伤的原理及不同+Gz条件下肝组织中GRP78/Bip 含量变化及其意义。
1 材料与方法
1.1 材料
清洁级雄性Wistar大鼠24只,体质量(195±10)g(由军事医学科学院动物中心提供,编号:SCKK- 2012-COO4);GRP78、牛血清蛋白BSA(Sigma公司);DAB显色(ZSGB-BIO公司);光学显微镜(Olimpus BX51);图像分析系统(CMIAS,空军总医院);蛋白提取混合剂(凯基公司);BCA蛋白测定试剂盒(索莱宝公司);TEMED、 Tris碱、甘氨酸GLYCINE(AMRESCO公司);预染的蛋白Marker (Trermo公司);β-actin 单克隆抗体、羊抗兔二抗(中杉公司)。
1.2 实验方法
1.2.1 分组:大鼠适应饲养1周后进行实验。随机分成对照组、+6Gz组、+9Gz组和+12Gz组,每组6只。
1.2.2 造模与取材:参照文献[4]等的加速度暴露方法建立模型;实验结束后30 min,使用10%水合氯醛麻醉(0.5 mL/100 g),无菌操作,经腹正中线剖腹,下腔静脉采血,然后迅速切取肝脏标本,每只动物肝脏切割保存5块大小约为1 cm×1 cm×1 cm,切割部位随机选取,使用0.9%氯化钠注射液冲洗肝组织上残留血液,用10%甲醛固定;其余部分迅速液氮冷冻保存。
1.2.3 血清转氨酶ALT和AST:ALT和AST检测麻醉后常规肝下下腔静脉采血4 mL,用全自动生化分析仪检测血清AST、ALT水平。
1.2.4 HE染色和光镜观察:取新鲜肝脏组织块,常规修整制作HE切片。光学显微镜下进行观察组织形态学变化。
1.2.5 大鼠肝组织GRP78蛋白免疫组化:常规石蜡包埋,随机肝脏组织切片制作,每块标本随机连续切片5张,切片厚度5 μm,用ABC法进行免疫组化,主要过程包括:H2O2甲醛封闭内源性过氧化物酶,正常绵羊血清阻断,胰蛋白酶消化,用PBS漂洗5 min×3次。滴加按要求稀释的一抗GRP78 (稀释浓度1∶100),4 ℃冰箱孵育过夜后,经0.01 mol/L PBS洗5 min×3次,加生物素化二抗和ABC复合物孵育。DAB显色。37 ℃孵育30 min DAB 显色常规脱水透明中性树胶封片。阳性细胞为黄色, 在光学显微镜下观察整张切片的表达情况,在400倍视野下每张切片随机选取5个阳性染色区域,光镜下计数阳性细胞; 并用图像分析系统测量阳性细胞的平均吸光度、积分吸光度和平均灰度,每个标本取5个视野的平均值做定量分析比较。阳性细胞越多,各值越大,提示免疫反应越强。
1.2.6 Western blot检测大鼠肝组织GRP78蛋白:秤取肝脏组织块100 mg,液氮充分研磨,移入玻璃匀浆器,加入蛋白提取混合剂1.5 mL,充分匀浆后冰浴下超声处理。4 ℃,13 000 r/min离心10 min,取上清。用BCA蛋白测定试剂盒,以牛血清清蛋白作为标准品进行蛋白定量,检测各样品蛋白浓度。采用SDS-聚丙烯酰胺凝胶电泳,每孔加蛋白提取液20 g,第一孔加入预染的Marker 5 μL,以显示蛋白位置。电泳条件为恒压70 mV,30 min,恒压100 mV,至溴酚蓝到胶边缘。根据marker切胶转膜,PVDF膜用冷的100%甲醇浸泡10 s,转膜条件为恒压80 mV,60 min。转膜后用洗膜缓冲液清洗5 s,非磷酸化蛋白以5%脱脂奶粉TBST溶液,磷酸化蛋白以5% BSA的TBST溶液室温封闭1 h。加入1∶1 000 一抗,4 ℃过夜,内参采用小鼠来源抗大鼠β-actin单克隆抗体。TBST 洗膜3 次,每次5 min,加入1∶10 000稀释的羊抗兔二抗,内参的二抗为山羊抗小鼠,室温作用1 h。TBST洗膜3 次,每次5 min。在PVDF膜上滴加化学发光试剂,于暗室中作用1 min后曝光X线片3 min后记录显像情况,采用Quantity One v4.6.2软件进行吸光度(A)值分析,目的蛋白的表达量以目的蛋白条带与对应β-actin条带的吸光度值的比值表示。
1.3 统计学分析
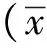
2 结果
2.1 血清转氨酶ALT和AST
与对照组相比,+9Gz组、+12Gz组转氨酶水平均显著升高,且在ALT水平上,+12Gz组高于+9Gz组(P<0.05)(表1)。
表1 实验各组的大鼠血清转氨酶AST和ALT数据
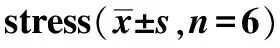

groupALT(U/L)AST(U/L)control 4238±929 124±42+6Gz 4850±593 134±21+9Gz 5420±475∗ 166±32+12Gz 6120±896∗# 213±80∗
*P<0.05 compared with control group;#P<0.05 compared with +6Gz group.
2.2 HE染色和光镜观察
肝组织HE染色后光镜下观察显示,对照组大鼠肝细胞以中央静脉为中心呈放射状排列,细胞壁完整,形态未见异常;HE染色显示实验组肝细胞排列紊乱,形态不规则,细胞间隙不清晰,空泡样改变,且随G值增长而加重。+6Gz组部分肝细胞索排列紊乱,轻度水肿,部分细胞壁破坏,形态不规则;+9Gz和+12Gz组部分肝细胞排列紊乱,细胞壁破坏,形态不规则,细胞间的间隙不清晰,部分出现空泡样改变,明显水肿,肝窦闭合。肝脏组织病理改变程度随着Gz增加而加重(图1)。
2.3 免疫组化结果分析
正常大鼠肝脏组织中也存在GRP78蛋白阳性信号,免疫组化染色阳性信号为棕黄色(箭头指示),阳性表达的GRP78 蛋白主要定位于细胞质中,细胞系反应为阴性;实验组阳性表达更为明显,棕黄色信号也较为突出。同时,观察到+9Gz和+12Gz组肝细胞排列紊乱,形态不规则,细胞间隙增宽,空泡样改变,但以+12Gz组更为严重(图2)。CMIAS 病理分析系统定量分析结果,实验各组的MA值均比对照组高,且随G值得升高MA值升高。+9Gz组高于对照组 (P<0.05),+12Gz组高于+9Gz组(P<0.05)(表2)。
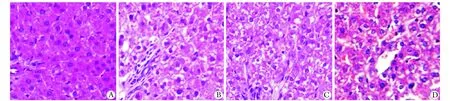
A.stress control group;B.+6Gz group;C.+9Gz group;D.+12Gz group
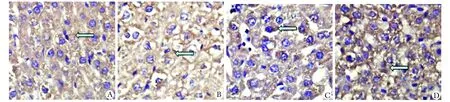
A.stress control group;B.+6Gz group;C.+9Gz group;D.+12Gz group; Arrow shows the protein expression, Magnification
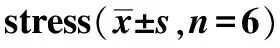

groupAA IAMGVcontrol 024±001995±0178677±246+6Gz 027±001 1125±0619150±115+9Gz 030±002∗ 1296±069∗9427±211∗+12Gz 033±004∗# 1456±130∗# 10117±341∗#
*P<0.05 compared with control group;#P<0.05 compared with +6Gz group.
2.4 Western blot结果分析
在曝光3 min后,+9Gz组和+12Gz组相比差异显著,蛋白表达水平明显增加(P<0.05);同时,+12Gz组较+6Gz组差异也有统计学意义(P<0.05)。各组大鼠肝脏组织GPR78,3 min表达水平(图3,4)。
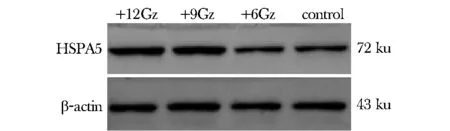
图3 蛋白质印迹法检测曝光3 min各组大鼠肝脏GPR78蛋白的水平Fig 3 Protein expression of GPR78/Bip in liver of rats under different levels +Gz stress by Western blot after 3 min
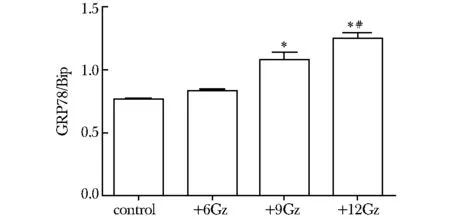
*P<0.05 compared with control group; #P<0.05 compared with +6Gz group图4 GRP78蛋白表达的比较Fig 4 The comparison of GRP78 protein expression
3 讨论
现代高性能战斗机在飞行中产生的+Gz可高达+9Gz以上,其持续时间可达15~45 S,已超出了人体正常的耐受限度。研究发现由于正加速度暴露导致血液向下端肢体和胃肠道分布、回心血量减少,因此有学者推测+Gz暴露可以导致肝动脉和门静脉向肝脏和胆道系统供血明显减少,通过诱导肝脏内微循环损害导致肝胆系统继发性损伤[5]。在正加速度重复暴露下,大鼠肝脏超氧化物歧化酶SOD含量明显降低,重复+10Gz应激导致肝脏氧自由基代谢能力下降[6]。在持续性加速度暴露作用下,肝脏糖异生作用增加,从而适应不同的G值作用[7]。
本实验,在不同的重复持续性正加速度(+Gz)的作用下,尤其首次使用12Gz超高值暴露,发现血浆ALT和AST随G值的增加呈明显的上升趋势;HE染色发现细胞索结构紊乱,细胞水肿,肝窦闭合,部分出现空泡样改变,且以+12Gz组最为严重。以往对GRP78的研究发现该蛋白对细胞内外环境的改变极为敏感。在氧化应激、缺血损伤、钙稳态紊乱时ER应激反应标志就是相关蛋白的表达,主要包括 ER 分子伴侣如 GRP78、GRP94 等[8]。
GRP78/Bip是一种葡萄糖调节性蛋白质,业已证实GRP78/Bip由HSPA5基因编码,被视为一个重要的管家基因[9]。GRP78/Bip有利于新合成蛋白质的运输、折叠[10],其伴侣功能包括细胞间蛋白的传导、降解不稳定和错误折叠的蛋白等。同时,在应激反应调节时其基因的转录活性可提高10~25倍,维持ER钙稳态及内环境的稳定[11]。本研究发现,在加速度作用因素下,机体内可能存在血液从新分配、动物内脏的相互挤压和离心G值的综合因素,造成血液的分配不均、离心应激损伤,影响GRP78的表达。
通过本研究,初步证实GRP78受重复持续性+Gz的影响。在持续+Gz条件下肝脏细胞GPR78蛋白表达增强,且随G值的增加而表达增强。+Gz对肝脏的损伤是一个复杂的病理生理过程。目前从蛋白水平对重复持续性+Gz对肝的应激性损伤的研究仍较少。因而,关于+Gz对肝脏细胞损伤的作用机制,尤其以超高G诱导下,加速度应激和氧化应激之间的具体相关性仍待进一步研究。
[1] Guillaume AI, Osmont D, Gaffié D,etal. Physiological implications of mechanical effects of+ Gz accelerations on brain structures[J]. Aviation, space, and environmental medicine, 2002, 73: 171- 177.
[2] Zawadzka-Bartczak EK, Kopka LH. Centrifuge braking effects on cardiac arrhythmias occurring at high+ Gz acceleration[J]. Aviation, space, and environmental medicine, 2004, 75: 458- 460.
[3] Luo S, Mao C, Lee B,etal. GRP78/BiP is required for cell proliferation and protecting the inner cell mass from apoptosis during early mouse embryonic development[J]. Molecular and cellular biology, 2006, 26: 5688- 5697.
[4] 李文兵, 孔亚林, 何晓军, 等. 重复持续性+Gz暴露对大鼠肝组织的损伤及机制研究[J]. 解放军医学杂志,2014,39: 240- 244.
[5] WU ZA. Gastropic examination and clinical analysis of gastrointestinal ulcers in parachute troop [J]. Chin J Aerospace Med, 2005, 16:58- 59.
[6] Zhang QJ, Zhan H, Li T,etal. Effects of repeated+ Gz exposures on lipid peroxidation of various organs in rats[J]. Aviation, space, and environmental medicine, 2001, 14: 240- 243.
[7] Daligcon BC, Oyama J, Hannak K. Increased gluconeogenesis in rats exposed to hyper-G stress[J]. Life sciences, 1985, 37: 235- 241.
[8] Kaufman RJ. Stress signaling from the lumen of the endoplasmic reticulum: coordination of g ene transcriptional and translational controls [J]. Genes Dev, 1999, 13: 1211- 1233.
[9] Meimaridou E,Gooljar SB,Chapple JP.From hatching to dispatching:the multiple cellular roles of the Hsp70 molecular chaperone machinery [J].J Mol Endocfinol,2009,42:1- 9.
[10] Gething, M.J. Role and regulation of the ER chaperone BiP[J]. Semin Cell Dev Biol, 1999, 10: 465- 472.
[11] Yang G H, Li S, Pestka JJ. Down-regulation of the endoplasmic reticulum chaperone GRP78/Bip by vomitoxin (Deoxynivalenol)[ J]. Toxicol Appl Pharm acol, 2000, 162: 207- 217.
The damage of liver cells and the expression of GRP78 in rats liver tissue after repeated and sustained exposure to different +Gz
HU Shen1, ZHANG Hong-yi1*, ZHAO Gang2, LIU Lei3, SHI Bin2, LI Wen-bing2, CHANG Peng1
(1.Clinical Air Force School of Anhui Medical University, Hefei 230023;2.Dept. of Hepatobiliary Surgery, Air Force General Hospital, PLA,Beijing 100142; 3.Graduate School of Dalian Medical University, Dalian 116044, China)
Objective To observe the damage of liver cells and to investigate the distribution and expression of glucose-regulated protein 78 (Glucose regulated protein78, GRP78/Bip) in liver tissue under the positive acceleration (+ Gz) exposure.Methods Totally 24 wistar rats were randomly assigned to four groups: blank control,+6Gz,+9Gz and +12Gz. Each rat was clamped to the centrifuge arm, prone position, with the head of the rat facing the axis of the centrifuge for +Gz orientation. The onset rate was +0.5 Gz/s, which was used trapezoidal acceleration curve effect and controlled by computer. Blank control group rats were placed on the arm of centrifuge and underwent a process similar to that described above, but they were not exposed to acceleration. +6Gz group,+9Gz group and +12Gz group were subjected at peak time 3 min in animal centrifuge, acceleration rate 0.5 G/s, five times with
interval 30 min between times. In addition, liver tissue of rats were respectively observed by H.E. staining. Mean while, plasma aspartate aminotransferase (AST) and alanine aminotransferase (ALT) were tested determine the damage of liver function. Results +Gz acceleration stress injury increased serum AST and ALT level. Compared with the stress control, +9Gz group and +12Gz group significantly increased in plasma ALT and AST as compared with control group(P<0.05). +12Gz stress induced the highest level in these groups. The level of ALT in+2Gz group was higher than that in +6Gz group(P<0.05). HE staining showed derangement of liver cells, irregular shape, the cell gap is not clear, vacuolar changes in +Gz groups, and with the increase of G value. Compared with the control group, the expression of GRP78/Bip was focused in the cytoplasm; the expression of GRP78 in the experimental group is higher than that in the control group (P<0.05). +12Gz group was significantly higher than +6Gz group and the control group (P<0.05). The expression of GRP78/Bip in liver tissue increased with the increasing of G value levels; the expression level of GRP78/Bip in +12Gz and +9Gz groups were higher than that in +6Gz and control group (P<0.05). Conclusions There is positively related expression of GRP78/Bip, which was associated with exposure of increasing G values.
acceleration; liver injury; GRP78/Bip;pathology;immunohistochemistry; Western blot
2014- 05- 20
2014- 07- 18
全军医学科技“十二五”项目(CKJ12J022);科技部国家科技支撑计划(2012BAⅡ15B08)
1001-6325(2015)01-0017-05
文献标志码:A
*通信作者(corresponding author):zhhyjyi1487@163.com
