大鼠脑缺血后Notch分子上调调控血管新生
2015-08-07娄远蕾匡助才鲁友明张爱军邓志锋
娄远蕾,匡助才,鲁友明,张爱军,邓志锋,*,汪 泱,3*
(南昌大学 1.第一附属医院 泌尿外科研究所; 2.第二附属医院 神经外科, 江西 南昌 330006; 上海交通大学 附属第六人民医院 3.四肢显微外科研究所; 4.神经外科, 上海 200233)
大鼠脑缺血后Notch分子上调调控血管新生
娄远蕾1,匡助才2,鲁友明4,张爱军4,邓志锋2,4*,汪 泱1,3*
(南昌大学 1.第一附属医院 泌尿外科研究所; 2.第二附属医院 神经外科, 江西 南昌 330006; 上海交通大学 附属第六人民医院 3.四肢显微外科研究所; 4.神经外科, 上海 200233)
缺血性脑卒中是临床常见疾病,脑缺血发生后,神经细胞发生变性及坏死,可导致严重的神经功能缺损,尽快恢复缺血区血供是治疗缺血性脑卒中的关键。研究显示脑缺血后缺血区域有代偿性血管新生现象,它们对于增加脑缺血区血液灌注量和限制缺血半影区面积的扩散具有积极作用[1],揭示脑缺血后血管新生的分子机制,有助于为临床寻找新的治疗靶点。Notch信号通路在胚胎期血管发育和肿瘤血管形成中发挥重要作用[2],但它是否参与调控成体脑缺血后缺血皮质区微血管新生,尚不清楚。本研究观察大鼠脑缺血后Notch信号分子的变化及其与缺血皮质区血管新生的关系。
1 材料与方法
1.1 实验动物和主要试剂:清洁级7~9周龄雄性SD大鼠伴质量250~280 g [南昌大学医学院动物实验中心SYXK(赣)2010- 0002]。Notch1抗体(CST和Millipore公司),Hes1抗体、Ⅷ因子抗体、FITC标记的抗羊IgG和TRITC标记的抗兔IgG(Santa cruz公司),ECL化学发光试剂盒(Pierce公司)。
1.2 局灶性脑缺血大鼠模型的制作及分组:参考文献[3]制作大鼠大脑中动脉栓塞缺血损伤模型。模型成功的标志为右侧出现Horner’s征和左侧肢体神经功能缺损。将造模成功的大鼠随机分组,每组各5只,分别于再灌注后8 h、1和3 d 处死动物。以假手术组作为对照组。
1.3 蛋白免疫印迹:心脏灌注后游离出脑组织,提取皮质区组织蛋白。取30 μg总蛋白经电泳分离后转移至硝酸纤维素膜,分别加稀释后大鼠抗Notch1和羊抗Hes1,4 ℃过夜。加HRP标记的抗大鼠IgG和抗山羊IgG,室温1 h,ECL 检测杂交信号。以β-actin蛋白作为内参,通过Image J 软件对各组蛋白的表达进行半定量分析。
1. 4 免疫荧光组织化学染色:心脏灌注、取脑和固定,以8 μm作连续冰冻切片。
分别滴加小鼠抗Notch1和兔抗Ⅷ因子,37 ℃ 2 h。加FITC标记的羊抗小鼠IgG和TRITC标记的牛抗兔IgG,室温1 h。PBS漂洗后50%缓冲甘油封片,荧光显微镜下观察并拍照。
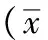
2 结果
2.1 缺血损伤激活脑组织Notch1分子:缺血1 d后脑组织活化Notch1蛋白(NICD)显著上调,缺血第3天表达量进一步升高(P<0.05)。缺血1和3 d,Notch1分子的靶基因Hes1蛋白的表达趋势与NICD一致(P<0.05)(图1)。
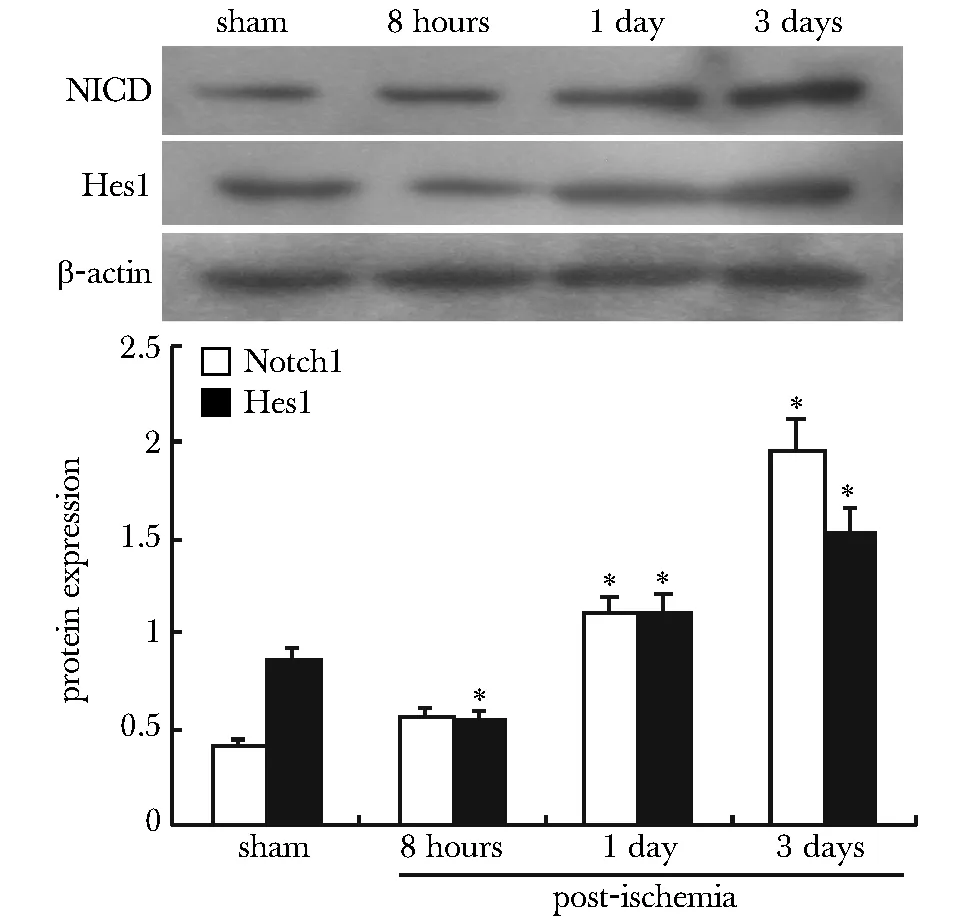
*P<0.05 compared with control图1 脑缺血后皮质区NICD及Hes1蛋白的表达Fig 1 Protein expression of NICD and Hes1 after cerebral ischemia
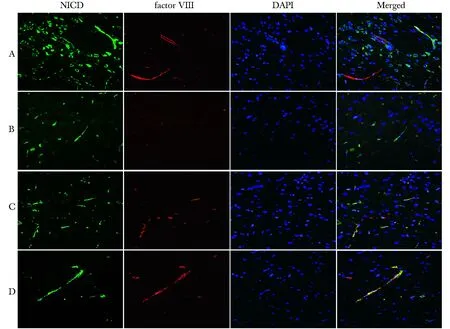
A.sham control; B.8 hours after ischemia; C.1 day after ischemia; D.3 days after ischemia
2.2 Notch信号途径参与脑缺血后血管新生的调控:正常脑组织中Vlll因子阳性细胞(TRITC标记)未观察到有NICD(FITC标记)的表达(图2A),脑缺血再灌注1 d后缺血皮质区内有少量内皮细胞表达NICD(图2C),脑缺血3 d表达NICD的内皮细胞数明显增加(P<0.05)(图2D),脑缺血8 h无明显双染阳性细胞(图2B)。
3 讨论
血管新生是指在原有血管的基础上内皮细胞增殖、迁移和重塑形成新血管的过程,涉及诸多生长因子和信号通路分子。Notch通路主要由Notch受体、配体及靶基因组成,它决定着细胞的分化和组织的发生。当配体与受体结合后Notch分子活化,释放受体胞内段活性结构域(NICD),启动Notch下游靶基因Hes1等的转录而发挥调控作用,Notch通路激活是血管发生和功能血管最终形成的重要调控因素[4]。
本研究显示脑缺血后脑组织缺血皮质区NICD蛋白的表达明显上调,提示Notch通路参与了脑缺血后的病理生理过程。本文采用免疫荧光双重染色,观察到脑缺血3 d缺血皮质区血管内皮细胞中NICD蛋白的表达较对照组显著上调,提示Notch信号通路参与了脑缺血后血管新生过程的调控。Notch1分子靶基因Hes1蛋白在脑缺血1 d后明显上调,缺血第3天仍有较高水平表达,表明Notch1可能通过上调其靶基因Hes1蛋白参与了脑缺血后微血管新生的调控,其具体机制还需更深入分析。
[1] Beck H, Plate KH. Angiogenesis after cerebral ischemia [J]. Acta Neuropathol,2009, 117: 481- 96.
[2] Kofler NM, Shawber CJ, Kangsamaksin T,etal. Notch signaling in developmental and tumor angiogenesis[J]. Genes Cancer, 2011,2:1106- 1116.
[3] Ma J, Zhao L, Nowak TS Jr. Selective, reversible occlusion of the middle cerebral artery in rats by an intraluminal approach. Optimized filament design and methodology [J]. J Neurosci Methods, 2006, 156: 76- 83.
[4] Gridley,T. Notch signaling in the vasculature[J].Curr Top Dev Bio, 2010, l92: 277- 309.
2014- 02- 12
2014- 06- 30
国家自然科学基金(81272170,81060324);江西省教育厅基金(GJJ11311)
1001-6325(2015)01-0097-02
R743
A
*通信作者(corresponding author):wangy63cn@126.com;dengzf63@126.com
