系统生物学指导下基于TRAIL网络靶向抗肿瘤研究进展
2015-08-07沈悦海郭晓汐王冠林张宽仁
左 晖,沈悦海,郭晓汐,王冠林,张宽仁*
(1.昆明理工大学 生命科学与技术学院 分子药理组, 云南 昆明 650504;2.昆明理工大学附属医院/云南省第一人民医院 药剂科, 云南 昆明 650032)
短篇综述
系统生物学指导下基于TRAIL网络靶向抗肿瘤研究进展
左 晖1,2,沈悦海1,郭晓汐1,王冠林1,张宽仁1*
(1.昆明理工大学 生命科学与技术学院 分子药理组, 云南 昆明 650504;2.昆明理工大学附属医院/云南省第一人民医院 药剂科, 云南 昆明 650032)
肿瘤是一种系统生物学疾病,治疗这一顽固疾病仅靠单一靶向药物已不太现实。本文将用系统生物学的观点,对肿瘤坏死因子相关凋亡配体(TRAIL)与现今研究较热点的靶向药物以网络“network”联合方式,协同抗肿瘤进行一个综述。以期待为基于TRAIL个体化治疗肿瘤提供夯实的理论依据。
TRAIL; 网络靶向;肿瘤; 研究进展
TRAIL作为肿瘤生物治疗的新型药物自发现以来就备受关注。目前对TRAIL单药及以TRAIL 为基础的多药联合治疗的作用机制在肿瘤治疗方面的研究已经取得较大进展[1]。 临床前研究及临床试验均已证实TRAIL是极具潜能的新型抗肿瘤药物。但因肿瘤细胞类型不同,癌细胞的基因易变性,以及肿瘤的异质性,单一药物的治疗常不尽如人意。因此,基于系统生物学的网络联合“network”药理学的多药靶联合治疗策略具有重要的研究前景。同时,由于癌症分子机制的复杂性,TRAIL与不同治疗手段联合具有不同的抑瘤效果,寻找适当的个体化治疗的组合靶标已成为研究的热点。
1 TRAIL 及其“network”网络联合的必要性
1.1 TRAIL与死亡受体
肿瘤坏死因子相关凋亡配体(tumor necrosis
factor related apoptosis-inducing ligand,TRAIL),又称凋亡素 2 配体(APO2L),是肿瘤坏死因子(TNF)超家族的新成员。最早由Wiley等[2]在1995 年从人心肌cDNA文库中克隆出来并命名。作为TNF家族新成员,与家族其他成员不同的是TRAIL对肿瘤细胞具有较高选择性,能特异性地诱导多种肿瘤细胞凋亡,对正常组织却无明显凋亡诱导作用, 这主要是 TRAIL 与其受体相互作用的结果[3]。TRAIL主要通过两条信号途径诱导细胞凋亡, 分别称为“ 内源性途径”和“外源性途径”, (图 1)都是通过活化半胱2 天冬氨酸蛋白酶(caspase) 系列分子启动凋亡过程[4]。其中, 死亡受体5(death receptor 5, DR5)起到了关键的作用[5]。有研究表明,TRAIL诱导Hela细胞凋亡的可能途径之一是通过线粒体进行的。TRAIL能够降低BcL- 2和MMP水平,使线粒体通透性增大,这样cytc和AJF释放加剧,分别通过caspases和非caspases依赖途径导致细胞凋亡[6]。另外,TRAIL的抗肿瘤作用为P53非依赖型, 其对P53变异或缺失的肿瘤细胞亦有较强的杀伤作用[7]。
1.2 TRAIL“network”联合应用
TRAIL广泛地表达于脾、淋巴结、肺、肾、卵巢和前列腺等大多数正常组织。TRAIL可特异性地诱导转化细胞、病毒感染细胞和肿瘤细胞发生凋亡,而对正常细胞基本没有影响。此外,在激活的T 细胞、自然杀伤细胞、单核细胞及树突状细胞中也发现了TRAIL的表达,这说明TRAIL与宿主防御和维持免疫稳态相关,并参与机体免疫调节[8]。
TRAIL独有的作用方式、独特的作用优势都为它在肿瘤治疗中的应用奠定了良好的基础,有望通过进一步的探索和研究,将其开发成为一种新型的抗癌药,并将为肿瘤的治疗研究带来新的希望。尽管对TRAIL的作用机制及其在肿瘤治疗方面的研究已经取得了长足的进展,但是还有许多空白领域有待人们继续探索[9]。
2 基于TRAIL网络靶向抗肿瘤治疗
2.1 TRAIL与Smac肽类及其类似物靶向协同作用
Smac 在细胞凋亡的线粒体以及死亡受体途径中均发挥着重要作用,其主要通过与IAP家族成员相互作用,解除IAPs对caspase活性的抑制,从而促进细胞凋亡[10]。有研究表明,TRAIL与凋亡抑制蛋白拮抗剂显示出协同抗癌作用, 如 Smac肽类合成物和Smac类似物可增强TRAIL诱导的各种肿瘤细胞凋亡。又如PI3K/AKT靶向抑制剂哌立福新可通过P53非依赖途径上调死亡受体DR5的表达并下调cFlip和XIAP来恢复急性粒细胞白血病对TRAIL的敏感性。 因此,该类制剂在增强协同抗癌反应性方面将有可能发挥巨大的潜能。
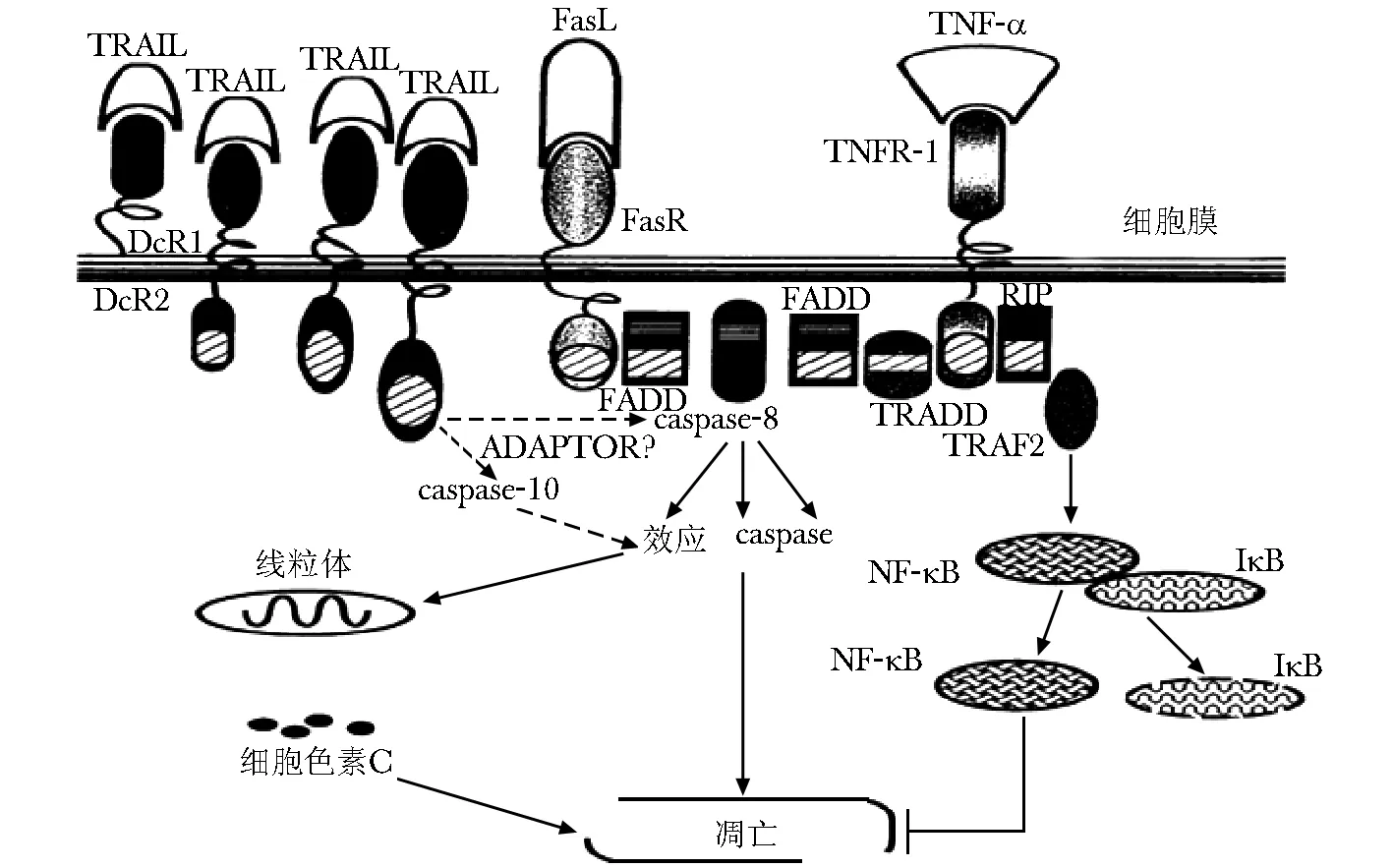
图1 死亡受体介导的TRAIL相关的凋亡通路Fig 1 The apoptosis pathways of TRAIL mediated by the death receptors
2.2 TRAIL与分子酪氨酸激酶抑制剂(TKIs)及蛋白酶体抑制剂协同
由于TRAIL与酪氨酸激酶抑制剂的作用机制完全不同,两种细胞杀伤机制药物的联用也许可以对肿瘤细胞产生更大的效应。有研究发现,Iressa与TRAIL联合可以明显增加Iressa敏感细胞系的凋亡,而且Iressa可以反转TRAIL的耐药性这为酪氨酸激酶抑制剂与TRAIL基因制剂的联用提供了可行性。还有研究表明scFv-EHD2-scTRAIL融合蛋白可以选择性增强TRAIL抗肿瘤细胞的作用[11]。
此外,蛋白酶体抑制剂MG132,ALLN联合TRAIL均能提高细胞表面 DR5表达量,显著增强TRAIL 诱导的凋亡效应。[12- 13]
2.3 Micro RNA对TRAIL的增敏作用
在对乳腺癌的研究中发现[14],miR- 146a在MDA-MB- 231/TR细胞中表达低,使血管内皮生长因子受体(EGFR)蛋白表达量增加,导致表皮生长因子(EGF)诱导的细胞迁移能力增强。进而揭示miR- 146a可以通过靶向调控IRAK- 1的表达来改变NF-κB的活化水平,最终影响细胞的迁移,最终对TRAIL不敏感的乳腺癌细胞迁移起重要的调节作用。
2.4 TRAIL与HSP90抑制剂联合应用
热休克蛋白(heat shock proteins, HSPs)是一种功能强大的分子伴侣。它是很多癌基因通路的重要组成部分。目前在体内发现的HSP90的200多个效应蛋白中包括在机体信号传导通路中起重要作用的蛋白激酶和转录因子,其中有酪氨酸激酶受体(Her-2)、EGFR、细胞周期依赖性激酶(CDK4)、突变型P53和低氧诱导因子1(HIF1)等对肿瘤生长转移的血液供应、营养支持、信号刺激和物质代谢起重要作用的蛋白质[15- 16]。
Hsp90抑制剂能抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、引起周期阻滞及促进Hsp90降解[17- 18]。由于其对肿瘤细胞亲和力是正常细胞的100倍以上,故对正常的组织细胞没有明显的不良作用。有报道发现,Hsp90抑制剂 Radicicol 可促进 caspase- 8活化、上调Bid依赖途径和线粒体依赖的凋亡途径来增强TRAIL对卵巢癌细胞系所诱导的凋亡[19]。Hsp90抑制剂17DMA(17-dimethylaminoethylamino- 17-demethoxygeldanamycin)能增强TRAIL对乳腺癌细胞所诱导的凋亡,它可下调受体相互作用蛋白(receptor interacting protein,RIP1)、同时抑制 IκB(nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor,alpha)的磷酸化[20]。
3 展望
诱导肿瘤细胞的凋亡是治疗肿瘤的方法之一,也是现今肿瘤学研究的热点之一。肿瘤坏死因子相关的凋亡诱导配体TRAIL,作为TNF超家族的一员,具有抗肿瘤活性强、但对正常细胞几乎无毒性等特点,并且可起到免疫监视作用,防止细胞癌变,是机体保持自身稳定的一种途径[21]。此外, TRAIL与化疗药物联合应用,特别是与靶向制剂网络联合,均表现出强大的协同抗肿瘤作用, 最近几年,重组截短的TRAIL 和拮抗TRAIL 受体的单克隆抗体的快速发展及其在临床试验中所展现出的振奋人心的效果,极大地推动了以TRAIL 为靶点在肿瘤治疗方面的研究[22]。相信随着对TRAIL及其调控网络的深入研究,基于TRAIL凋亡信号通路的“network”网络靶向抗肿瘤将为治疗肿瘤提供新的策略,也为临床肿瘤的个体化治疗提供理论依据和新的治疗方向。
[1] 陈娟,欧阳学农,余宗阳.基于TRAIL联合治疗的信号通路及协同作用机制研究进展[J].肿瘤学杂志, 2012,18:964- 967.
[2] French LE, Tschopp J. The TRAIL to selective tumor death[J]. Nat Med, 1999,5:146- 147.
[3] Di X,Zhang G,Zhang Y,etal. Accumulation of autophagosomes in breast cancer cells induces TRAIL resistance through downregulation of surface expression of death receptors 4 and 5[J]. Oncotarget,2013,4:1349- 1364.
[4] 于明燕.TRAIL基因多态性与临床疾病的相关性研究进展[J].滨州职业学院学报, 2011, 8:51- 53.
[5] 张磊磊,王坚. 肿瘤坏死因子相关凋亡诱导配体抗肿瘤作用研究进展[J].中华实用诊断与治疗杂志, 2013, 27:629- 631.
[6] 叶记林,刘永春,于有江,等.TRAIL诱导Hela细胞凋亡的线粒体信号通路[J].基础医学与临床,2011,31:1120- 1123.
[7] 李雪燕 杜晶春 徐霞. TRAIL 联合药物诱导肿瘤细胞凋亡协同机制的研究[J]. 分子诊断与治疗杂志, 2012,4: 206- 211.
[8] Thimme R. NKp46+ expression on NK cells as a biomarker for liver pathology and IFN-responiveness in HCV infection[J].Gut, 2014,63:382- 384.
[9] 聂金梅,徐雅君,邢永梅, 等. 肿瘤细胞对TRAIL耐受机制以及克服耐受性的研究进展[J].中国医药科学, 2011, 01: 43- 45.
[10] 秦思达,任宏,杨成成.Smac促凋亡机制及其与肺癌的关系[J].现代肿瘤医学, 2011,19:998- 1000.
[11] Oliver Seifert, Aline Plappert, Sina Fellermeier,etal. Tetravalent Antibody-scTRAIL Fusion Proteins with Improved Properties[J]. Mol Cancer Ther, 2014, 13:101- 111.
[12] Cheong HJ, Lee KS,Woo IS,etal. Up-regulation of the DR5 Expression by Proteasome Inhibitor MG132 Augments TRAIL-Induced Apoptosis in Soft Tissue Sarcoma Cell Lines[J]. Cancer Res Treat, 2011, 43: 124- 130.
[13] Lee YJ, Seol JW, Jeong JK,etal. Inhibition of the ubiquitin-proteasome system sensitizes TRAIL-resistant prostate cancer cells by up-regulation of death receptor 5[J]. Mol Med Report, 2011, 4: 1255- 1259.
[14] 刘丹,姜明红,刘敏,等.MiR- 146a调节TRAIL不敏感的乳腺癌细胞迁移及其分子机制[J].基础医学与临床,2013,33:881- 887.
[15] Pillai, Rathi N, Ramalingam, Suresh S. Heat shock protein 90 inhibitors in non-small-cell lung cancer [J]. Curr Opini Oncol, 2014, 26: 159- 164.
[16] Jeong CH, Park HB, Jang WJ,etal. Discovery of hybrid Hsp90 inhibitors and their anti-neoplastic effects against gefitinib-resistant non-small cell lung cancer (NSCLC)[J]. Bioorg Med Chem Lett, 2014, 24: 224- 227.
[17] Daniel W. Stuckey, Khalid Shah. TRAIL on trial: preclinical advances in cancer therapy[J]. Trends in Mol Med, 2013, 19: 685- 694.
[18] Grazia Saturno, Melanie Valenti, Alexis De Haven Brandon,etal. Combining TRAIL with PI3 Kinase or HSP90 inhibitors enhances apoptosis in colorectal cancer cells via suppression of survival signaling[J]. Oncotarget, 2013, 4: 1185- 1198.
[19] Kim YJ, Lee SA, Myung SC,etal.Radicicol, an inhibitor of Hsp90, enhances TRAIL-induced apoptosis in human epithelial ovarian carcinoma cells by promoting activation of apoptosis-related proteins[J]. Mol Cell Biochem, 2011, 29: 158- 160.
[20] Palacios C, López-Pérez AI, López-Rivas A. Down-regulation of RIP expression by 17-dimethylaminoethylamino- 17-demethoxygeldanamycin promotes TRAIL-induced apoptosis in breast tumor cells[J]. Cancer Lett, 2010, 287: 207- 215.
[21] 江伟,于茜,陆才德.TRAIL 与肿瘤关系的研究进展[J].医学综述, 2013, 19: 3304- 3307.
[22] 朱玲,王祥喜,李雪梅,等. TRAIL诱导肿瘤细胞凋亡的分子机制及其在肿瘤生物治疗中的应用前景[J].生物物理学报, 2012, 28: 448- 456.
Research progress of TRAIL network against tumor under the guidance of systems biology
ZUO Hui1,2, SHEN Yue-hai1, GUO Xiao-xi1, WANG Guan-lin1, CHANG Kwen-jen1*
(1.Lab of Molecular Pharmacology, Kunming University of Science and Technology, Kunming 650504; 2.Dept. of Pharmacology, the First People’s Hospital of Yunnan Province, the Affiliated Hospital of Kunming University of Science and Technology, Kunming 650032, China)
Tumor is a system-biology illness. Treatment of this intractable disease by any single medicine has not been realistic. In this review, we analyze the anti-tumor network of Tumor Necrosis Factor-related Apoptosis-inducing Ligand(TRAIL) by a system-biology technology and try to providecin individualized treatment strategy for TRAIL based therapy.
TRAIL; network targeting therapy; tumor; research review
2014- 03- 10
2014- 06- 22
云南省科技创新平台“云南省肿瘤转化医学工程技术研究中心”项目(2011DH011);昆明理工大学校人才培养项目(KKSY201326121)
1001-6325(2015)01-0122-04
R730.5
A
*通信作者(corresponding author):zuohui80@hotmail.com;Kwenjenchang@yahoo.com
