原发性肺黏液腺癌的影像学表现
2015-08-07邓生德汪建华于志海俞文英周成伟王玉涛
涂 灿,邓生德,汪建华,于志海,俞文英,邓 茜,周成伟,王玉涛,于 亮,江 凯
·全科医生技能发展·
原发性肺黏液腺癌的影像学表现
涂 灿,邓生德,汪建华,于志海,俞文英,邓 茜,周成伟,王玉涛,于 亮,江 凯
目的 探讨原发性肺黏液腺癌(PPMA)的影像和临床、病理特征及影像诊断价值。方法 收集2011年3月—2014年3月宁波大学医学院附属医院经手术病理或穿刺活检证实的7例PPMA患者的临床、影像及病理资料。7例患者均行CT平扫,其中4例行CT多期增强扫描,1例行MR平扫及MR多期增强扫描。观察其影像学表现并与临床和病理结果进行对照。结果 4例单发结节型,1例多发结节型,2例实变型,共9个病灶。外围及胸膜下分布8个,另1个占据整个肺左下叶。最大径0.5~17.3 cm,平均(4.9±5.0) cm。7例病变均未见出血、钙化,分叶、空泡征、血管集束征各4例,空气支气管征、支气管截断征、晕征、胸膜凹陷征各3例,细小短毛刺、棘状突起、碎石路征、卫星播散病灶、血管造影征、肺叶膨隆各2例;3例呈囊实性,实性成分均以边缘分布为主或内部散在斑片样分布;1例MR白肺征,实性成分弥散加权成像(DWI)明显高信号,表观扩散系数(ADC)值明显降低。6例术后病理均为浸润型肺黏液腺癌,分期为Ⅰa期1例,Ⅱa期1例,Ⅲa期4例。1例穿刺活检证实为肺黏液腺癌。结论 PPMA的影像及病理表现有一定的特异性,正确认识其病理学特点,有助于提高对其影像征象的理解和认识。对怀疑肺黏液腺癌的肺实变患者应常规行MR重T2加权像(T2WI)及DWI。
原发性肺黏液腺癌;体层摄影术,X线计算机;磁共振成像;病理学
涂灿,邓生德,汪建华,等.原发性肺黏液腺癌的影像学表现[J].中国全科医学,2015,18(15):1849-1853.[www.chinagp.net]
肺黏液腺癌是2011年肺腺癌国际多学科分类中一个新的术语,为腺癌的一种特殊类型[1]。原发性肺黏液腺癌(primary pulmonary mucinous adenocarcinoma,PPMA)临床少见,其临床表现无特异性,极易误诊为肺炎、肺结核及其他肺部疾病,导致延误治疗[2]。肺黏液腺癌在所有分化良好的腺癌中占30%,较其他类型肺癌5年生存率更长[1]。PPMA国内多以临床、病理分析为主[2-4],影像学分析多以个案报道为主[5-6]。本文收集7例经手术病理或穿刺活检证实的PPMA患者的临床、影像及病理资料,并复习相关文献,总结和分析该病的影像特征与病理特征的相关性及影像诊断价值,以提高对PPMA的认识及诊断水平。
1 资料与方法
1.1 一般资料 收集2011年3月—2014年3月宁波大学医学院附属医院经手术病理或穿刺活检证实的7例PPMA患者,其中男6例,女1例;发病年龄54~75岁,中位发病年龄65岁,平均发病年龄63.9岁;病程1个月~2年。临床以反复出现咳嗽、咳痰就诊3例:1例咳大量白色黏痰,1例轻微胸痛,1例气促;1周前受凉后出现流涕、咳嗽、咳痰、发热就诊1例;体检时发现2例;痔疮术前常规胸部X线片检查发现1例。所有患者无消化道症状及其他脏器肿瘤病史。吸烟者5例,均为男性,吸烟>20支/d,烟龄34~40年。
1.2 影像学检查 7例患者均行CT平扫,其中4例行CT多期增强扫描,1例行MR平扫及MR多期增强扫描。CT扫描均采用Philipsi CT 256层螺旋CT机,扫描条件为:120 kV、230 mA,层厚5 mm,层间距5 mm;对比剂采用非离子型对比剂碘海醇(350 mg I/ml),剂量1.5 ml/kg,采用高压注射器经肘静脉团注,注射速率为3.0 ml/s,延迟时间30~180 s。MR平扫采用GE Signa HDXT 1.5 T双梯度超导MR仪,腹部相控阵线圈,所有序列采用呼吸门控和屏气扫描。检查序列包括平扫轴面、冠状T1加权像(T1WI),快速梯度回波(FSPGR)双回波序列及轴面T2加权像(T2WI),快速回聚快速SE(FRFSE)序列,轴面T1WI FS FSPGR双回波序列及T2WI FS FRFSE序列,轴位重T2WI及弥散加权像(DWI)(b=800),轴面、冠状面三维容积超快速多期动态增强扫描(3D LAVA)序列,轴面扫描层厚6 mm,间隔3 mm,冠状面扫描层厚8 mm,间隔4 mm。对比剂为Gd-DTPA 1.0 mmol/kg,注射速率为2.0 ml/s,经肘静脉注射并分别于注射前及注射后25、60、90、120 s行轴面动态增强扫描,延迟180 s扫描冠状面。
1.3 图像分析与测量 所有患者图像由2名高年资主治医师独自阅片分析,对病变的部位、数目、形态、最大径、边缘及周围情况、密度、内部结构及强化表现、有无纵隔、肺门肿大淋巴结及胸膜、胸壁侵犯进行评价。对1例行MR平扫的病变信号(与背部肌肉对比)、增强表现进行观察分析,并将DWI传至高级工作站(ADW )4.5工作站,自动生成表观扩散系数(ADC)图和DWI,参照病变在常规平扫、增强序列图像和DWI上的位置,在ADC图中选取感兴趣区,测量其ADC值,分别测量3次,取其平均值作为病变的ADC值。意见不一致时与1名高级医师共同协商确定。
1.4 实验室及其他辅助检查 所有患者行红细胞沉降率、血常规、肿瘤标志物及腹部B超检查,5例行低剂量CT引导经皮肺穿刺活检,3例行纤维支气管镜检查。
1.5 手术方式及病理检查 5例行根治性肺叶切除及淋巴结清扫术,1例行姑息性切除术,手术切除的标本行常规固定和HE染色及免疫组化染色。
2 结果
2.1 CT表现
2.1.1 病变部位、数目、形态及最大径 单发6例,多发1例,总共9个病灶。
本研究背景:
原发性肺黏液腺癌(PPMA)临床少见,其临床表现无特异性,极易误诊为肺炎、肺结核及其他肺部疾病,导致延误治疗。PPMA国内多以临床、病理分析为主,影像多以个案报道为主,且其MRI表现少有报道。本文总结和分析PPMA的影像特征与病理的相关性及影像诊断价值,强调MRI在实变型黏液腺癌的诊断价值。
肺右上叶4个,右下叶1个,左上叶2个,左下叶2个。外围及胸膜下分布8个,其中1个位于纵隔胸膜下(见图1);1个占据整个肺左下叶。结节型(类圆形、类椭圆形或不规则形)5例,其中4例呈单发结节,1例呈多发结节;实变型2例。最大径0.5~17.3 cm,平均(4.9±5.0) cm,除1个结节为0.5 cm(出现在多发结节患者中),其余病变均大于2.0 cm。
2.1.2 病变边缘及周围情况 6例边缘毛糙不整,分叶、血管集束征各4例,晕征、胸膜凹陷征、支气管截断征各3例(见图2),细小短毛刺、棘状突起、碎石路征各2例,肺叶膨隆2例(见图3A),2例病变所在肺叶有卫星播散病灶,1例边缘呈不规则厚壁状(见图1B)。
2.1.3 病变的密度、内部结构及强化表现 7例均未见出血、钙化,4例有空泡征,且分布于病灶边缘部(见图2、3A)。3例内部见空气支气管征,其中2例呈病理性支气管(见图3A)。行CT平扫及CT增强扫描的4例患者,血管造影征2例(见图3A、B),3例密度不均匀,呈囊实性,实性成分均以边缘分布为主或内部散在斑片样分布(见图3B),1例密度均匀;实性成分平扫CT值29.5~36.9 HU,平均(34.0±3.5)HU。CT增强扫描后,囊性成分无强化,实性成分中度或明显强化,强化幅度25.9~59.5 HU,平均(40.0±15.0) HU,1例于60 s达峰值,而后缓慢下降,另3例于120~180 s仍持续强化。
2.1.4 纵隔、肺门肿大淋巴结及胸膜、胸壁侵犯情况 5例有纵隔肿大淋巴结,1例有肺门肿大淋巴结,其中1例纵隔肿大淋巴结内部出现明显坏死。均无胸膜、胸壁侵犯。
2.2 MR表现 肺叶膨隆,以长T1、长T2信号为主(见图3C),重T2WI呈明显高信号,呈白肺征(见图3D),可见血管造影征及病理性空气支气管征,边缘多发含气小泡状低信号;内部及边缘散在分布斑片状、片絮状实性成分,呈等T1、等T2信号(见图3C、D),DWI呈高信号(见图3E),ADC值明显减低(ADC=1.42×10-3mm2/s)(见图3F);MR增强扫描后,实性成分明显强化,黏液成分无强化(见图3G)。
2.3 病理特征 6例手术患者大体病理肉眼见肿物呈灰白色、湿润、半透明似胶冻状;镜下肿瘤细胞排列成细支气管肺泡结构或腺腔,细胞呈柱状或杯状,胞质丰富、透亮呈分泌状,胞核位于基底,细胞异型不明显或轻度,核分裂象罕见,肺泡及腺腔内充满黏液,部分浸润间质(见图4)。免疫组化均呈CK7(+)、CK5/6(-)、P63(-),2例CK20(+)、甲状腺转录因子1(TTF-1)部分(+)(见图5A、B)。6例术后病理均为浸润型肺黏液腺癌,分期为Ⅰa期1例,Ⅱa期1例,Ⅲa期4例。另1例未行手术治疗,经穿刺活检证实为肺黏液腺癌。
2.4 影像诊断 CT检查4例单发结节型中1例误诊为纵隔肿瘤,另3例诊断为肺癌;1例多发结节型及2例实变型均误诊为肺炎症性病变。实变型1例MR检查诊断为肺黏液腺癌。
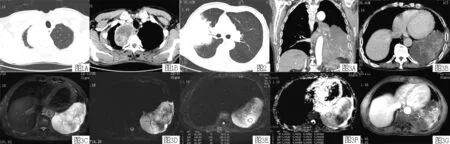
注:患者,男,57岁
图1 A (肺窗)、B(CT增强扫描静脉期)显示肺右上叶尖段纵隔胸膜下类椭圆形肿块,内部囊性成分无强化,边缘呈不规则厚壁,明显强化
Figure 1 A(lung window) and B(CT enhanced venous phase) showed a oval mass in mediastinal subpleura of apical segment of the right lung,which cystic components were no enhancement and the edge was enhanced obviously thick and irregular wall
注:患者,男,66岁
图2 右上肺实变,上叶及前段支气管开口呈鱼嘴样狭窄,后段支气管截断,边缘呈磨玻璃样(晕征),且见多发小空泡
Figure 2 The consolidation in the right upper pulmonary showed the upper lobe and anterior segmental bronchus opening were stricture like fish mouth,posterior segmental bronchus was truncation,the edge was ground glass (halo sign) and there were many small vacuoles in it
注:患者,男,75岁
图3 A、B 为CT增强扫描显示肺左下叶实变,肺叶膨隆,实变影内见病理性支气管征、血管造影征,上缘多发小空泡,囊性成分无强化,肿瘤实性成分中度强化,以病变边缘分布为主,肺门未见肿块;C为T2压脂像黏液成分呈高信号,肿瘤实性成分呈低信号,呈片絮状分布于病变边缘部;D为 T2黏液成分仍呈高信号;E为DWI 肿瘤实性成分明显高信号;F为ADC图ADC值明显减低(ADC=1.42×10-3mm-2/s),G为MR增强扫描显示实性成分明显强化,黏液成分无强化
Figure 3 A and B enhanced CT showed left lower lobe pulmonary consolidation,lung lobe distention,pathological bronchial sign and angiogram sign in the lesion,multiple small vacuoles within the upper edge of the lesion,cystic components without enhancement,solid components with moderate enhancement and distribution mainly in the edge of the lesion,no mass in hilus of the lung;C T2 fat suppression showed mucus components with high signal,solid components with low signal and distribution in the edge of the lesion;D mucus components still showed high signal in T2;E solid components with significantly higher signal in DWI;F ADC diagram showed the ADC value of the solid lesions were significantly lower (ADC=1.42×10-3mm-2/s);G MR enhancement showed the solid components with obvious enhancement and mucus components without enhancement
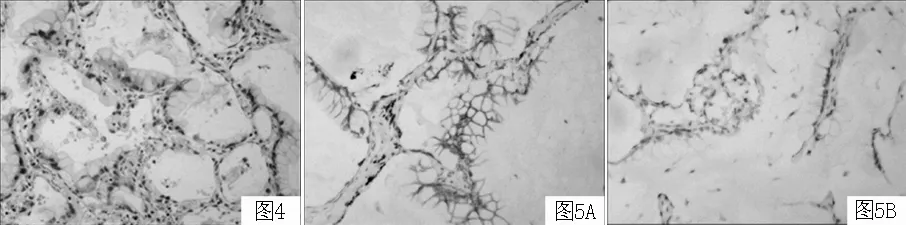
图4 手术后标本病理切片,肺泡腔内充满大量黏液,癌细胞胞质透亮、细胞核位于基底部,沿细支气管肺泡壁伏壁生长及漂浮在大量黏液湖中(HE染色,×200)
Figure 4 Pathological specimens after operation showed the alveolar spaces were filled with mucus,cancer cells with cytoplasmic lucency,the nucleus located in the basal part of cells,growth along the bronchial alveolar wall and floating in the mucus lake
图5 A为CK7阳性,B为P63阴性(免疫组化染色,×100)
Figure 5 Immunohistochemical staining showed CK7 positive in A and P63 negative in B
3 讨论
3.1 PPMA的临床与病理表现 PPMA多见于中老年患者[2],本组中位发病年龄为65岁,与普通型腺癌患者的平均67岁接近。肺腺癌一般以女性较多见[7],本组男女发病之比为6∶1,可能与样本数少有关。临床表现无特异性,不易早期发现。本组3例为体检或偶然发现。肺黏液腺癌分泌大量黏液导致肺泡内黏液增多,患者可咳出大量白色黏痰[8],但多在病变晚期出现,且无特异性,本组仅1例病变占据整个左下肺叶的患者出现反复咳大量白色黏痰。
根据最新肺腺癌分类标准[1],PPMA包括黏液性原位腺癌(AIS)、微浸润腺癌(MIA)及浸润型黏液腺癌,前两者非常罕见。PPMA的病理特征为癌组织呈界限不清的灰褐色、柔软、半透明似胶冻状。由于癌细胞分泌较多的黏液并堆积在细胞中,将细胞核挤压到细胞的一侧呈新月形,肺泡内可见大量的黏液。癌细胞产生的细胞外黏液形成大小不等的黏液池(黏液湖),常可见成堆或散在的癌细胞漂浮在其中,黏液湖周围常有结缔组织反应[9]。肿瘤细胞具有杯状或柱状细胞形态,不典型增生细胞不明显或缺如,当发现间质浸润,则肿瘤细胞分泌黏蛋白减少及不典型增生增多[10]。PPMA的组织学特征与转移性胃肠道腺癌极为相似,有时需要结合免疫组化检测免疫表型以鉴别[4]。文献研究证实,PPMA具有独特的免疫表型:高表达CK7,部分表达TTF-1、CK20,而转移性胃肠道腺癌高表达CK20,而阴性表达CK7、TTF-1[4]。PPMA分化程度高,恶性程度较低,临床症状出现的晚,本组6例PPMA患者的病理分期位于Ⅰa~Ⅲa期,所有患者术前未发现远处及对侧肺转移。
3.2 PPMA的影像诊断价值及其影像学表现 PPMA影像上可分为单发结节型、实变型及多发结节型。
3.2.1 单发结节型 本组4例表现为单发结节,均位于肺外围及胸膜下。1例位于纵隔胸膜下而误诊为纵隔肿瘤,其余3例术前诊断为肺癌。通过本组患者总结,笔者认为,PPMA除具备一般肺癌的影像特征外,还有一些相对特异的影像特征:(1)由于肿瘤内含有黏液成分,其密度常低于肌肉的密度;(2)晕征及碎石路征,晕征是围绕病变周围的磨玻璃影,边界常不清,病理上,磨玻璃影相当于分泌到肺泡间隙的黏液及巨噬细胞聚集或肺泡周围部分,被肿瘤细胞替代而肺泡间隙未被完全填充[11]。碎石路征见于晕征背景上,为肿瘤细胞沿肺泡间隔生长,肺泡壁增厚,但肺泡未闭塞,其内可见少量黏液或脱落的肿瘤细胞;(3)空泡征,尤其是病变边缘部或周围磨玻璃影内出现空泡征,其病理基础主要是尚未被肿瘤破坏、替代的肺结构,如肺泡、扩张扭曲的未闭细支气管等[12];(4)粟粒状卫星瘤灶,呈“卫星”样围绕病变,小叶中心分布,多呈磨玻璃影,这可能与肿瘤沿气道播散或分泌黏液有关。本组1例单发结节CT增强扫描后呈中度强化,且密度均匀,并未出现明显黏液或囊性成分,另一呈囊实性肿块的患者,内部为囊性密度,实性成分分布于病变边缘,呈不规则厚壁状,且厚壁明显强化,与文献报道肿块无或轻度强化有所不同[5-6],这可能与黏液池周围常有结缔组织反应使病变呈结节样或周围间质浸润时,肿瘤细胞分泌黏蛋白减少及不典型增生增多有关。
3.2.2 实变型 实变型PPMA是唯一在影像学上表现为非支气管阻塞性的实变的肺癌[13],其影像学表现与大叶性肺炎、干酪性肺炎等肺部感染性病变相似,常被误诊。本组1例表现为不完全的肺叶实变,另1例表现为整个肺叶的实变,CT均误诊为大叶性肺炎,后1例MR诊断正确。本研究发现,MR平扫也能达到CT增强扫描的显示征象效果,可通过信号强度的变化而间接做出诊断。复习相关文献,总结其相对特异的影像特征主要有:(1)外围性分布,其起源于细支气管黏液杯状细胞。(2)肺叶膨隆,肿瘤产生的黏液可使肺叶膨胀,导致叶间裂向外膨隆。(3)病理性支气管充气征,见于病变后期,表现为叶段性实变内见走行僵硬、分支少、呈“枯树枝”状的充气支气管。病理基础是肿瘤细胞沿支气管壁伏壁生长及肺泡腔内黏液挤压。(4)空泡征,实变病灶边缘多发含气小囊状透亮影。(5)晕征及周围卫星瘤灶,晕征为实变中央相对密实,边缘浅淡,逐渐过渡为磨玻璃影;病变周围出现结节播散灶,且邻近病变的结节逐渐与病变结节相互融合,是由于肿瘤细胞或黏液沿支气管播散而形成,或沿肺泡间隔或肺泡孔蔓延所致[14]。(6)实性成分以边缘分布为主,当黏液成分较多时,实性成分呈斑片絮状分布于病灶内部或边缘,以增强扫描后期显示最清楚。其原因是:癌细胞产生的细胞外黏液形成大小不等的黏液湖,癌细胞成堆或散在地漂浮在其中;或黏液组织挤压癌细胞偏向边缘侧;增强扫描后期,黏液及癌细胞强化程度差异大。(7)“白肺征”,MR重T2WI上黏液成分表现为明显高信号,此征象对肺黏液腺癌的诊断有高度的特异度和灵敏度[13,15]。“白肺征”也可见于阻塞性肺炎,可通过发现中央气道内肿块予以鉴别。(8)DWI明显高信号,病变实性成分弥散显著受限,呈明显高信号,实性成分ADC值明显降低。癌细胞内及细胞外黏液蛋白分泌,造成细胞内、外水分子弥散明显受限;PPMA癌细胞沿肺泡壁生长并相对保留肺的组织结构,其癌组织细胞密度低于鳞癌等其他组织类型肺癌,DWI及ADC值有助于肺良恶性病变的诊断,不同病理类型的肺癌间ADC值亦有差异[16]。
3.2.3 多发结节型 本组该例PPMA患者合并肺炎,在临床抗感染治疗中,肺炎性结节吸收好转,而恶性结节依旧存在,且部分结节具有融合趋势,出现新的斑片状实变影,邻近的结节与实变影亦具有融合趋势。过去常认为多发结节是病变经气管或淋巴管肺内播散的结果,但现在多数学者支持多克隆假说,即多发结节不一定是肺内转移[17]。本型主要CT征象有:(1)母瘤,即多发结节中一较大的肿块,其位于肺外围及胸膜下,可见分叶、毛刺、空泡、晕征及胸膜凹陷等征象。(2)结节融合、结节与实变融合趋势,由于肿瘤细胞或黏液沿肺泡间隔、肺泡孔蔓延。
综上所述,PPMA是一种分化良好的肿瘤,其临床表现无特异性且常与影像学表现不相符。PPMA的影像学及病理表现有一定特异性,正确认识其病理学特点,有助于提高对其影像特征的理解和认识。对怀疑肺黏液腺癌的肺实变患者应常规行MR重T2WI及DWI。
[1]Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/American Thoracic Society/European Respiratory Society:international multidisciplinary classification of lung adenocarcinoma:xecutive summary[J].Proc Am Thorac Soc,2011,8(5):381-385.
[2]Zhang J,Chen C,Zheng H,et al.Clinicopathologic analysis of 57 cases of primary pulmonary mucinous adenocarcinoma[J].Chinese Journal of Oncology,2009,31(1):66-68.(in Chinese) 张洁,陈昶,郑卉,等.57例原发性肺黏液腺癌的临床分析[J].中华肿瘤杂志,2009,31(1):66-68.
[3]徐小雄,姜格宁.肺黏液性腺癌的研究进展[J].中华胸心血管外科杂志,2012,28(10):632-635.
[4]Wei QZ,Liu JH,Zhang ZX,et al.Expression and significance of TTF-1,CK7,CK5/6,P63 and CK20 in mucin producing lung cancer[J].Chinese Journal of Difficult and Complicated Cases,2010,9(11):822-824.(in Chinese) 魏清柱,刘江欢,张志雄,等.TTF-1、CK7、CK5/6、P63和CK20在黏液性肺癌中的表达及意义[J].疑难病杂志,2010,9(11):822-824.
[5]倪文光,姜风.原发性肺黏液腺癌1例[J].中外健康文摘,2012,9(49):131.
[6]田风,白松,金燕芬,等.原发性肺粘液腺癌1例报道[J].中国癌症杂志,2006,16(12):1088-1089.
[7]Zhu XX,Hu CP.Recent progress in susceptibility mechanisms of lung adenocarcinoma in female patients[J].Chinese Journal of Tuberculosis and Respiratory Diseases,2009,32(7):530-532.(in Chinese) 祝小霞,胡成平.女性肺腺癌易感性机制的研究进展[J].中华结核和呼吸杂志,2009,32(7):530-532.
[8]Popat N,Raghavan N,McIvor RA.Severe bronchorrhea in a patient with bronchioloalveolar carcinoma [J].Chest,2012,141(2):513-514.
[9]Pelosi G.The new taxonomy of lung adenocarcinoma stemming from a multidisciplinary integrated approach:novel pathology concepts and perspectives[J].J Thorac Oncol,2011,6(2):241-243.
[10]Oda S,Awai K,Liu D,et al.Ground-glass opacities on thin-section helical CT:differentiation between bronchioloalveolar carcinoma and atypical adenomatous hyperplasia[J].AJR Am J Roentgenol,2008,190(5):1363-1368.
[11]Sawada E,Nambu A,Motosugi U,et al.Localized mucinous bronchioloalveolar carcinoma of the lung:thin-section computed tomography and fluorodeoxyglucose positron emission tomography findings [J].Jpn J Radiol,2010,28(4):251-258.
[12]Fan L,Yu H,Liu SY,et al.Comparison of multi-slice CT findings between malignant focal pulmonary ground-glass opacity nodules and solid nodules of 3 cm or less[J].Chinese Journal of Radiology,2010,44(1):16-19.(in Chinese) 范丽,于红,刘士远,等.3 cm以下肺恶性局灶性磨玻璃结节与实性结节螺旋CT征象对照[J].中华放射学杂志,2010,44(1):16-19.
[13]王迪,于红.肺黏液腺癌的影像学与病理学研究进展[J].国际医学放射学杂志,2012,35(5):426-429.
[14]Wen F,Hu L,Dai QC,et al.CT features and misdiagnostic analysis of pneumonic-type lung carcinoma[J].Journal of Practical Radiology,2013,29(9):1426-1428.(in Chinese) 闻芳,胡粟,戴启春,等.肺炎型肺癌的CT表现及误诊分析[J].实用放射学杂志,2013,29(9):1426-1428.
[15]Gaeta M,Ascenti G,Mazziotti S,et al.MRI differentiation of pneumonia-like mucinous adenocarcinoma and infectious pneumonia[J].Eur J Radiol,2012,81(11):3587-3591.
[16]Chen GX,Qu CH,Zheng T,et al.Differentiation of pulmonary benign and malignant lesions with diffusion-weighted MR imaging[J].Radiologic Practice,2013,28(7):763-766.(in Chinese) 陈光祥,屈春晖,郑婷,等.MR扩散加权成像鉴别肺良恶性病变[J].放射学实践,2013,28(7):763-766.
[17]Zhou LN,Wu N.Imaging features of synchronous multiple primary lung adenocarcinomas on CT:comparison with histopathology[J].Chinese Journal of Medical Imaging Technology,2012,28(4):676-679.(in Chinese) 周丽娜,吴宁.同时多原发肺腺癌的CT表现与病理对照[J].中国医学影像技术,2012,28(4):676-679.
修回日期:2015-03-13)
(本文编辑:李婷婷)
Tu C,Deng SD,Wang JH,et al.Imaging features of primary pulmonary mucinous adenocarcinoma[J].Chinese General Practice,2015,18(15):1849-1853.
Imaging Features of Primary Pulmonary Mucinous Adenocarcinoma
TUCan,DENGSheng-de,WANGJian-hua,etal.DepartmentofRadiology,theAffiliatedHospitalofSchoolofMedicineofNingboUniversity,Ningbo315020,China
Objective To study the imaging,clinical and pathologic characteristics of primary pulmonary mucinous adenocarcinoma (PPMA) and their diagnostic value.Methods Seven patients with histopathologically or needle biopsy proved PPMA in the Affiliated Hospital of School of Medicine of Ningbo University from March 2011 to March 2014,were selected as study subjects,the imaging,clinical and radiographic data of the subjects were collected.All patients underwent CT plain scan,among them,4 patients underwent CT multi-phase enhanced scan,and 1 patient underwent MR plain scan and multi-phase enhanced scan.Imaging findings were analyzed and compared with clinical and pathologic findings.Results 7 patients had 9 lesions,among whom 4 patients had solitary nodule,1 patient had multiple nodule and 2 patients had nodular consolidation.Of the 9 lesions,8 lesions were located in peripheral areas or under the pleural membrane,another lesion occupied the whole of the left lower lobe.The maximum diameter of the lesions ranged from 0.5 to 17.3 cm〔mean value was(4.9±5.0 )cm〕.Hemorrhage and calcification were not found among all lesions in 7 patients;lobulated sign,vacuole sign and vascular convergence sign was found in 4 cases respectively;air bronchograms,bronchial cut-off sign,halo sign and pleural indentation sign was found in 3 cases respectively;spiculation,spiculate protuberance,crazy paving pattern,′satellite′ disseminated nodules,angiogram sign and lung lobe distention was found in 2 cases respectively;3 cases had solid cystic lesions,solid components showed marginal distribution or internal scattered patchy distribution;MRI features of the lesion in 1 case showed "white lung sign",diffusion weighted imaging (DWI) of solid components showed obviously high signal and the apparent diffusion coefficient (ADC) value decreased obviously.6 patients had histopathologically proved invasive mucinous adenocarcinoma of lung,among whom 1 was in stage Ia,1 was in stage Ⅱa,4 were in stage Ⅲa.Conclusion PPMA had specific imaging and pathologic characteristics,understanding of the pathologic characteristics correctly can contribute to improving the image understanding.Lung consolidation patients with suspected pulmonary mucinous adenocarcinoma should undergo routinely MRI heavy T2WI and DWI.
Primary pulmonary mucinous adenocarcinoma;Tomography,X-ray computed;Magnetic resonance imaging;Pathology
315020浙江省宁波市,宁波大学医学院附属医院放射科(涂灿,邓生德,汪建华,于志海,王玉涛,于亮,江凯),胸外科(周成伟);宁波市临床病理诊断中心(俞文英,邓茜)
邓生德,315020浙江省宁波市,宁波大学医学院附属医院放射科;E-mail:dengsd116@163.com
R 734.2
D
10.3969/j.issn.1007-9572.2015.15.025
2014-12-21;
