脂肪酶的固定化及其性能研究
2015-08-06程娟鹿保鑫王霞易伟民
程娟,鹿保鑫,王霞,易伟民
(黑龙江八一农垦大学食品学院,大庆 163319)
脂肪酶是一类特殊的酯键水解酶[1],能催化油脂水解,生成脂肪酸、甘油和甘油单酯或二酯。此外,还可以用于生物表面活性剂的合成、多肽合成、聚合物的合成和药物的合成等[2]。而固定化脂肪酶是将脂肪酶通过物理或化学的方法制备成为不溶于水的,但仍具有催化活性的复合体,这一过程是将单体的游离脂肪酶转变成了复合脂肪酶催化剂[3-4]。将脂肪酶进行固定化,可以提高酶的专一性以及稳定性等,使酶的性质更加稳定,且反应条件温和,副产物少,易于分离[5]。目前固定化脂肪酶的制备上还存在一些限制因素[6-7],例如,在固定化上载体的设计上、在制备和选用上,固定化脂肪酶的方法等方面[8]。
在特异性上脂肪酶的区分不是很明显,根据反应条件的不同,其特异性也有差异[9],所以,试验以两种不同的脂肪酶为原料,分别进行固定化,考察了硅烷化试剂添加量、硅藻土与酶的质量比、温度、时间等四个因素对酶的固定化的影响,并对影响因素进行了单因素试验,确定了最佳的工艺参数,希望为实际生产提供理论依据和技术上的支持。
1 材料与方法
1.1 原料与试剂
脂肪酶(Lipase):Sigma 公司生产;乙烯基三甲氧基硅烷,南京化学试剂有限公司;盐酸,南京化学试剂有限公司;过氧化氢,南京化学试剂有限公司;甲苯,南京化学试剂有限公司;乙醇,南京化学试剂有限公司。
1.2 主要仪器
DK-S24 电热恒温水浴锅,上海森信实验仪器有限公司;AR2140 电子天平,梅特勒-托利多仪器有限公司;RE52-98 旋转蒸发仪,上海亚荣生化仪器厂;SHY-2 恒温水域振荡器,江苏金坛环宇科学仪器厂;JJ-1 精密定时电动搅拌器,江苏金坛荣华仪器制造有限公司;LD4-40 低速大容量离心机,北京京立离心机有限公司。
1.3 试验方法
1.3.1 羟基化处理
准确称取20 g 硅藻土颗粒,将其放在容量为250 mL 的圆底烧瓶中,分别向其中加入1 mol·L-1的HCl 35 mL,再加入质量分数为25%的H2O2溶液35 mL,最后加入175 mL 的去离子水,充分混匀,然后用搅拌桨在80 ℃水浴锅条件下搅拌5 min 后,停止搅拌静置分层,将上层混合液倒掉,反复用去离子水洗涤至少5 次,取出硅藻土,放置在平皿上,放置在70 ℃的恒温干燥箱中干燥。
1.3.2 硅烷化处理
称取10 g 经过羟基化处理后的硅藻土放置在容量为100 mL 的圆底烧瓶中,依次向其中加入少量硅烷化试剂和40 mL 甲苯充分混匀,用搅拌桨于室温条件下搅拌1 h,待反应结束后,静置分层,倒掉上层混合液,用甲苯和乙醇的混合液充分洗涤硅藻土3次以上,取出硅藻土,放置在平皿中室温干燥即可得到经硅烷化处理后的硅藻土。
1.3.3 脂肪酶的固定和活力测定
在4 mL pH 7.0,0.03 mol·L-1的tris-HCl 缓冲溶液中加入0.02 g 脂肪酶,分装在离心管中,离心条件为8 000 r·min-1离心10 min,用移液枪分别称取上清液于50 mL 烧杯中,将一定质量的经过处理后硅藻土载体加入到酶液中,将瓶口密封,将其放在一定温度的摇床中缓慢震荡一定时间后取出,过滤烧杯中的混合物,用同样的缓冲液冲洗固体数次,最后将其取出,放置在平皿上,干燥。这时所得的即为吸附固定化酶。而酶的活力测定参照国标GB/T5523-2008测定。
1.3.4 硅烷化试剂添加量对固定脂肪酶活力的影响
硅烷化添加量分别调为0.1%、0.2%、0.3%、0.4%、0.5%和0.6%,硅藻土与酶的质量比为4∶1,固定温度为30 ℃,固定时间为6 h。在此条件下,检验硅烷化试剂对固定化脂肪酶活力的影响。
1.3.5 硅藻土与酶质量比对固定脂肪酶活力的影响
硅藻土与酶的质量比分别调为1∶1、2∶1、3∶1、4∶1、5∶1 和6∶1,硅烷化试剂添加量为0.3%,固定温度为30 ℃,固定时间为6 h。在此条件下,检验硅藻土与酶质量比对固定脂肪酶活力的影响。
1.3.6 固定温度对固定脂肪酶活力的影响
温度分别设置为22、24、26、28、30、32 ℃,硅藻土与酶的质量比为4∶1,硅烷化试剂添加量为0.3%,固定时间为6 h。在此条件下,检验固定温度对固定化脂肪酶活力的影响。
1.3.7 固定时间对固定脂肪酶活力的影响
固定时间分别设置为3、4、5、6、7 、8 h,硅烷化试剂添加量为0.3%,硅藻土与酶的质量比为4∶1,固定温度为30 ℃。在此条件下,检验固定时间对固定脂肪酶活力的影响。
1.3.8 响应面法优化固定酶的最佳条件
通过单因素试验确定各因素的范围,以固定脂肪酶酶活性为响应值进行四元二次回归正交旋转组合设计,并采用Design-Expert.V8.0.6 软件对试验数据进行分析,得到最佳的固定化条件。
2 结果与分析
2.1 单因素试验结果
2.1.1 硅烷化试剂添加量对固定脂肪酶活力的影响
由图1 可知固定脂肪酶活力随着硅烷化试剂添加量先升高后降低,在硅烷化试剂添加量为0.4%达到最大值,硅烷化试剂添加量过高导致固定脂肪酶活力降低是因为偶联剂过多使游离的化学键过多,起不到固定作用。

图1 硅烷化试剂添加量对固定脂肪酶活力的影响Fig.1 Impacts of additive amount of silicon alkylation reagents to the immobilized lipase activity
2.1.2 硅藻土与酶质量比对固定脂肪酶活力的影响
由图2 可知硅藻土与酶的质量比越大,固定脂肪酶活力也就越低,应为固定的脂肪酶与大量的硅烷化处理后的硅藻土结合,酶的活力就相对降低了。
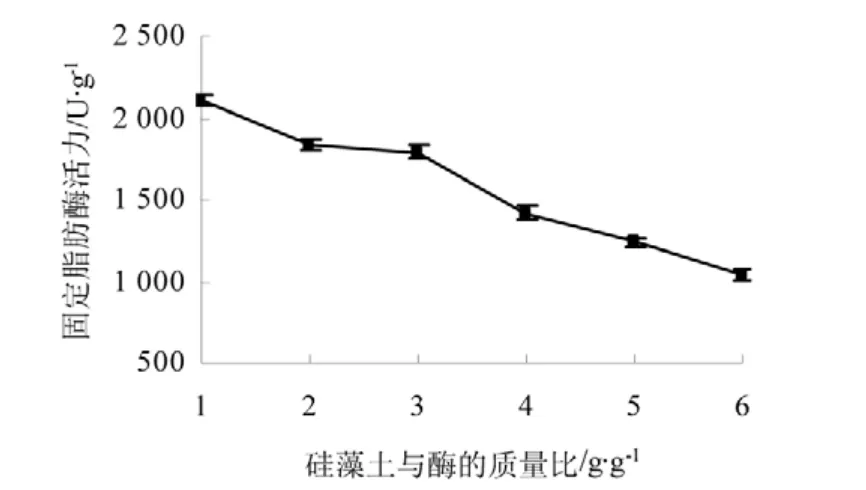
图2 硅藻土与酶质量比对固定脂肪酶活力的影响Fig.2 Impacts of the quality proportion between diatomaceous earth and enzyme to the immobilized lipase activity
2.1.3 固定温度对固定脂肪酶活力的影响
由图3 可知随着温度的升高固定脂肪酶的活力开始升高,当温度达到30 ℃后固定脂肪酶活力就不再上升了,由于高温导致酶失活,酶的最适作用温度为37 ℃,所以固定脂肪酶时的温度不宜太高。

图3 固定温度对固定脂肪酶活力的影响Fig.3 Impacts of the immobilized temperature to the immobilized lipase activity
2.1.4 固定时间对固定脂肪酶活力的影响
由图4 可知随着处理时间的增加,固定脂肪酶活力也随着增加,当时间达到4 h 时基本不再变化,说明4~6 h 的时间处理使酶与硅藻土紧密结合即将脂肪酶固定在硅藻土上。
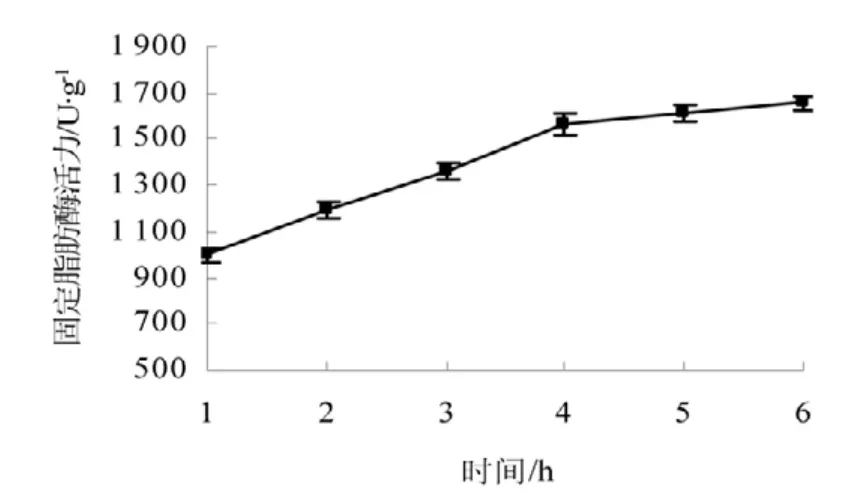
图4 固定时间对固定脂肪酶活力的影响Fig.4 Impacts of the immobilized time to the immobilized lipase activity
2.2 四元二次回归正交旋转组合试验结果
2.2.1 回归方程的建立及显著性
根据单因素试验确定各因素的范围并进行编码,因素水平编码见表1,试验设计与结果见表2。
采用Design-Expert.8.0.6 对试验数据进行回归分析,得到固定脂肪酶的活性(y)与硅烷化试剂添加量(x1)、硅藻土与酶质量比值(x2)、温度(x3)和时间(x4)编码值的二次回归方程如下:
y=2 155.39-107.78x1-104.42x2+99.37x3+5.48x4+91.38x1x2-25.79x1x3+40.56x1x4+64.79x2x3+144.95x2x4-172.22x3x4-163.35x12-194.81x22-155.39x32-196.06x42

表1 因素水平编码表Table 1 Factors and levels of central composite design
同时模型的决定系数R2=0.860 8,校正R2=0.768 0,说明该模型能解释76.80%响应值的变化,与实际试验拟合良好,试验误差小,证明应用四元二次回归正交旋转组合试验优化硅烷化试剂添加量、硅藻土与酶的质量比、固定温度和固定时间对脂肪酶活性的影响是可行的[10]。

表2 四元二次回归正交旋转组合试验结果表Table 2 Results of orthogonal rotating combination test
从表3 中可以得出模型的F 值为9.28,对应的P值<0.000 1,远小于0.01,说明模型极显著,从表3 还可以得出因素一次项(X1、X2和X3)、交互项(X3X4)和二次项(X12、X22、X32和X42)对试验的结果影响是极显著的;交互项(X2X4)也达到了显著水平。失拟项的P值为0.542 8,远大于0.05,这说明该模型拟合程度较好,试验误差小,所建立的模型是可行的,可以用此模型对固定化酶的工艺条件进行优化。
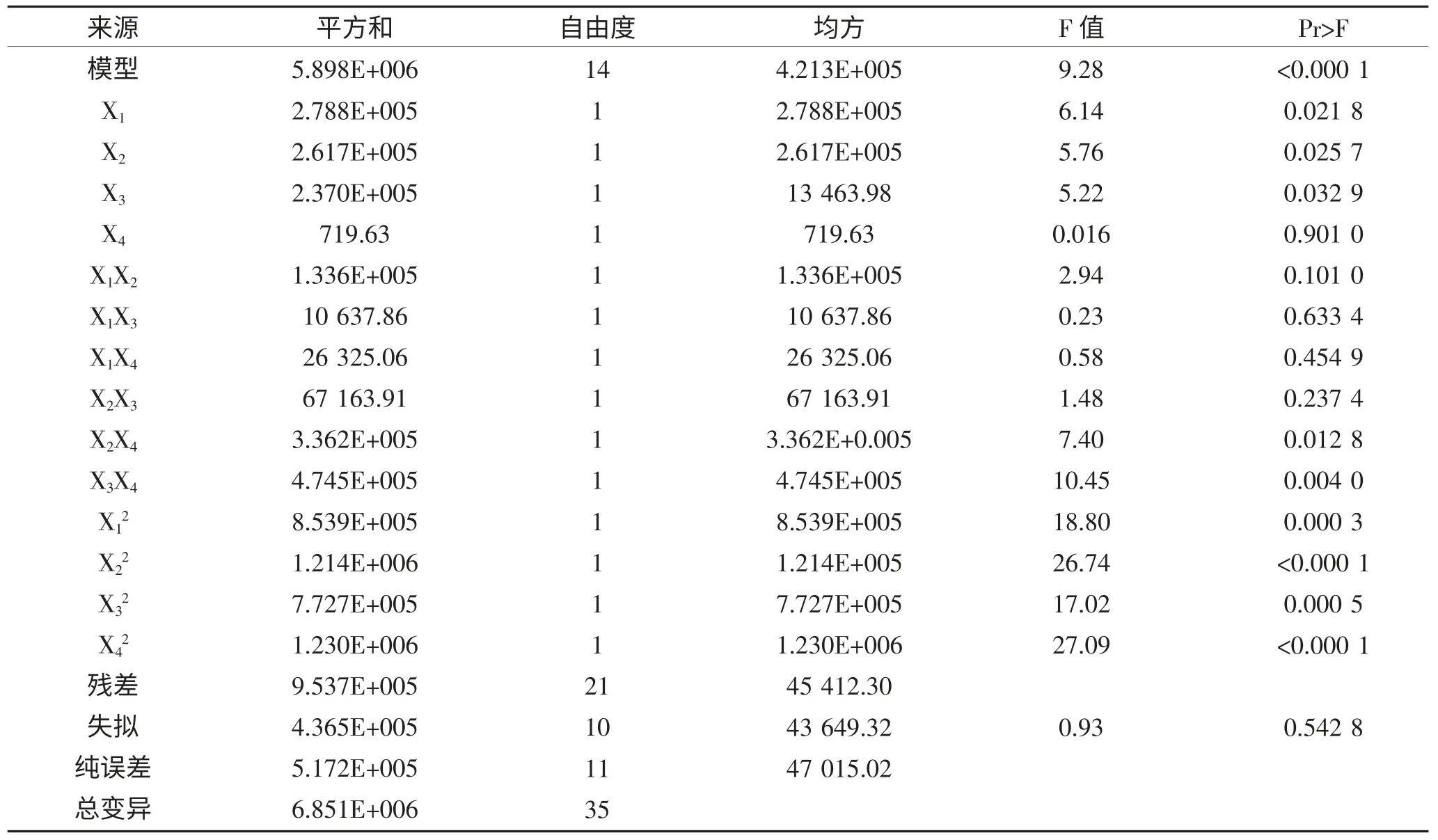
表3 方差分析表Table 3 Analysis of variance
2.2.2 响应面分析
从表3 可以得到X2X4(P=0.012 8<0.05)交互作用显著和X3X4(P=0.004 0<0.01)交互作用极显著,采用降维分析法找出在其他因素条件固定不变情况下,某两个因素对固定脂肪酶活性的影响,即硅藻土与酶的质量比和时间交互作用及温度和时间的交互作用对固定脂肪酶活性的影响。图5 和图6 是Design-Expert 8.0.6 软件作出的等高线图及响应曲面图,对这些因素中交互项之间的交互效应进行分析。
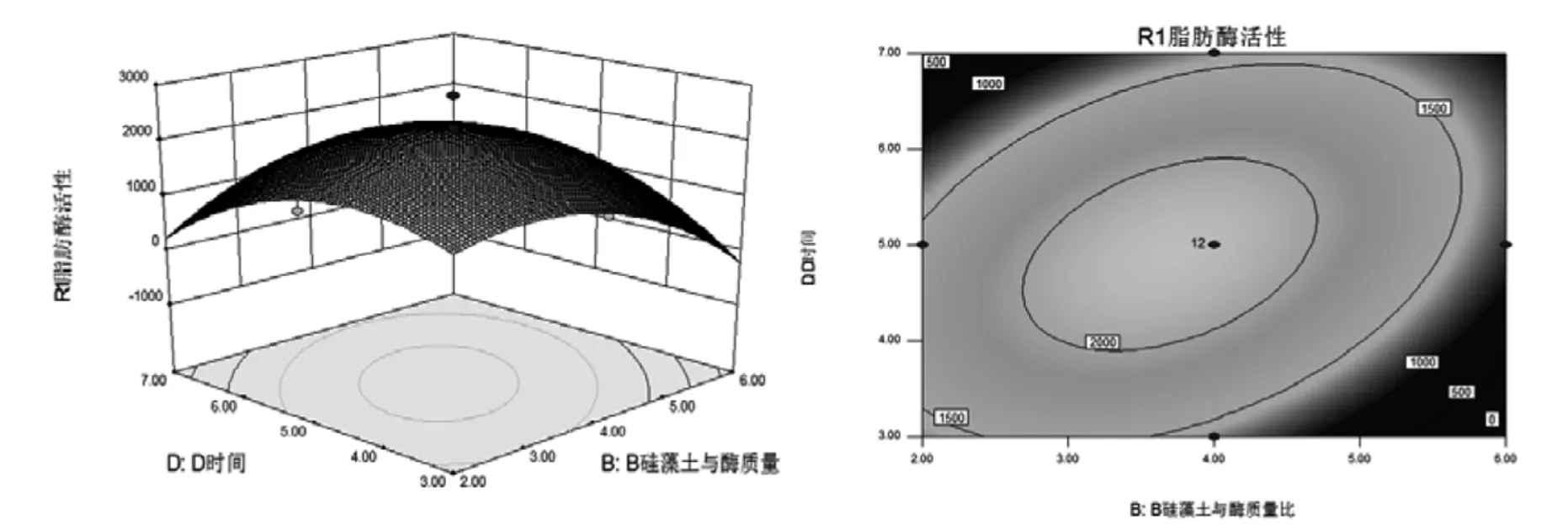
图5 硅藻土与酶的质量比和时间对固定化脂肪酶活力影响的响应面图和等高线图Fig.5 Figure of response surface and contour about quality proportion between diatomaceous earth,enzyme and time to the immobilized lipase activity

图6 温度和时间对固定化脂肪酶活力影响的响应面图和等高线图Fig.6 Figure of response surface and contour about the temperature and time to the immobilized lipase activity
由图5 可以看出当硅烷化试剂添加量为0.4%,温度为固定28 ℃时,硅藻土与酶的质量比值在2.0~4.0,时间在3.0~5.0 h 范围内显著增效作用,固定脂肪酶活力随着两因素水平的增加而升高。硅藻土与酶的质量比值在4.0~6.0,时间在5.0~7.0 h 范围内时,固定脂肪酶的活力随着两个因素的增加反而开始降低。由图6 可知,硅烷化试剂添加量为0.40%,硅藻土与酶的质量比值为4 时,温度在28~32 ℃,时间在5~7 h 范围内存在显著增效作用,固定脂肪酶活力随着两因素水平的升高而增加。温度在24~28 ℃,时间在3.0~5.0 h 范围内固定脂肪酶活力随着两因素水平的升高反而降低。
为了得到最佳的固定化条件值,分析该模型,经过分析可知最佳的固定脂肪酶条件为硅烷化试剂添加量为0.35%、硅藻土与酶的质量比为3.5∶1、温度为29 ℃、时间为4.5 h。
2.2.3 验证性试验
按上述优化的试验条件进行验证性试验,同时也考虑到实际情况,采用硅烷化试剂添加量为0.35%、硅藻土与酶的质量比3.5∶1、温度为29 ℃、时间为4.5 h,此时固定后的脂肪酶活力为2 206.67 U·g-1,与预测的固定脂肪酶活力相对误差为1.27%,因此响应分析的模型是可靠的。
3 固定化脂肪酶的重复利用
固定前脂肪酶的活力为3 000 U·g-1而在最佳的固定化条件下,测得的固定后脂肪酶活力为2 206.67 U·g-1。虽然酶法在工业中的应用具有反应条件温和、操作简便、易于分离、节约能源、降低消耗等诸多优点。但酶的价格因素限制其在工业中的应用。因为,固定化后的脂肪酶的使用寿命也被大家广泛的关注。试验在正交试验优化出的最佳的试验条件下,重复使用固定化的脂肪酶,观察脂肪酶的使用次数,见图7。

图7 使用次数对固定化脂肪酶活力与DAG 产率的影响Fig.7 Impact of employ frequency to the immobilized lipase activity and DAG rate
由图7 可知,固定化后的脂肪酶具有良好的操作稳定性,连续使用7 次后,甘二酯的产率依然可以达到50%以上,固定化脂肪酶活力仍可达到1 900 U·g-1以上。这说明多次重复使用后,固定后的脂肪酶仍能保持较好的活性,整个反应体系在上述优化条件下有较好的操作稳定性,而且本反应体系反应条件温和,保持了脂肪酶的良好的催化活性。工艺本身可以在一定程度上节约脂肪酶的使用成本,有着良好的工业前景和市场前景。
在固化后的脂肪酶回收方面,试验采用将反应后的混合物于4 000 r·min-1离心20 min,用正己烷溶解下层固定脂肪酶残留反应物,抽滤分离固定脂肪酶,得到的固定脂肪酶用正己烷反复洗涤3 次,晾干后用于下一次试验。
4 结论
通过采用四元二次回归正交旋转组合试验设计, 进行响应面分析结合验证性实验确定固定脂肪酶最佳固定化条件为硅烷化试剂添加量为0.35%、硅藻土与酶的质量比3.5∶1、温度为29 ℃、时间为4.5 h,此时固定后的脂肪酶活力为2 206.67 U·g-1。在最佳的固定化条件下,硅烷化试剂添加量、硅藻土与酶的质量比和温度对固定脂肪酶活力影响显著,因素的主次顺序依次为硅烷化试剂添加量、硅藻土与酶的质量比、处理温度、处理时间,该模型显著,能说明固定的条件对固定脂肪酶活力的关系。
[1]殷傅.米糠油的营养保健功能及其生产工艺探讨[J].江西食品工业,2000(3):17-20.
[2]黄莉莉.甘油二酯的功能及安全性研究现状[J].国外医学卫生分册,2007,34(2):94-98.
[3]孙德明.米糠综合利用的开发研究[J].农林科技,2008(12):200-20.
[4]韩秀丽,张如意.马晓健,等.米糠的综合利用及其前景[J].农产品加工学刊,2007,7(7):62-64.
[5]于济洋,李新华,赵前程,等.甘二酯制备的研究进展[J].中国油脂,2007,32(11):12-15.
[6]Nandi S,Gangopadhyay S,Ghosh S.Production of medium chain glycerides from coconut and palm kernel fatty acid distillates by lipase-catalyzed reactions [J].Enzyme and Microbial Technology,2005,36(5-6):725-728.
[7]孟祥河,邹冬芽,段作营,等.无溶剂体系合成1,3-甘油二酷用脂肪酶的筛选及其酷化性质[J].无锡轻工业大学学报,2004,23(2):31-35.
[8]王诗路,赵国明,刘辉,等.固定化脂肪酶催化合成癸二酸二(2-乙基己基)酯[J].化学反应工程与工艺,2012,28(4):330-334.
[9]李磊.高酸价米糠油酶法催化制备富含甘油二酯米糠油的研究[D].无锡:江南大学,2012.
[10]马萍,郭希娟,李思荻.响应面法优化红小豆中总酚的提取[J].黑龙江八一农垦大学学报,2011,23(5):64-68.
