2013年秋末黄渤海海水中胞外酶活性水平和垂直变化
2015-08-03赵丽军田继远杨桂朋贾鸿冰中国海洋大学海洋化学理论与工程技术教育部重点实验室山东青岛6600青岛农业大学食品科学与工程学院山东青岛6609
赵丽军,田继远,于 娟*,杨桂朋,贾鸿冰 (.中国海洋大学,海洋化学理论与工程技术教育部重点实验室,山东 青岛 6600;.青岛农业大学食品科学与工程学院,山东 青岛 6609)
海水中含有多种高分子聚合物,如蛋白质、核酸、多糖(纤维素、几丁质、淀粉等),这些高分子聚合物对维持海洋生态平衡具有重要的作用,但它们不能被细菌直接吸收利用作为维持生命的营养物质,需要被胞外酶分解成小分子物质后才能被吸收利用.胞外酶是指在细胞内合成后穿过细胞膜并在细胞外发挥作用、使多糖、蛋白质、核酸等天然高聚物裂解变为可穿过细胞质膜而被吸收利用的小分子物质的一类酶[1].
早在20世纪30年代,Kreps[2]已经意识到海水中胞外酶的存在,随后Vallentyne[3]指出海水中胞外酶在物质的化学形态变化过程中的重要作用.近年来对水体和沉积物的胞外酶研究最多的是水解酶[4].这些水解酶包括碱性磷酸酶、脂肪酶、肽酶、纤维素酶、几丁质酶、葡萄糖苷酶、淀粉酶等.胞外酶水解有机高聚物是一个生物与化学相互作用的复杂过程,必然受到各种环境及生物因素的强烈影响[5].这些因素包括温度、pH值[6-7]、营养盐[8-9]、腐殖质[10-11]、氧气条件[12]、UV-B辐射[13]等.其中,底物以及最终产物对酶造成的激发与抑制被视为重要的调节者.另外,同一种因素对不同的胞外酶活性的影响也不尽相同.目前国际上已有很多关于水生生态系统中胞外酶活性的研究报道[14-21],研究表明,胞外酶活性与季节[16]、水体环境[17-18]、水深[19-21]、赤潮发生阶段[4]等因素有关.而国内对近海海水中胞外酶活性的研究仅限于台湾海峡[22]、胶州湾[23]和厦门海域[24]等有限海域.本研究扩大了中国近海胞外酶活性的研究领域,研究了黄渤海海水中 9种胞外酶的酶活性分布及其影响因素,可以为评估胞外酶对有机质降解的贡献提供帮助.
目前测定胞外酶活性通常采用的方法是荧光模拟底物法(FMS)[25-26].简而言之,就是向待测定样品中加入适量底物,酶和底物在合适的条件下发生反应,生成可以直接被测定的物质,通过检测此物质来观测酶的活性.4-甲基伞形酮(MUF)及7-氨基-4甲基香豆素(AMC)是目前广泛应用的底物.
针对目前国内胞外酶活性的研究不足,本研究运用荧光模拟底物法对黄渤海海域秋末海水中9种胞外酶(碱性磷酸酶(Alkaline Phosphatase,AP)、肽酶(Leucine aminopeptidase,AMP)、脂肪酶(Lipase,LIP)、纤维素酶(Cellulase,CEL)、几丁质酶(Chitinase,CHI)、β-D-葡萄糖苷酶(β-DGlucosidase,BGLU)、α-D-葡萄糖苷酶(α-DGlucosidase,AGLU)、β-D- 半乳糖苷酶 (β-DGalactosidase,BGAL)和木糖苷酶(Xylosidase,XYL))活性的水平和垂直分布进行了研究,并探讨了胞外酶活性与环境因子的相互关系,对于全面理解生态系统中物质循环、能量分配以及评估水体环境质量、生态效率等具有重要意义,并有助于了解异养细菌对海洋环境中碳的生物地球化学循环过程以及有机碳对细菌生长繁殖的营养贡献.
1 材料与方法
1.1 采样

图1 黄渤海海域海水样品采样站位Fig.1 Sampling stations of seawater samples in the Yellow Sea and the Bohai Sea
2013年11月6~23日,随“东方红2号”调查船对黄渤海(30°~40°N,118°~126°E)的 42 个大面站位的表层海水以及其中A7(32.80°N,125.67°E)和E7(34°N,124°E)2个站位的海水进行了垂直采样并测定.现场用CTD采水器采集各站位的各层海水,经 0.22μm的微孔滤膜过滤、-20℃冷冻保存,带回陆地实验室后在一个月内完成测定.采样站位见图 1.辽东半岛的老铁山与山东半岛北岸的蓬莱角为渤海与黄海的分界线.黄海又被分为南黄海和北黄海两部分,北黄海是指渤海以东、山东半岛成山角与朝鲜长山连线以北的半封闭海域[27],长江口至济州岛连线以北的椭圆形半封闭海域为南黄海.此调查中将 L3站位作为渤海与黄海的分界,将H断面视为南北黄海的分界.
1.2 胞外酶活性的测定
1.2.1 标准曲线的绘制 配制一系列低浓度(0.0005,0.001,0.0025,0.005,0.0075,0.01,0.025,0.05μ mol/L)以及高浓度(0.1,0.25,0.5,0.75,1.0μmol/L)的MUF和AMC标准溶液,根据溶液浓度以及相对应的荧光强度分别绘制低浓度和高浓度标准曲线.
1.2.2 胞外酶活性的测定 向待测海水样品中加入相应的酶底物(底物最终浓度为2μmol/L),让底物在模拟的现场海水温度以及黑暗条件下与酶进行反应,分别在0h和2h用荧光分光光度计(日立 F-4500)测定样品的荧光强度,MUF的激发和发射波长分别是 365nm和455nm,AMC的激发和发射波长分别是 380nm和440nm.AP、CHI、LIP、AMP、CEL、BGLU、AGLU、BGAL和XYL所对应的底物分别为4-甲基伞形酮酰磷酸酯、4-甲基伞形酮-N-乙酰基-β-D-氨基葡萄糖苷、4-甲基伞形酮油酸酯、L-亮氨酰-7-氨基-4-甲基香豆素盐酸盐、4-甲基伞形酮-β-D-纤维素二糖苷、4-甲基伞形酮-β-D-葡萄糖苷、4-甲基伞形酮-α-D-吡喃葡萄糖苷、4-甲基伞形酮-β-D-吡喃半乳糖苷和 4-甲基伞形酮-β-D-木糖苷.底物在相应酶的水解作用下,释放出小分子物质和荧光显色团(MUF或AMC),测定荧光显色团荧光强度的变化并通过标准曲线计算胞外酶对底物的水解速率.用MUF或AMC的释放速率即酶对底物的水解速率来表示胞外酶活性,单位为nmol/(L·h).实验所用试剂均购自Sigma公司.
测定荧光强度时,向比色皿中加入3mL样品后,再加入 200μL CAPS(3-环己胺-1-丙磺酸)缓冲溶液(pH 10.3),缓冲溶液具有终止反应并增加荧光密度的作用.
1.3 温度、盐度以及Chl a含量的测定
现场海水的温度、盐度和深度由直读式温盐深仪CTD(Seabird911-plus)在采集海水样品时同步获得.海水样品经 Whatman GF/F玻璃纤维滤膜过滤后,将滤膜放置于-20℃冷冻条件下保存,带回陆地实验室测定Chl a含量.Chl a样品用90%的丙酮提取至少 24h,然后用荧光分光光度计(日立F-4500)进行测定[28].
1.4 数据分析
每个样品的酶活性测定3次,取其平均值±标准偏差.用Origin8.0、Surfer8.0和SPSS19.0处理数据.
2 结果
2.1 9种胞外酶活性的水平分布
秋末黄渤海表层海水的 9种胞外酶活性水平分布见图2.
2013年秋末黄渤海表层海水中9种胞外酶活性的分布不尽相同.碱性磷酸酶、几丁质酶、脂肪酶、肽酶、纤维素酶、β-D-葡萄糖苷酶、α-D-葡萄糖苷酶、β-D-半乳糖苷酶和木糖苷酶的活性在整个黄渤海的平均值分别为 77.31,1.29,23.59,1.09,1.47,3.87,1.58,0.74,2.63nmol/(L·h).整个调查海域胞外酶活性的平均值排列顺序为碱性磷酸酶>脂肪酶>β-D-葡萄糖苷酶>木糖苷酶>α-D-葡萄糖苷酶≈纤维素酶≈几丁质酶>肽酶>β-D-半乳糖苷酶.
碱性磷酸酶活性的变化范围为 2.11~781.31nmol/(L·h).高值区分布在南黄海西部离岸较近的海域,最大值出现在 E3站位(33°59′N,121°59′E),并以 E3站位为中心以扩散方式降低[图 2(a)].几丁质酶活性的变化范围为 0~4.51nmol/(L·h),其中H1、I5和D93个站位的几丁质酶活性为 0.高值区中心位于南黄海中部,低值区分布在南黄海沿岸、渤海海峡中部以及北黄海东部海域,A断面几丁质酶活性较低[图 2(b)].平均脂肪酶活性在 9种胞外酶中仅次于碱性磷酸酶,变化范围为 1.05~215.57nmol/(L·h).高值区主要分布在南黄海西部的海州湾以南沿岸及附近海域[图 2(c)].肽酶活性变化范围为 0.12~4.79nmol/(L·h),其高值区主要分布在南黄海中部和南部海域[图 2(d)].山东半岛以南和长江口以东海域是纤维素酶活性的高值区[图 2(e)].在整个调查海区,纤维素酶活性变化范围为 0.06~9.29nmol/(L·h).α-D-葡萄糖苷酶活性的高值区分布在渤海海域[图 2(f)].β-D-葡萄糖苷酶活性的变化范围为 0.28~21.62nmol/(L·h),并且在海州湾以南的近岸海域以及长江口以东的中部海域活性较高[图 2(g)].β-D-半乳糖苷酶活性的变化范围为 0.05~3.75nmol/(L·h),在山东青岛以南的近岸海域和南黄海北部的中部海域活性较高,而在渤海、北黄海以及南黄海沿岸海域活性比较低[图 2(h)].木糖苷酶活性变化范围为 0.06~17.85nmol/(L·h),高值区分布在长江口与济州岛之间的中部海域,以 D7站位为高值中心向四周以扩散方式降低[图2(i)].
根据上文对海区的划分,对各海区胞外酶活性的平均值进行了比较(表1).碱性磷酸酶、几丁质酶、纤维素酶、β-D-葡萄糖苷酶和木糖苷酶5种胞外酶的活性排列顺序均为南黄海>北黄海>渤海.其中几丁质酶活性在不同调查海区的平均值比较接近(表 1).而 α-D-葡萄糖苷酶在不同海区的活性排列顺序与前面 5种胞外酶活性相反,为渤海>北黄海>南黄海.其他3种酶(脂肪酶、肽酶和 β-D-半乳糖苷酶)的活性在不同的海区的排列顺序为南黄海>渤海>北黄海.除 α-D-葡萄糖苷酶外,其他 8种胞外酶在黄海的活性均高于渤海.


图2 2013年秋末黄渤海表层海水9种胞外酶活性的水平变化[nmol/(L·h)]Fig.2 Horizontal variations of activities of nine extracellular enzyme in the surface water of the Yellow Sea and the Bohai Sea in late autumn, 2013 [nmol/(L·h)]
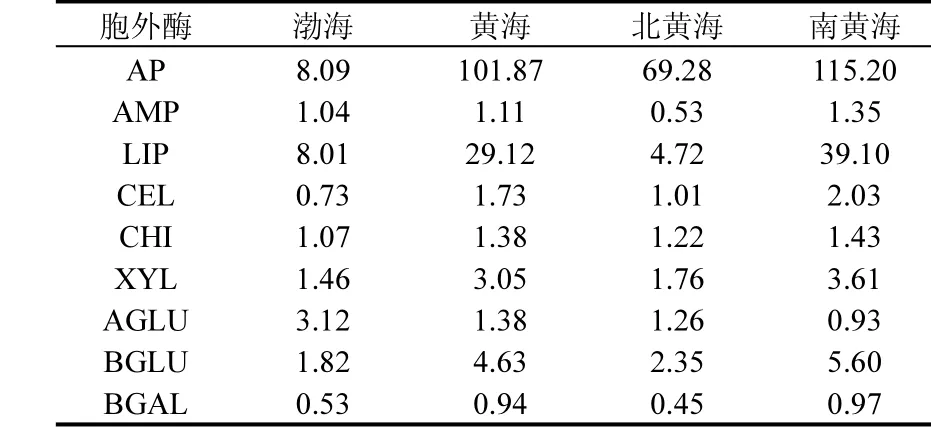
表1 2013年秋末不同调查海区9种胞外酶的平均活性[nmol/(L·h)]Table 1 Average activities of the nine extracellular enzyme activities in the different survey area in late autumn of 2013 [nmol/(L·h)]
2.2 表层海水中胞外酶活性与温度、盐度及Chl a含量的相关性
黄渤海秋末表层海水温度呈现南高北低的特点,最高温度(21.36℃)和最低温度(9.63℃)分别出现在A3和J4站位[图3(a)].盐度分布呈现南高北低、近岸低远海高的特点[图3(b)],最高盐度(33.42)和最低盐度(27.19)分别出现在 A3和 P4站位.Chl a含量高值区主要分布在受陆源输入和生物活动影响较严重的莱州湾以及山东半岛与辽东半岛之间的海域[图3(c)],Chl a含量最大值(3.01μg/L)和最小值(0.11μg/L)分别出现在 K7 和K3站位.
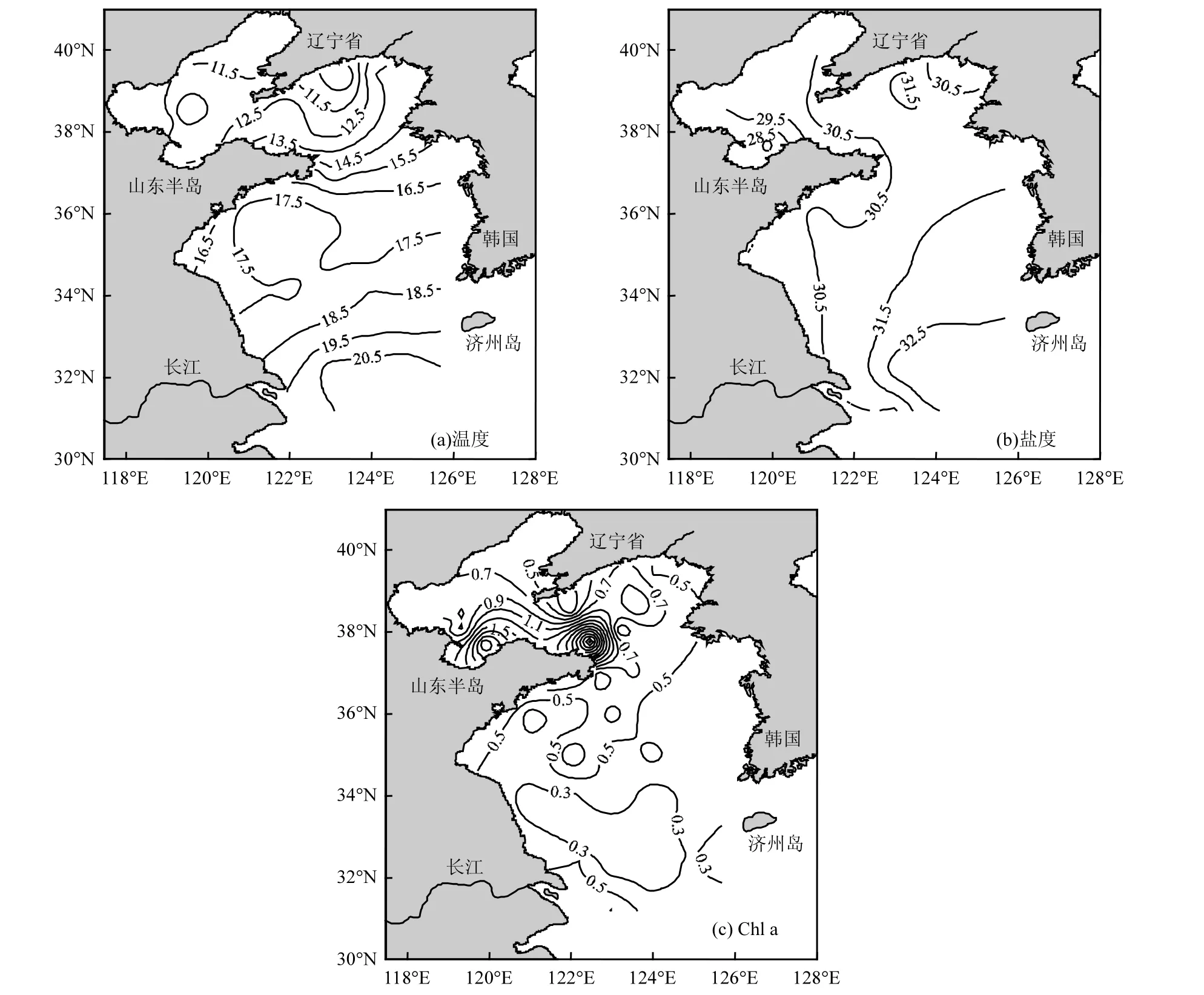
图3 2013年秋末黄渤海温度(℃)、盐度、叶绿素a含量(μg/L)的变化Fig.3 Variations of temperature(℃), salinity and contents of Chl a (μg/L) in the Yellow Sea and the Bohai Sea in autumn, 2013

表2 9种胞外酶活性与温度、盐度、叶绿素a含量的相关性分析Table 2 Correlation analysis between activities of nine extracellular enzyme and temperatures, salinities or contents of Chl a
将42个站位表层海水的9种胞外酶活性分别与温度、盐度以及 Chl a含量运用SPSS19.0作Pearson相关性分析.黄渤海秋末β-D-葡萄糖苷酶活性分别与温度、盐度呈现弱的正相关(P<0.05),纤维素酶活性与温度呈现弱的正相关(P<0.05).而其他7种胞外酶活性与温度、盐度及Chl a含量均无显著相关性(P>0.05)(表2).
2.3 9种胞外酶活性的垂直分布
A7站位的温度和Chl a含量的变化趋势基本一致[图4(a)].30m的海水温度和Chl a含量明显高于其他深度.盐度由表层到底层呈现逐渐升高的趋势,由10m到30m盐度变化幅度最大.A7站位不同深度9种酶的平均酶活性排列顺序为:碱性磷酸酶>脂肪酶>木糖苷酶>β-D-葡萄糖苷酶>肽酶>几丁质酶>α-D-葡萄糖苷酶>纤维素酶>β-D-半乳糖苷酶.碱性磷酸酶、几丁质酶、β-D-葡萄糖苷酶、β-D-半乳糖苷酶和肽酶活性的垂直分布趋势大致相同,在10m处的酶活性均明显高于其他水深,最低值均出现在温度最低的 50m处.木糖苷酶活性最高值[5.92nmol/(L·h)]和最低值[0.19nmol/(L·h)]分别出现在75m处和底层.A7站位垂直分布中纤维素酶活性较低,且分布较均匀,最大值[1.41nmol/(L·h)]出现在 30m 处,其他深度纤维素酶活性差距不大.脂肪酶活性最大值[18.12nmol/(L·h)]和最小值[2.90nmol/(L·h)]分别出现在50m和75m[图4(c)].
E7站位的温度和Chl a含量的变化趋势基本一致[图4(b)].表层、10m、30m的温度和Chl a含量均比50m和底层的高.盐度变化趋势与温度和Chl a变化趋势相反,即在50m和底层的盐度均明显高于表层、10m和30m的盐度.E7站位不同深度 9种酶的平均酶活性排列顺序为:碱性磷酸酶>脂肪酶>纤维素酶>肽酶>β-D-葡萄糖苷酶≈木糖苷酶>几丁质酶>α-D-葡萄糖苷酶>β-D-半乳糖苷酶.表层水的 β-D-葡萄糖苷酶、α-D-葡萄糖苷酶、β-D-半乳糖苷酶和几丁质酶的活性均高于其它水层,而底层的碱性磷酸酶、β-D-葡萄糖苷酶、木糖苷酶和几丁质酶的活性最低.碱性磷酸酶和脂肪酶活性的垂直变化趋势基本一致,最大值均在Chl a含量最高的10m处出现.木糖苷酶、纤维素酶和肽酶活性的垂直变化趋势基本一致,30m处的活性均明显高于其他水层[图4(d)].
综上所述,9种胞外酶活性的垂直分布随着深度的增加呈现出不同的变化趋势,即胞外酶活性与站位、水深、酶的类型及环境因子等因素有关.
3 讨论
3.1 胞外酶活性的水平分布
Mudryk等[29]认为不同海域胞外酶活性的不同是由不同的有机物浓度导致的.Davey等[30]的研究结果中溶解胞外酶的活性与环境参数没有呈现显著相关性,这与我们的研究结果相似.这可能是因为海洋环境中溶解胞外酶活性只占总胞外酶活性的一小部分[21,25,31].
碱性磷酸酶与水体中的磷循环和碳循环密切相关[20],浮游植物和细菌可以释放大量的碱性磷酸酶到水体中,为异养微生物和藻类提供赖以生存的磷元素[32].本研究结果显示游离碱性磷酸酶的活性在9种胞外酶活性中最高,是其它8种游离胞外酶活性的3.3~103.8倍,这可能是由于碱性磷酸酶与其他胞外酶在秋末黄渤海海水中的存在形式不同所导致的.Hoppe[33]和 Chróst[6]的研究表明,碱性磷酸酶大部分是以溶解态的形式存在于海水中.Li等[34]进一步证实了游离碱性磷酸酶占总碱性磷酸酶活性的 42%~74%,相比之下,水体中其他游离胞外酶的活性相对较低.Chróst[35]的研究结果表明,水体中游离的 β-D-葡萄糖苷酶很少,其活性仅占总活性的 3.4%,并认为部分β-D-葡萄糖苷酶可能来源于过滤时细胞的损坏.绝大部分的 β-D-葡萄糖苷酶依附在细菌菌体上,使底物水解后的产物能够被细菌及时吸收利用.Rulík等[18]对摩拉瓦河的一条支流中3种游离胞外酶的研究得到相似的结论,即溶解态α-D-葡萄糖苷酶、β-D-葡萄糖苷酶和木糖苷酶的活性在总酶活性中所占百分比较低(14%~24%).
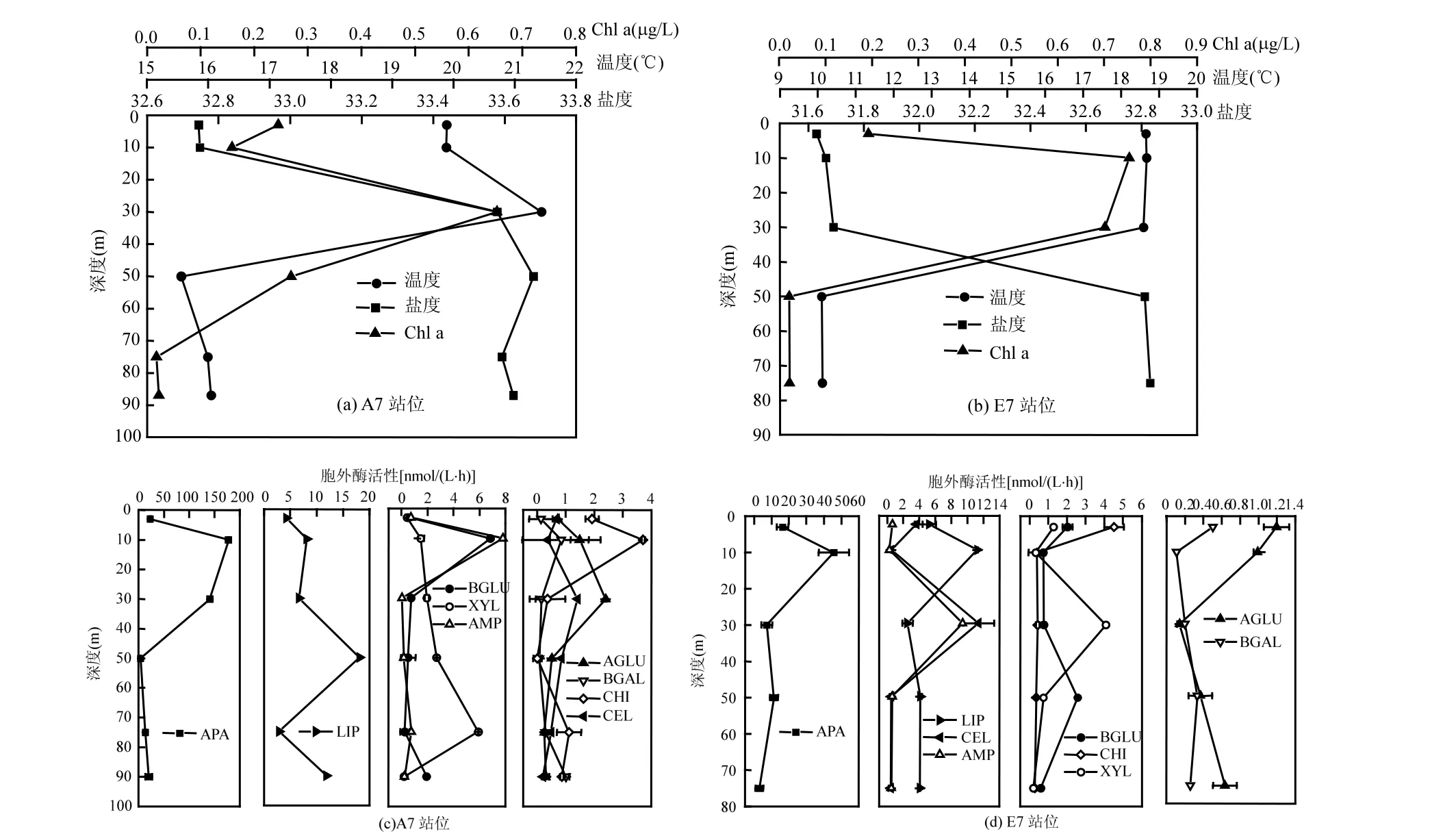
图4 A7和E7站位温度、盐度、叶绿素a含量及胞外酶活性的垂直变化Fig.4 Vertical variation of temperature, salinity, contents of Chl a and activities of extracellular enzyme at Station A7and E7
秋末黄渤海表层海水中游离脂肪酶的活性在 9种酶活性中仅次于碱性磷酸酶.脂肪酶可以由活的微生物产生,也可以以游离酶的形式由细菌细胞的溶菌作用产生[36].脂肪酶是一种较小的蛋白质,能够将脂肪裂解为甘油和脂肪酸[37].在水生生态系统中,脂肪占所有有机物的3~55%[38].活的以及死亡的浮游植物、浮游动物和大型植物都是脂肪的主要来源[39-40],特别是在浮游植物藻华的衰亡期之后,脂肪的浓度较高.秋季黄渤海海水中脂肪酶活性的高值区主要分布在南黄海的沿岸海域,这可能是因为人类生产生活以及陆源输入带来了大量的脂肪.
多肽是水体中重要的有机物,它可以被胞外肽酶水解成氨基酸[41],其中亮氨酸氨基肽酶可以将多肽分解为亮氨酸和其他疏水性的氨基酸[16].有研究表明水体中的肽酶活性很大程度上依赖于多肽的浓度[42-43].Brown等[44]及 Patel等[45]指出在高度富营养化的水体中,肽酶的活性也较高.在 Caruso[46]的研究中,肽酶的高值是受河流的有机物输入的影响的结果,因此本研究结果中肽酶活性的高值区可能与长江有机物输入有关.
与碱性磷酸酶和脂肪酶相比,在分解多糖过程中起催化作用的α-D-葡萄糖苷酶、β-D-葡萄糖苷酶、β-D-半乳糖苷酶、几丁质酶、纤维素酶以及木糖苷酶在秋末黄渤海表层海水中的活性均较低,这与 Azam[47]和 Köster等[48]及 Brown等[44]的研究的结果相似.本研究调查结果中的β-D-葡萄糖苷酶活性的平均值[3.87nmol/(L·h)]比郑天凌等[22]对台湾海峡夏季[1.94nmol/(L·h)]与冬季[0.86nmol/(L·h)]调查的 β-D-葡萄糖苷酶活性的平均值都要高.造成这种差异的原因可能与调查的季节和海域不同有关.Rulík等[18]研究结果表明α-D-葡萄糖苷酶、β-D-葡萄糖苷酶和木糖苷酶的酶活性的排列顺序为β-D-葡萄糖苷酶>α-D-葡萄糖苷酶>木糖苷酶,这与本实验研究结果相近.
3.2 胞外酶活性的垂直分布
Lipizer等[49]的研究结果表明水温以及淡水输入和循环状况随水深不同而不同,导致无机营养元素、颗粒态和溶解态有机物的浓度在不同深度存在差异.这就意味着不同水深处有不同的微环境,从而可能会影响微生物的新陈代谢,进而影响它们对有机物的降解过程.事实上,本研究结果显示,9种胞外酶的活性在不同深度的分布存在明显的差异.这可能是因为大部分的有机物降解受与深度有关的参数的影响,这些参数包括温度、光照(与有机物的光降解有关)和初级生产力,它们分别影响有机物的稳定性、营养动力学和氧气浓度,最终影响微生物群落结构.本研究中的大部分胞外酶在 30m以浅的海水中的活性高于30m以深的活性,可能是因为30m以浅的海水中含有高浓度的有机物[50-51]能够激发胞外酶对有机化合物的水解作用.
海气相互作用是通过大气和海洋混合层间热量、动量和质量的直接交换而完成的,即海洋对气候变化的影响主要是通过海洋上混合层来实现,因此,海洋上混合层对海气相互作用具有非常重要的作用[52].海水混合作用使混合层以下的水文要素(特别是温度和盐度)的梯度增大,形成温跃层和盐跃层.温跃层和盐跃层随着大气强迫作用的变化而具有明显的季节变化[53].由图4(a)、4(b)可知,胞外酶活性在A7和E7站位垂直混合层中均表现出较高的活性.混合层 Chl a含量较高,说明有机质含量较高,进一步可以解释胞外酶活性在混合层的变化.
4 结论
4.1 2013年秋末黄渤海表层海水中9种胞外酶活性的排列顺序为碱性磷酸酶>脂肪酶>β-D-葡萄糖苷酶>木糖苷酶>α-D-葡萄糖苷酶≈纤维素酶≈几丁质酶>肽酶>β-D-半乳糖苷酶.
4.2 在不同的海区,碱性磷酸酶、几丁质酶、纤维素酶、β-D-葡萄糖苷酶和木糖苷酶 5种胞外酶的活性均为南黄海>北黄海>渤海.脂肪酶、肽酶和β-D-半乳糖苷酶的活性在不同的海区表现为南黄海>渤海>北黄海.除了 α-D-葡萄糖苷酶,其余 8种胞外酶的活性都呈现出黄海大于渤海,即南高北低的特点.
4.3 2013年秋末黄渤海表层海水中,β-D-葡萄糖苷酶和纤维素酶与温度呈弱的正相关(P<0.05),β-D-葡萄糖苷酶也与盐度呈现弱的正相关(P<0.05),而其他几种胞外酶与环境因子相关性均不显著(P>0.05).
4.4 A7站位不同深度9种酶的平均酶活性排列顺序为:碱性磷酸酶>脂肪酶>木糖苷酶>β-D-葡萄糖苷酶>肽酶>几丁质酶>α-D-葡萄糖苷酶>纤维素酶>β-D-半乳糖苷酶.E7站位不同深度9种酶的平均酶活性排列顺序为:碱性磷酸酶>脂肪酶>纤维素酶>肽酶>β-D葡萄糖苷酶≈木糖苷酶>几丁质酶>α-D 葡萄糖苷酶>β-D 半乳糖苷酶.而且大多数酶在表层、10m及30m的活性高于在50m、75m及底层的活性.
[1]Münster U, Einiö P, Nurminen J, et al.Extracellular enzymes in a polyhumic lake: important regulators in detritus processing [J].Hydrobiologia, 1992,229(1):225-238.
[2]Kreps E.Organic catalysts or enzymes in sea water [M].Liverpool: University of Liverpool Press, 1934:193-202.
[3]Vallentyne J R.The molecular nature of organic matter in lakes and oceans, with lesser reference to sewage and terrestrial soils[J].Journal of the Fisheries Board of Canada, 1957,14(1):33-82.
[4]Chróst R J, Münster U, Rai H, et al.Photosynthetic production and exoenzymatic degradation of organic matter in the euphotic zone of a eutrophic lake [J].Journal of Plankton Research,1989,11(2):223-242.
[5]Wang X, Chi Z, Yue L, et al.A marine killer yeast against the pathogenic yeast strain in crab (Portunus trituberculatus) and an optimization of the toxin production [J].Microbiological Research, 2007,162(1):77-85.
[6]Chróst R J.Microbial ectoenzymes in aquatic environments[M]//Aquatic Microbial Ecology, Springer New York, 1990:47-78.
[7]Christian J R, Karl D M.Bacterial ectoenzymes in marine waters:activity ratios and temperature responses in three oceanographic provinces [J].Limnology and Oceanography, 1995,40(6):1042-1049.
[8]Gambin F, Bogé G, Jamet D.Alkaline phosphatase in a littoral Mediterranean marine ecosystem: role of the main plankton size classes [J].Marine Environmental Research, 1999,47(5):441-456.
[9]Nausch M, Nausch G.Stimulation of peptidase activity in nutrient gradients in the Baltic Sea [J].Soil Biology and Biochemistry,2000,32(13):1973-1983.
[10]Carlsson P, Granéli E.Availability of humic bound nitrogen for coastal phytoplankton [J].Estuarine, Coastal and Shelf Science,1993,36(5):433-447.
[11]Boavida M J, Wetzel R G.Inhibition of phosphatase activity by dissolved humic substances and hydrolytic reactivation by natural ultraviolet light [J].Freshwater Biology, 1998,40(2):285-293.
[12]Newman S, Reddy K R.Alkaline phosphatase activity in the sediment-water column of a hypereutrophic lake [J].Journal of Environmental Quality, 1993,22(4):832-838.
[13]Garde K, Gustavson K.The impact of UV-B radiation on alkaline phosphatase activity in phosphorus-depleted marine ecosystems[J].Journal of Experimental Marine Biology and Ecology,1999,238(1):93-105.
[14]Hollibaugh J T, Azam F.Microbial degradation of dissolved proteins in seawater [J].Limnology and Oceanography, 1983,28:1104-1116.
[15]Kamer M, Rassoulzadegan F.Extracellular enzyme activity:indications for high short-term variability in a coastal marine ecosystem [J].Microbial ecology, 1995,30(2):143-156.
[16]Celussi M, Del Negro P.Microbial degradation at a shallow coastal site: Long-term spectra and rates of exoenzymatic activities in the NE Adriatic Sea [J].Estuarine, Coastal and Shelf Science, 2012,115:75-86.
[17]Arnosti C, Bell C, Moorhead D L, et al.Extracellular enzymes in terrestrial, freshwater, and marine environments: perspectives on system variability and common research needs [J].Biogeochemistry, 2014,117(1):5-21.
[18]Rulík M, Spáčil R.Extracellular enzyme activity within hyporheic sediments of a small lowland stream [J].Soil Biology and Biochemistry, 2004,36(10):1653-1662.
[19]Caruso G.Leucine aminopeptidase, β-glucosidase and alkaline phosphatase activity rates and their significance in nutrient cycles in some coastal Mediterranean sites [J].Marine Drugs, 2010,8(4):916-940.
[20]Hoppe H G, Ullrich S.Profiles of ectoenzymes in the Indian Ocean: phenomena of phosphatase activity in the mesopelagic zone [J].Aquatic Microbial Ecology, 1999,19(2):139-148.
[21]Rosso A L, Azam F.Proteolytic activity in coastal oceanic waters:depth distribution and relationship to bacterial populations [J].Marine Ecology Progress Series, 1987,41(3):231-240.
[22]郑天凌,王 斐.台湾海峡水域的 β-葡萄糖苷酶活性 [J].应用与环境生物学报, 2001,7(2):175-182.
[23]宋福行.胶州湾海水中胞外酶活性的动态变化及其调控因素的初步研究 [D].青岛:中国科学院海洋研究所, 2001.
[24]王 新.我国近海典型海域微生物的分布与活性研究 [D].厦门:厦门大学, 2007.
[25]Hoppe H G.Significance of exoenzymatic activities in the ecology of brackish water-measurements by means of methylumbelliferyl-substrates [J].Marine Ecology Progress Series, 1983,11(3):299-308.
[26]Hoppe H G.Use of fluorogenic model substrates for extracellular enzyme activity (EEA) measurement of bacteria [M]//Handbook of Methods in Aquatic Microbial Ecology, 1993,423-431.
[27]张 辉,石晓勇,张传松,等.北黄海营养盐结构及限制作用时空分布特征分析 [J].中国海洋大学学报:自然科学版, 2009,39(4):773-780.
[28]Parsons T R, Maita Y, Lalli C M.A manual of chemical and biological methods for seawater analysis [M].Oxford: Pergamon Press, 1984,101-104.
[29]Mudryk Z J, Skórczewski P.Extracellular enzyme activity at the air–water interface of an estuarine lake [J].Estuarine, Coastal and Shelf Science, 2004,59(1):59-67.
[30]Davey K E, Kirby R R, Turley C M, et al.Depth variation of bacterial extracellular enzyme activity and population diversity in the northeastern North Atlantic Ocean [J].Deep Sea Research Part II: Topical Studies in Oceanography, 2001,48(4):1003-1017.
[31]Vives Rego J, Billen G, Fontigny A, et al.Free and attached proteolytic activity in water environments [J].Marine ecology.Progress series, 1985,21(3):245-249.
[32]Münster U.Studies on phosphatase activities in humic lakes [J].Environment international, 1994,20(1):49-59.
[33]Hoppe H G.Degradation in Seawater.[M]//Rehm H J, Reed G(eds).Biotechnology.VCH Verlagsgesellschaft Weinheim, 1986:453-474.
[34]Li H, Veldhuis M J W, Post A F.Alkaline phosphatase activities among planktonic communities in the northern Red Sea [J].Marine Ecology Progress Series, 1998,173:107-115.
[35]Chróst R J.Characterization and significance of β-glucosidase activity in lake water [J].Limnology and Oceanography, 1989,34(4):660-672.
[36]Chróst R J.Environmental control of the synthesis and activity of aquatic microbial ectoenzymes [M].Microbial enzymes in aquatic environments.Springer New York, 1991:29-59.
[37]Gajewski A J, Kirschner A K T, Velimirov B.Bacterial lipolytic activity in a hypertrophic dead arm of the river Danube in Vienna[J].Hydrobiologia, 1997,344(1-3):1-10.
[38]Reemtsma T, Haake B, Ittekkot V, et al.Downward flux of particulate fatty acids in the central Arabian Sea [J].Marine Chemistry, 1990,29:183-202.
[39]Nagata T, Kirchman D L.Release of macromolecular organic complexes by heterotrophic marine flagellates [J].Marine Ecology Progress Series, Oldendorf, 1992,83(2):233-240.
[40]Siuda W, Wcisło R, Chróst R J.Composition and bacterial utilization of photosynthetically produced organic matter in an eutrophic lake [J].Archiv für Hydrobiologie, 1991,121(4):473-484.
[41]Ainsworth A M, Goulder R.The effects of sewage-works effluent on riverine extracellular aminopeptidase activity and microbial leucine assimilation [J].Water Research, 2000,34(9):2551-2557.
[42]Foreman C M, Franchini P, Sinsabaugh R L.The trophic dynamics of riverine bacterioplankton: relationships among substrate amiability, ectoenzyme kinetics, and growth [J].Limnology and Oceanography, 1998,43:1344-1352.
[43]Mallet C, Debroas D.Relations between organic matter and bacterial proteolytic activity in sediment surface layers of a eutrophic lake (Lake Aydat, Puy de Dôme, France) [J].Archiv für Hydrobiologie, 1999,145(1):39-56.
[44]Brown S E, Goulder R.Extracellular-enzyme activity in troutfarm effluents and a recipient river [J].Aquaculture Research,1996,27(12):895-901.
[45]Patel A B, Fukami K, Nishijima T.Regulation of seasonal variability of aminopeptidase activities in surface and bottom waters of Uranouchi Inlet, Japan [J].Aquatic Microbial Ecology,2000,21(2):139-149.
[46]Caruso G.Leucine aminopeptidase, β-glucosidase and alkaline phosphatase activity rates and their significance in nutrient cycles in some coastal Mediterranean sites [J].Marine Drugs, 2010,8(4):916-940.
[47]Azam F.Intense hydrolytic enzyme activity on marine aggregates and implications for rapid particle dissolution [J].Nature, 1992,359:10.
[48]Köster M, Dahlke S, Meyer-Reil L.Microbiological studies along a gradient of eutrophication in a shallow coastal inlet in the southern Baltic Sea(Nordruegensche Bodden) [J].Marine Ecology Progress Series, 1997,152(1):27-39.
[49]Lipizer M, Cossarini G, Falconi C, et al.Impact of different forcing factors on N: P balance in a semi-enclosed bay: the Gulf of Trieste (North Adriatic Sea) [J].Continental Shelf Research,2011,31(16):1651-1662.
[50]Williams P M, Carlucci A F, Henrichs S M, et al.Chemical and microbiological studies of sea-surface films in the southern Gulf of California and off the west coast of Baja California [J].Marine Chemistry, 1986,19(1):17-98.
[51]Maki J S.The air-water interface as an extreme environment [J].Aquatic Microbiology-An Ecological Approach (Ford TE, ed).Boston: Blackwell Scientific Publications, 1993:409-440.
[52]伍应艳.渤海温度混合和层化演变的三维数值模拟 [D].杭州:浙江大学, 2002.
[53]杨殿荣,匡国瑞,张玉琳,等.黄、东海夏季温跃层的诊断研究 [J].海洋学报, 1990,12(1):14-23.
