水煮加热虾肉蛋白变化研究
2015-08-02李晓龙刘书成解万翠吉宏武毛伟杰
李晓龙,刘书成,解万翠,吉宏武,毛伟杰
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东湛江 524088)
水煮加热虾肉蛋白变化研究
李晓龙,刘书成,解万翠,吉宏武,毛伟杰*
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东湛江 524088)
水煮加热是熟虾制品加工中一种常用手段。为了研究水煮加热虾肉蛋白变性和分子间作用力的变化规律,测定了80、90、100 ℃三种加热温度条件下虾仁的中心温度、蛋白各组分含量、溶解度、总巯基含量和Ca2+-ATPase活性变化。结果表明,温度越高,蛋白组分含量变化越明显(p<0.05);80 ℃加热条件下离子键和氢键变化最为明显,终点含量明显低于90、100 ℃加热(p<0.05);温度对疏水作用的影响大小为90 ℃>100 ℃>80 ℃;不同加热条件下,总巯基含量和Ca2+-ATPase活性均呈下降趋势,最终趋近于0,100 ℃加热条件下两者变化最为显著。
水煮,虾肉,蛋白变化,总巯基
虾肉蛋白质含量高,营养丰富,味道鲜美,深受人们喜爱。虾是一种季节性的水产品,价格随季节波动较大且易腐败,为了提高虾的经济价值,避免资源浪费,需要对生鲜虾进行加工,目前虾的冷冻加工品较多,但是熟虾制品还比较少,为保证虾产业的健康发展,方便人们的生活,开发熟制虾品具有广阔的市场前景。
水煮加热是虾类熟制品加工中的一种常用手段。水煮加热条件会对水产品的品质产生重要的影响。适当的热处理有助于水产品品质的提高[1],一方面有助于水产品风味[2]、色泽和质构[3]的形成,但过度加热会导致肌肉持水能力降低,质构及风味变差[4],水产品性质的改变多由蛋白质变性引起,蛋白的变性程度是影响热加工后品质变化的主要因素。
肌肉蛋白质的构象是通过离子键、氢键、疏水相互作用、二硫键、范德华力等化学作用力来稳固的[5]。水煮加热过程中,分子间作用力发生改变,结构遭到破坏,蛋白发生聚集变性,最终体现为蛋白物理或者化学性质的改变。目前,鱼、虾、贝类等蛋白的热变性研究主要集中失水率、质构等物理变化,对于热处理过程中的蛋白质变化多将肌原纤维蛋白[6]、肌浆蛋白[7]、肌动球蛋白[8]等提取出来进行研究,姚磊等[6]研究发现总巯基含量和Ca2+-ATPase活性和蛋白质变性程度密切相关。单一的蛋白变化无法全面反映整体蛋白的变化过程。而在熟虾制品加工过程中,多以整只虾或虾仁为原料,因此,对加热过程中全蛋白的变化进行研究更有现实意义。
目前,对水煮加热过程中虾肉蛋白质变性规律和内部化学键的变化的研究还较少。本研究主要针对不同的水煮加热条件下虾肉蛋白质的组分、溶解度、总巯基含量和Ca2+-ATPase活性进行研究,探讨其水煮加热条件下变化规律,为工业化生产提供理论参考。
1 材料与方法
1.1 材料与仪器
冷冻基围虾(Metapenaeusensis)仁 (6.52±0.37)g/只,体长(6.81±0.47)cm,购于国联水产有限公司;氯化钾、磷酸氢二钠、磷酸二氢钾、盐酸、硫酸、氢氧化钠、碳酸钠、尿素和氯化钠 广州化学试剂厂,分析纯;ATPase测试试剂盒 南京建成生物工程研究所;5,5′-二硫代双(2-硝基苯甲酸)(DTNB) Sigma公司。
ES-C300A电子天平 湘仪天平仪器有限公司;恒温水浴锅 上海跃进医疗器械厂;VX5000R无纸记录仪 杭州盘古自动化系统有限公司;Philips 2860 打浆机 珠海菲利普家庭电器有限公司;高速台式离心机 湛江裕鑫实业有限公司;UV757T紫外可见分光光度计 上海江岳仪器仪表有限公司;凯氏定氮装置 林达化学仪器公司;均质机 顺城仪器设备厂。
1.2 实验方法
1.2.1 样品制备 将冷冻虾仁从冷柜取出,置于4 ℃冰箱解冻12 h,备用。恒温水浴锅温度分别设置为80、90、100 ℃,原料与水比例为1∶10,将无纸记录仪温度探针插入虾仁第二腹节中心,当中心温度达到25、35、45、55、65、75 ℃时迅速取出样品,置于封口袋中冰水冷却30 min,备用,未处理虾仁作为对照样品。每隔10 s记录样品中心温度变化。
1.2.2 蛋白各组分含量变化测定 将制备的样品用打浆机打成肉糜状。准确称取虾肉1.00 g,加入15 mL磷酸盐缓冲液A(3.5 mol/L KH2PO4,15.6 mmol/L Na2HPO4,pH 7.0),20000 r/min 条件下均质1 min,4 ℃条件下7500 r/min离心30 min,收集上清液,重复三次,上清液即为水溶性蛋白溶液,向离心后的沉淀中加入磷酸盐缓冲液B(0.45 mol/L KCl,3.5 mol/L KH2PO4,15.6 mmol/L Na2HPO4,pH 7.0),20000 r/min 均质1 min后7500 r/min,4 ℃离心30 min,收集上清液,重复三次,即为盐溶性蛋白溶液,沉淀为不溶性蛋白[9]。蛋白含量测定采用凯氏定氮法,平行测定三次。
1.2.3 蛋白溶解度变化测定 根据Liu[10]的测定方法,稍加修改。分别称取虾肉1.00 g,加入25 mL SA(0.05 mol/L NaCl)、SB(0.6 mol/L NaCl)、SC(0.6 mol/L NaCl,1.5 mol/L Urea),SD(0.6 mol/L NaCl,8 mol/L Urea)。冰水浴20000 r/min匀浆2 min,4 ℃条件下7000 r/min离心15 min,福林酚法测各溶液中蛋白浓度,平行测定三次。
1.2.4 Ca2+-ATPase活性测定 酶活测定利用南京建成生物工程研究所ATPase测试试剂盒测定,ATP酶分解ATP生成ADP及无机磷。因此,测定结果用每小时每毫克组织蛋白中ATPase酶分解ATP产生无机磷的量表示,即微摩尔分子磷/毫克蛋白/小时(μmol Pi/mgprot/h)。
1.2.5 总巯基含量测定 总巯基测定采用Jiang[11]的方法,稍加修改。吸取1 mL 1.2.2中盐溶性蛋白溶液,加入3 mL 0.2 mol/L Tris-HCl缓冲液(8 mol/L Urea,10 mmol/L EDTA,2% SDS,pH 6.8)。混合均匀后加入0.4 mL 0.1% DTNB(0.2 mol/L Tris-HCl,pH 8.0)。置于40 ℃温水浴中25 min,412 nm 测其吸光度,平行测定三次。总巯基含量用公式1计算。
总巯基含量(mol/105g)
=A×D/(13600 L·mol-1·cm-1×C)
式(1)
A为吸光度,D为稀释倍数,13600 L·mol-1·cm-1为分子吸光系数,C为蛋白浓度(mg/mL)。
1.3 数据处理
利用JMP 7.0.2和Excel 2007对实验数据进行分析统计。数据用平均值±标准差表示,组间分析采用t-检验,p<0.01为极显著,p<0.05为显著,p>0.05为不显著。
2 结果与分析
2.1 不同加热条件下虾仁中心温度变化
虾肉蛋白变性的程度受加热温度和加热时间的影响。为了最大限度地保持肉原有的营养及风味,杀灭大多数微生物,设置中心温度达到75 ℃为加热终点[12]。如图1所示,未经热处理的虾肉初始中心温度均控制在10 ℃左右,随着加热的温度越高,虾仁中心温度变化越快,100 ℃加热条件下,中心温度达到75 ℃只需70 s。100 ℃加热时,中心温度的上升速度与加热时间接近于9∶10的比例关系,而80、90 ℃加热时在中心温度达到40 ℃之前升温速度与加热时间分别接近于1∶1、4∶5的正比例关系,之后增长趋势缓慢。

图1 80、90、100 ℃水煮加热虾仁中心温度变化Fig.1 Changes of shrimp central temperature during80,90 and 100 ℃ boiled
2.2 蛋白含量变化
虾肉蛋白主要有水溶性蛋白、盐溶性蛋白和不溶性蛋白构成。水溶性蛋白主要成分为肌浆蛋白,盐溶性蛋白成分主要为肌原纤维蛋白,不溶性蛋白包括肌基质蛋白和热处理后的变性蛋白[13]。如图2中所示,未处理样品水溶性蛋白、盐溶性蛋白和不溶性蛋白的含量分别为5.89%±0.25%、11.04%±0.18%、1.57%±0.05%,随着加热的进行,水溶性蛋白和盐溶性蛋白逐渐减少(p<0.05),不溶性蛋白含量增加(p<0.05)。加热的温度越高,变化越明显(p<0.05)。

图2 80、90和100 ℃加热条件下蛋白组分含量变化Fig.2 Contents change of protein components during80,90 and 100 ℃ boiled
如图2a所示,80 ℃加热前期水溶性蛋白含量变化差异不大(p>0.05),加热终点含量明显下降(p<0.05),但仍高于90 ℃和100 ℃加热。如图2b所示,在中心温度达到65 ℃以后继续加热,盐溶性蛋白含量变化不再显著(p>0.05)。通过对比可以发现,盐溶性蛋白在加热初期变化比较明显(p<0.05),而水溶性蛋白含量下降较为缓慢,说明盐溶性蛋白变性温度要低于水溶性蛋白,这与Belibaghet等人的研究结果吻合[14]。在不同加热温度下,蛋白含量变化程度不同。100 ℃加热条件达到不同中心温度时,水溶性蛋白和盐溶性蛋白含量变化最为明显(p<0.05),加热温度高更容易引起水溶性蛋白和盐溶性蛋白的变性。袁莉莉对虾肉糜升温过程中蛋白质种类及含量变化进行了研究,结果表明水溶性蛋白和盐溶性蛋白受热含量减少,不溶性的蛋白含量升高,热处理过程中水溶性和盐溶性蛋白发生共价键交联,形成了高分子量的蛋白质聚集体,生成了不溶性的蛋白[15]。
2.3 蛋白溶解度变化
蛋白的空间结构决定了蛋白的物化性质,当蛋白受到物理、化学等因素的作用时,空间结构受到破坏,发生重组、聚集,分子间作用力也会经历断裂、重新形成的过程。蛋白溶解度和分子间作用力有密切的关系。蛋白的溶解是同溶剂之间的相互作用[16],蛋白的溶解度是蛋白的一种重要功能性质,也是反应蛋白变性程度的一个重要指标,通过测定蛋白在不同溶液中的溶解度,可以反应相应分子间作用力的变化。
如图3所示,用SB溶液和SA溶液的蛋白浓度差表示离子键变化,SC溶液和SB溶液蛋白浓度差表示氢键变化,SD溶液和SC溶液蛋白浓度差表示疏水相互作用的变化[10]。虾肉蛋白质的离子键和氢键从10 ℃到75 ℃热处理过程中显著降低(p<0.05),疏水作用升高趋势明显(p<0.05)。温度对蛋白质分子间作用力的影响程度不同。从图3a中可以看出,加热温度升高,离子键含量反而下降较为缓慢,温度较低的情况下,氢键含量变化显著(p<0.01)。对于氢键变化,80 ℃加热初始阶段氢键含量降低明显(p<0.01),加热终点含量最低,其次为100、90 ℃加热,这可能是因为加热条件下蛋白受热变性,离子键和氢键断裂,含量降低,而在90 ℃和100 ℃加热条件下,离子键和氢键重新形成,生成稳定的蛋白构象。温度对疏水作用的影响为90 ℃>100 ℃>80℃。100 ℃加热条件下疏水作用小于90 ℃加热,有可能是因为100 ℃加热温度较高,蛋白形成凝胶以后发生劣化,降低了其疏水作用。分子间作用力和虾仁的质构品质紧密相关,控制加热条件和蛋白分子间作用力的变化,对提高熟虾制品的品质有着重要的意义。

图3 80、90、100 ℃加热条件下蛋白质在不同溶液中溶解度差变化Fig.3 Difference of protein solubility indifferent solution during 80,90 and 100 ℃ boiled
2.4 总巯基含量变化
如图4所示,三种热处理条件下,总巯基含量下降。虾仁中心温度达到45 ℃之前,巯基含量变化明显(p<0.01),中心温度达到45 ℃后,随着加热的进行,巯基含量没有显著变化(p>0.05)。Wang等人[7]测定了冰冻鲤鱼肌原纤维蛋白从20 ℃加热到80 ℃的总巯基含量变化,发现当中心温度达到45 ℃以后,总巯基含量变化不明显。

图4 80、90、100 ℃加热条件下巯基含量变化Fig.4 Contents change of total thiol group during80,90 and 100 ℃ boiled
蛋白变性的过程涉及到巯基和二硫键的转化。热处理过程中,蛋白的空间结构受到破坏,蛋白结构打开,隐藏在分子内部的巯基基团暴露出来,氧化形成二硫键,巯基基团数量减少,导致ATPase活性降低[17]。因此,总巯基含量可一定程度上反映蛋白变性程度的大小。
2.5 Ca2+-ATPase活性变化
研究表明,在冷藏和热处理过程中,Ca2+-ATPase活性都会有不同程度的降低。Ca2+-ATPae存在于组织细胞及细胞器的膜上,是生物膜上的一种蛋白酶,它在物质运输、能量转换以及信息传递方面具有重要作用。Ca2+-ATPase活性主要与肌球蛋白球状头部结构有关,肌球蛋白球状头部命名为SH1、SH2的巯基基团被证实与ATPase活性有关,Ca2+-ATPase活性和巯基数量有一定的联系[18]。
Ca2+-ATPase活性下降的快慢主要和肌球蛋白的变性程度有关,肌球蛋白与虾仁的持水能力密切相关[19]。肌球蛋白变性程度越快,Ca2+-ATPase活性下降越明显,如图5所示,随着加热的进行,Ca2+-ATPase活性呈下降趋势。其中,和80 ℃水煮加热条件相比,90、100 ℃加热条件下,Ca2+-ATPase活性下降更快(p<0.05)。当虾仁中心温度在10~45 ℃区间内,Ca2+-ATPase活性在温度较高的加热条件下变化显著(p<0.05),之后变化趋于平缓(p>0.05)。虽然加热过程中,酶活性变化程度不同,但加热终点含量区别不明显(p>0.05),趋近于零。
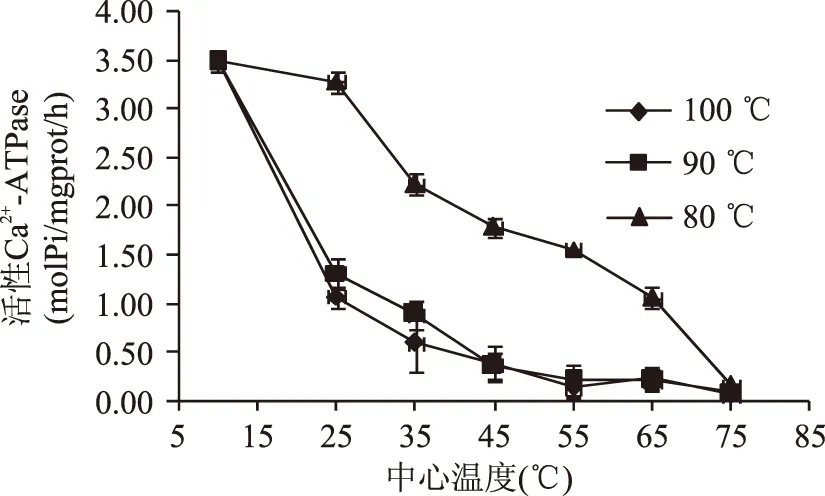
图5 80、90和100 ℃加热条件下Ca2+-ATPase活性变化Fig.5 The activity changes of Ca2+-ATPase during80,90 and 100 ℃ boiled
3 结论
水煮热处理作为一种经济实用的加工方式,广泛应用于水产品等食品加工中。本研究以整只虾仁为研究对象,通过比较80、90、100 ℃三种加热条件下蛋白质的理化变化发现,加热温度越高,虾仁中心温度变化越迅速。对于蛋白组分含量、总巯基含量和Ca2+-ATPase活性,温度越高,变化越明显(p<0.05)。蛋白变性过程中分子间作用力的变化与加热的温度和时间关系密切,分子间作用力的计算结果却不同于其他变化。80 ℃加热条件下离子键变化最为明显,终点含量最低,其次是90 ℃加热和100 ℃加热,氢键含量变化则是80 ℃>100 ℃>90 ℃,疏水作用90 ℃条件下变化最明显,其次是100 ℃和80 ℃,分子间作用力变化和虾仁口感、质构品质有密切联系。通过测定加热过程中虾仁的理化变化,可以优化加工条件,进而提高产品的质量。
[1]甘晓玲,和劲松,朱瑞,等. 热处理对凡纳滨对虾虾仁加工品质的影响[J]. 食品科学,2012,33(19):29-34.
[2]池岸英,吉宏武,高加龙,等. 加热方式对凡纳滨对虾滋味成分的影响[J]. 现代食品科技,2012,28(7):776-779.
[3]郭力,过世东,刘海英. 盐煮和微波加热对即食龙虾质构的影响[J]. 食品与生物技术学报,2011,30(3):376-380.
[4]刘姗,刘晓艳.热变性对蛋白理化性质的影响[J]. 中国食品添加剂,2007(6):108-112.
[5]Fennema O R,王璋,许时婴,等. 食品化学[M]. 北京:中国轻工业出版社,2003.
[6]姚磊,罗永康,沈慧星,等. 鲫肌原纤维蛋白加热过程中理化特性变化规律[J]. 水产学报,210,123(031):420.
[7]Wang H,Luo Y K,Shen H X. Effect of frozen storage on thermal stability of sarcoplasmic protein and myofibrillar protein from commom carp(Cyprinus carpio)muscle[J]. International Journal of Food Science and Technology,2013,48:1962-1969.
[8]王继涛,朱蓓薇,董秀萍,等. 热处理对扇贝闭壳肌肌动球蛋白生化性质的影响[J]. 食品与发酵工业,2012,38(2):22-26.
[9]Hashimoto K,Watabe S,Kono M,et al. Muscle proteincomposition of sardine and mackerel[J]. Bulletin of the Japanese Society of Scientific Fisheries,1979,45:1435-1441.
[10]Liu R,Zhao S M,Xie B J,et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids,2011,25(5):898-906.
[11]Jiang S T,Hwang D C,Chen C S. Effect of Storage Temperatures on the Formation of Disulfides and Denaturation of Milkfish Actomyosin(Chanos chanos)[J]. Journal of Food Science,1988,53:1333-1335.
[12]孙链,周辉,徐宝才. 低温肉制品腐败微生物控制技术研究进展[J]. 肉类研究,2010(7):40-45.
[13]孙丽. 金枪鱼肉在蒸煮过程中品质特性变化的研究[D]. 无锡:江南大学,2009.
[14]Belibaghet K B,Speers R A,Paulson A T. Thermophysical properties of silver hake and mackerel surimi at cooking temperatures[J]. Journal of Food Engineering,2003,60:439-448.
[15]袁莉莉. 凡纳滨对虾肉糜凝胶特性研究及虾肉肠的研发[D]. 湛江:广东海洋大学,2013.
[16]刘洋涛,陆利霞,林丽军,等. 热处理对鱼肉品质的影响研究进展[J]. 安徽农业科学,2012,40(32):15891-15893.
[17]许艳顺. 发酵鲢鱼鱼糜凝胶形成及其机理研究[D]. 无锡:江南大学,2010.
[18]Roura S.I,Crupkin M. Biochemical and functional properties of myofibrils from pre and post-spawned hake(Merluccius hubbsi marini)stored on ice[J]. Journal of Food Science,1995,60:269-272.
[19]Naomi I,Mika F,Noboru S. Effect of protein denaturation degree on texture and water state of cooked meat[J]. Journal of Food Engineering,2013,117:361-369.
Protein changes in shrimp muscle during boiled processing
LI Xiao-long,LIU Shu-cheng,XIE Wan-cui,JI Hong-wu,MAO Wei-jie*
(College of Food Science and Technology,Guangdong Ocean University,Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China)
Water heating is a common method used in shrimp cooking. In order to investigate the changes of protein denaturation and intermolecular forces of shrimp during boiling,central temperature,contents change of each protein component,protein solubility,total sulfhydryl content and Ca2+-ATPase activity under 80,90 and 100 ℃ were measured. The results showed that the higher the temperature was,the more significantly protein components changed. It was obvious that the changes of contents of ionic bonds and hydrogen bonds under 80 ℃ heating were less than those under 90 ℃ and 100 ℃(p<0.05). Effect of temperature on the hydrophobic interaction was 90 ℃>100 ℃>80 ℃. The total sulfhydryl(-SH)content and Ca2+-ATPase activity were showed a downward trend under different heating conditions,approaching 0 finally and both of them were significantly changed under 100 ℃ heating.
boiled;shrimp muscle;protein change;total-SH
2014-10-23
李晓龙(1989-),男,硕士研究生,研究方向:水产品加工及贮藏工程,E-mail:xiaolong7269@163.com。
*通讯作者:毛伟杰(1973-),女,博士,研究方向:低值海洋生物资源化学成分及高值化利用, E-mail:973575112@qq.com。
国家虾产业技术体系建设(CARS-48);国家自然科学基金(31301513)。
TS254.1
A
1002-0306(2015)15-0066-05
10.13386/j.issn1002-0306.2015.15.005
