GSTM1GSTM1基因多态性与亚洲人群前列腺癌易感性的MetaMeta分析
2015-08-02黄敏志黄裕清余自强邹火生张河元冯凌松梅州市人民医院泌尿外二科广东梅州514031
黄敏志 黄裕清 余自强 邹火生 李 健 张河元 冯凌松梅州市人民医院泌尿外二科(广东梅州 514031)
GSTM1GSTM1基因多态性与亚洲人群前列腺癌易感性的MetaMeta分析
黄敏志 黄裕清 余自强 邹火生 李 健 张河元 冯凌松
梅州市人民医院泌尿外二科(广东梅州 514031)
摘要目的 探讨亚洲人群谷胱甘肽巯基转移酶基因GSTM1多态性与前列腺癌易感性的关系。方法 检索Pubmed、EMBase、CBM、CNKI、VIP、万方数据平台从建库到2013年8月1日的文献,对所纳入的研究,运用RevMan5.2软件进行meta分析,Stata11.0软件进行Egger's检验和Begg's检验。结果 共纳入13篇病例对照研究,累计样本量为3889例,其中前列腺癌病例组1 444例,对照组2 445例。Meta分析结果可见亚洲人群中GSTM1无效基因型与前列腺癌易感性呈显著性正相关(OR=1.42,95% CI=1.10-1.82,P=0.007)。亚组分析提示,印度人群及东亚人群中,GSTM1无效基因型均显示出能显著增加前列腺癌易感性(OR=1.73,95% CI=1.18-2.53,P=0.005)(OR=1.43,95% CI=1.02-2.02,P=0.04)。各文献间未见明显发表偏倚。结论 在亚洲人群中GSTM1无效基因型与前列腺癌易感性呈正相关。
关键词谷胱甘肽转移酶; 多态性, 单核苷酸; 前列腺肿瘤; Meta分析
前列腺癌是最常见的泌尿生殖系恶性肿瘤之一。其发病率随年龄增长而增加,50岁以上男性为发病高峰,严重威胁中老年男性健康。寻找到预测前列腺癌易感性和恶性程度的标志物能极大促进公共健康,保护中老年男性免受前列腺癌的危害。目前前列腺癌作为复杂性疾病,其病因尚不清楚。根据流行病学研究提示,前列腺癌与环境、种族、基因、激素及饮食习惯等多因素有关[1]。环境中的致癌物及代谢过程中产生的内生性致癌物均在前列腺癌发生发展中起到重要作用。众所周知,暴露于潜在致癌物质是前列腺癌的病原学因素。
谷胱甘肽巯基转移酶(GST)是一个具有超家族的酶系,细分为7类(α,μ,ω,π,σ,θ,ξ)。其作用是通过与谷胱甘肽结合,进而催化亲电子化合物对外源性物质(致癌物,治疗药物,环境毒素)及内源性氧化产物的解毒功能[2]。此偶联反应是机体降低致癌物毒性、促进致癌物排出体外的一个重要步骤。因此,对于内源及外源性致癌物所产生的亲电子化合物造成的DNA损伤,GSTs起着维持基因组的完整性及DNA修复等非常重要的作用。因此,GST酶可能在前列腺癌的发生发展中发挥了关键的作用。GSTM1无效基因型较早被发现,因其可使GSTM1蛋白酶失活而被广泛研究。由于种族、地域等差异,国内外关于GSTM1无效基因型与前列腺癌关系的研究存在争议。为了全面评价亚洲人群GSTM1无效基因型与前列腺癌易感性的关系,本文综合既往相关研究进行Meta分析。
资料与方法
一、检索策略
检索Pubmed、EMBase、CBM、CNKI、VIP、万方数据平台,并追溯所有初步纳入文献的参考文献。搜索年限从建库到2013年8月1日。英文搜索策略为("single nucleotide polymorphism" OR SNP OR polymorphism OR "genetic variation" OR "genetic variant" OR mut* OR "Polymorphism, Single Nucleotide" [MeSH]) AND ("prostate cancer" OR "prostate carcinoma" OR "Prostatic Neoplasms" [MeSH]) AND ("GSTM1" OR "glutathione S transferase"[MeSH])。中文搜索策略:(前列腺癌OR 前列腺肿瘤)AND(基因多态性 OR 多态性OR SNP)AND(GSTM1 OR "glutathione S transferase" OR谷胱甘肽巯基转移酶)。手工检索相关杂志、会议论文、学位论文、科技报告。逐一阅读以亚洲人群为试验对象的有关GSTM1无效基因型的文献。
二、文献纳入和排除标准
1. 纳入标准:(1)国内外公开发表的研究GSTM1无效基因型与前列腺癌易感性的相关临床对照研究,研究设计科学,研究对象有基本构成资料,语言不限;(2)文献给出病例组及对照组各多态性基因型频率;(3)病例组病理学确诊为前列腺癌;(4)对照组为年龄配对、无泌尿系症状的健康人群;(5)病例组与对照组人群基因频率符合Hardy-Weinberg遗传平衡。
2. 排除标准:(1)重复发表的文献;(2)对照组人群来源不清,特别是患其它系统疾病,未进行超声或CT检查及未进行PSA筛查的人群者;(3)非临床对照研究。
三、数据提取
由第一、第二作者独立阅读文题、摘要,对可能符合纳入标准的试验进一步阅读全文,对纳入有矛盾的试验由第三作者与前二位作者共同讨论决定。从每个纳入的文献中提取以下数据:第一作者、出版年份、对象人群、检测方法、病例对照实验类型,病例组和对照组基因型频率。
四、统计学分析
采用RevMan 5.2进行Meta分析,Stata11.0软件进行Egger’s检验和Begg’s检验[3,4]。各研究的异质性由Q检验和I2值评价。如I2<50%,选用固定效应模型进行Meta分析;如I2>50%,则采用随机效应模型。Egger's检验和Begg's检验评价发表偏倚。
结 果
一、文献检索结果
共检索到英文文献86篇、中文文献3篇(截止2013-8-1),逐一阅读全文筛选与GSTM1无效基因型有关文献,最后共纳入13篇,试验设计均为病例对照研究,累计样本量为3 889例,其中病例组1 444例,对照组2 445例(筛选流程见图1,纳入文献基本资料见表1)。

图1 文献筛选流程
二、MetaMeta分析结果
各亚组及总体的关于GSTM1无效基因型与前列腺癌易感性(图2)。Meta分析显示,纳入的13篇文献研究间具有明显异质性,亚组间为(Q=6.96,P=0.03,I 2=71.3%),印度亚组为Q=13.05,P=0.02,I 2=62%),东亚(中国、日本、韩国)亚组为Q=13.05,P=0.01,I2=69%)。故采用随机效应模型为各独立研究赋予权重并进行合并。将各研究文献按地域划分为西亚的伊朗,中亚的印度,以及东亚的中国、日本和韩国三国。随机效应模型提示,总体上,亚洲人群中GSTM1无效基因型与前列腺癌易感性呈显著性正相关(OR=1.42,95% CI=1.10~1.82,=0.007)。各亚组中,关于伊朗人群的文献有两篇,GSTM1无效基因型与前列腺癌易感性未见明显关联(OR=0.74,95% CI=0.44~1.24,P=0.25);关于印度人群的文献有6篇,GSTM1无效基因型与前列腺癌易感性呈显著性正相关性(OR=1.73,5% CI=1.18~2.53,P=0.005);关于东亚人群的文献有5篇,GSTM1无效基因型亦显示出能显著增加前列腺癌易感性(OR=1.43,95% CI=1.02~2.02,=0.04)。
三、发表偏倚评估
采用Egger's检验和Begg's检验分别评价入选13个病例对照研究的发表偏倚(图3)。在Egger’s法回归分析中,截距为-0.05,P>|t|指标为0.96,且由图3A3A可见,13个点分布均匀对称,未见明显发表偏倚。Begg's检验显示Pr>|z| = 1.000,且图3B3B各对应点分布对称,同样未见明显发表偏倚。
讨 论
前列腺癌是由遗传和环境等多因素共同致病的复杂疾病。流行病学及基础实验研究显示,环境中的甲基亚硝基脲(MNU)、3,2-二甲基4氨基联苯(DMAB)等化学物有较明确的致癌作用,特别是增加前列腺癌的发生率[5]。因此,在II相阶段解毒作用及维持基因组完整性方面具有重要作用的GST-μL酶,作为谷胱苷肽巯基转移酶(GST)超家族中的一员,其编码基因被广泛研究。GSTM1的基因编码定位于染色体1p13.3,通过替代和删除机制可产生两个基因型位点。替代是位于534位点的碱基C被G替代,导致合成天冬氨酸而替代赖氨酸,这似乎并不影响酶的功能。缺失突变体是无功能的GSTM1基因型,因其会导致GST-μL合成的缺失而比替代突变体更多的用于研究中[2]。因此,在这篇文章中,我们只研究导致GSTM1基因缺失突变的无效基因型。 GSTM1无效基因型与肿瘤易感性的关系被广泛研究。目前分子流行病学较为明确的是其与肺癌[6]、肝细胞癌[7]、头颈部鳞癌[8]及喉癌[9]易感性显著正相关。然而,在亚洲人群中,GSTM1无效基因型与前列腺癌易感性之间的关系尚存争议。
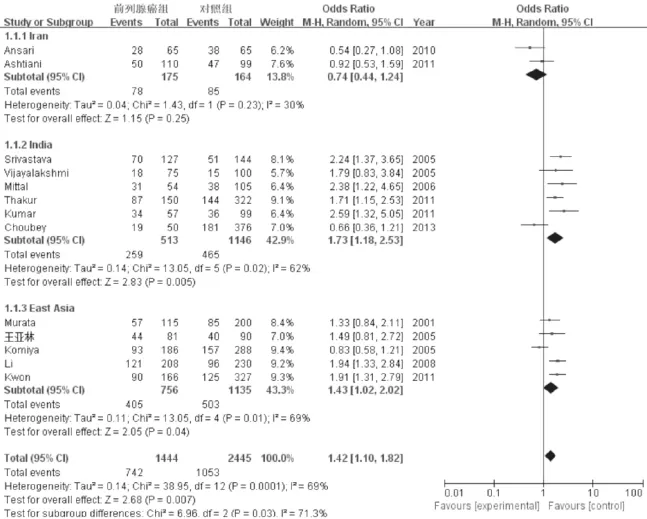
图2 GSTM1GSTM1无效基因型与前列腺癌易感性的MetaMeta分析
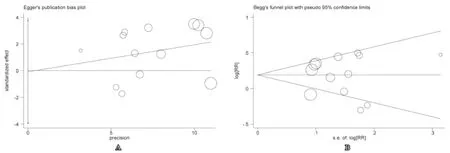
图3 各纳入文献的Egger'sger's 检验和Begg'segg's 检验
前列腺癌的生物学行为极其复杂,发生率在不同种族和地区差异很大。1997年Rebbeck等最早对467例美国白人(236例前列腺癌和231例健康对照)GSTM1无效基因型与前列腺癌易感性之间的关系进行了探究,结果未发现其显著的相关性(OR=0.96,95% CI=0.67~1.38,P>0.05)[10]。但2003年Kidd等的研究得出不同结果,通过检测200例前列腺癌和188例健康对照)GSTM1无效基因型,发现其与前列腺癌易感性两者存在负相关性(OR=0.64,95% CI=0.43~1.95,P<0.01)[11]。前列腺癌易感性与GSTM1无效基因型的关系在亚洲人群中研究较少,亚洲地域广阔,各地区人种构成并不一致。例如西亚地区主要由高加索人构成,中亚的印度地区则高加索人、黄种人和棕色人种各占比例,而东亚中日韩三国则主要由黄种人构成。因此,各自具有人种、地域和基因频率的特殊性。开发具有亚洲人群特异性的前列腺癌基因标记物,对肿瘤个体化诊断和治疗有重大研究前景。本研究通过全面综合相关研究来评价GSTM1无效基因型与亚洲人群前列腺癌的相关性,试图为前列腺癌基因诊疗提供方向。本研究纳入13项试验累计样本量为3 889例,定量分析各文献后发现,在亚洲人群中,GSTM1无效基因型能显著增加前列腺癌的易感性。为减少各研究间的偏倚,通过亚组分析,亦发现印度人群及东亚三国的人群中,GSTM1无效基因型与前列腺癌呈正相关关系。本研究虽未发现两者在伊朗等西亚高加索人群中的关系,鉴于只纳入2项研究,且样本量较少,在伊朗高加索人群中GSTM1无效基因型与前列腺癌的联系尚需进一步研究。
既往的研究对GSTM1无效基因型与前列腺癌是否相关仍有争论,本研究利用系统评价方法,通过搜集既往同类型研究,根据研究可靠性赋予不同权重,定量合并效应值,达到类似于多中心、大样本临床对照试验的效果,得出更科学、可靠的结论。但本研究的Meta分析也存在众多限制。在搜集同类型的独立研究过程中,不能得到每个研究对象的确切资料(环境毒素的暴露种类、暴露剂量、用药情况及饮食习惯),影响对前列腺癌与各因素关系的深入挖掘,并限制异质性来源的分析;发表偏倚也需要特别关注,由于研究者往往倾向发表有显著性结论的研究,导致Meta分析得出不真实的结论。本研究虽经Egger's检验和Begg's检验未发现明显发表偏倚,但考虑到纳入试验数较少,发表偏倚仍存在;另外纳入文献的质量和真实程度也影响Meta分析最终的结果。本研究虽得出GSTM1无效基因型与前列腺癌相关性的结论,但考虑到样本量和调控机制问题,更确切的结论有待进一步研究说明。
参 考 文 献
1 Schulz WA, Burchardt M, Cronauer MV. Molecular biology of prostate cancer. Mol Hum Reprod 2003; 9(8): 437-448
2 McIlwain CC, Townsend DM, Tew KD. Glutathione S-transferase polymorphisms: cancer incidence and therapy. Oncogene 2006; 25(11): 1639-1648
3 Begg CB, Mazumdar M. Operating characteristics of a rank correlation test for publication bias. Biometrics 1994; 50(4): 1088-1101
4 Egger M, Davey SG, Smith G, et al. Bias in meta-analysis detected by a simple, graphical test. BMJ 1997; 15(7109): 629-634
5 Tsuchiya N, Habuchi T. Mechanism of prostate cancer development. Nihon Rinsho 2005; 63(2): 194-197
6 Carlsten C, Sagoo GS, Frodsham AJ, et al. Glutathione S-transferase M1 (GSTM1) polymorphisms and lung cancer: a literature-based systematic HuGE review and meta-analysis. Am J Epidemiol 2008; 167(7): 759-774
7 Song K, Yi J, Shen X, Cai Y, et al. Genetic polymorphisms of glutathione S-transferase genes GSTM1, GSTT1 and risk of hepatocellular carcinoma. PLoS One 2012; 7(11): e48924
8 Zhang Y, Ni Y, Zhang H, et al. Association between GSTM1 and GSTT1 allelic variants and head and neck squamous cell cancinoma. PLoS One 2012; 7(10): e47579 9 Ying XJ, Dong P, Shen B, et al. Glutathione S-transferase M1 gene polymorphism and laryngeal cancer risk: a meta-analysis. PLoS One 2012; 7(8): e42826
10 Rebbeck TR, Walker AH, Jaffe JM, et al. Glutathione S-transferase-mu (GSTM1) and -theta (GSTT1) genotypes in the etiology of prostate cancer. Cancer Epidemiol Biomarkers Prev 1999; 8(4 pt 1): 283-287
11 Kidd LC, Woodson K, Taylor PR, et al. Polymorphisms in glutathione-S-transferase genes (GST-M1, GST-T1 and GST-P1) and susceptibility to prostate cancer among male smokers of the ATBC cancer prevention study. Eur J Cancer Prev 2003; 12(4): 317-320
12 Murata M, Watanabe M, Yamanaka M, et al. Genetic polymorphisms in cytochrome P450 (CYP) 1A1, CYP1A2, CYP2E1, glutathione S-transferase (GST) M1 and GSTT1 and susceptibility to prostate cancer in the Japanese population. Cancer Lett 2001; 165(2): 171-177
13 Srivastava DS, Mandhani A, Mittal B, et al. Genetic polymorphism of glutathione S-transferase genes (GSTM1, GSTT1 and GSTP1) and susceptibility to prostate cancer in Northern India. BJU Int 2005; 95(1): 170-173
14 Vijayalakshmi K, Vettriselvi V, Krishnan M, et al. Polymorphisms at GSTM1 and GSTP1 gene loci and risk of prostate cancer in a South Indian population. Asian Pac J Cancer Prev 2005; 6(3): 309-314
15 王亚林, 江军, 王洛夫, 等. GSTM1、GSTT1基因多态性与中国人前列腺癌风险关系. 第三军医大学学报2005; 27(10): 1039-1041
16 Komiya Y, Tsukino H, Nakao H, et al. Human glutathione S-transferase A1, T1, M1, and P1 polymorphisms and susceptibility to prostate cancer in the Japanese population. J Cancer Res Clin Oncol 2005; 131(4): 238-242
17 Mittal RD, Mishra DK, Mandhani A. Evaluating polymorphic status of glutathione-S-transferase genes in blood and tissue samples of prostate cancer patients. Asian Pac J Cancer Prev 2006; 7(3): 444-446
18 Li M, Guan TY, Li Y, et al. Polymorphisms of GSTM1 and CYP1A1 genes and their genetic susceptibility to prostate cancer in Chinese men. Chin Med J (Engl) 2008; 121(4): 305-308
19 Ansari SB, Vasudevan R, Bakhshi A, et al. Analysis of glutathione S-transferase (M1, T1 and P1) gene polymorphisms in Iranian prostate cancer subjects. Afr J Biotechnol 2010; 9(43): 7230-7235
20 Ashtiani ZO, Hasheminasab SM, Ayati M, et al. Are GSTM1, GSTT1 and CAG repeat length of androgen receptor gene polymorphisms associated with risk of prostate cancer in Iranian patients? Pathol Oncol Res 2011; 17(2): 269-275
21 Kumar V, Yadav CS, Datta SK, et al. Association of GSTM1 and GSTT1 polymorphism with lipid peroxidation in benign prostate hyperplasia and prostate cancer: a pilot study. Dis Markers 2011; 30(4): 163-169
22 Thakur H, Gupta L, Sobti RC, et al. Association of GSTM1T1 genes with COPD and prostate cancer in north Indian population. Mol Biol Rep 2011; 38(3): 1733-1739 23 Kwon DD, Lee JW, Han DY, et al. Relationship between the Glutathione-S-Transferase P1, M1, and T1 genotypes and prostate cancer risk in Korean subjects. Korean J Urol 2011; 52(4): 247-252
24 Choubey VK, Sankhwar SN, Tewari R, et al. Null genotypes at the GSTM1 and GSTT1 genes and the risk of benign prostatic hyperplasia: a case-control study and a meta-analysis. Prostate 2013; 73(2): 146-152
(2015-01-08收稿)
doi:10.3969/j.issn.1008-0848.2015.04.005
中图分类号R 737.25
Polymorphism of GSTM1 and prostate cancer in Asian people: a Meta-analysis
Huang Minzhi. Huang Yuqing, Yu Ziqiang, Zhou Huosheng, Li Jian, Zhang Heyuan, Feng Lingsong
Department of Second Urology, Meizhou People's Hospital, Meizhou, Guangdong 514031, China
AbstractObjective To explore the association between GSTM1 polymorphism and prostate cancer in Asian people. Methodsthods Databases, including Pubmed, EMBase, CBM, CNKI, VIP, Wanfang Data, were searched to get related studies. Data analysis was conducted by Revman 5.2 software and STATA 11.0 software. Resultssults Thirteen case-control studies were included. Totally, using M-H method in the random-effects model, the GSTM1 null genotype was associated with prostate cancer in Asian people (OR=1.42, 95% CI=1.10-1.82, P=0.007). In subgroup analysis, the GSTM1 null genotype was associated with prostate cancer in Indian and East Asian people (OR=1.73, 95% CI=1.18-2.53, P=0.005) (OR=1.43, 95% CI=1.02~2.02, P=0.04). There was no existence of publication bias. Conclusionusion This meta-analysis suggests that there may be a relationship between the GSTM1 null genotype and prostate cancer in Asian people.
Key wordsords Glutathione Transferase; Polymorphism, Single Nucleotide; Prostatic Neoplasms; metaanalysis
