高容量富锂层状材料Li2MnO3·2LiNi0.5Mn0.5O2的制备与表征
2015-08-01姜冬冬赵方辉杨其铭韦达鸿殷进超
姜冬冬,赵方辉, 杨其铭,韦达鸿,殷进超
(深圳清华大学研究院先进储能材料及器件实验室,广东深圳518057)
高容量富锂层状材料Li2MnO3·2LiNi0.5Mn0.5O2的制备与表征
姜冬冬,赵方辉, 杨其铭,韦达鸿,殷进超
(深圳清华大学研究院先进储能材料及器件实验室,广东深圳518057)
通过共沉淀法制备了富锂层状正极材料Li2MnO3·2 LiNi0.5Mn0.5O2,采用扫描电子显微镜(SEM)、X射线衍射分析(XRD)、循环伏安和恒流充放电测试对其结构和电化学性能进行了表征。研究结果表明富锂正极材料Li2Mn03· 2 Li Ni0.5Mn0.5O2具有相对高的比容量及良好的循环性能,首次放电比容量为187.2 mAh/g,首次充放电库仑效率为74.3%,第二次充放电库仑效率升至97.6%。经过30次循环,放电比容量仍有156.8 mAh/g,容量保持率为83.7%。
富锂材料;锂离子电池;共沉淀法
锂离子二次电池自商业化以来,已在便携式电子设备领域得到广泛应用,并开始应用于电动车、储能电站等能源交通领域,这对锂离子电池性能提出了更高的要求。现有的传统电极材料已越来越不能满足市场对二次电池能量密度、循环寿命、安全性等方面性能的需求。LiCoO2作为目前最广泛应用于商业化的正极材料具有工作电压高、放电平稳、循环性能好等优点,但钴资源稀少、价格高,而且对环境有一定污染[1];尖晶石结构的LiMn2O4具有较高的工作电压、价格低廉、环境友好等特点,但是可逆循环容量低,高温下容量衰减快[2];LiFePO4安全性高,循环寿命长,但电子电导率低,能量密度不高,低温性能差[3]。
我们采用共沉淀方法合成了Li2MnO3·2LiNi0.5Mn0.5O2正极材料,分子式也可表达为Li1.2Ni0.3Mn0.6O2.1,对该材料的结构、形貌进行了表征、并对其电化学性能进行了研究。
1 实验
1.1 材料制备
按计量比将硫酸锰,硫酸镍共同溶解于去离子水中形成混合溶液,然后将过渡金属混合溶液和含有一定浓度氨水NaOH溶液缓慢滴加到反应釜中,控制pH值在9~12之间,60℃水浴加热,形成过渡金属的氢氧化物共沉淀,搅拌至反应完全,沉淀物清洗烘干得到前驱体,接着将所得的前驱体与LiOH·H2O球磨混合均匀,马弗炉中高温烧结若干小时后随炉冷却得到富锂锰基层状固溶体类正极材料。
1.2 结构与形貌表征
使用D/max-A型转靶X射线衍射仪对合成材料进行结构分析,扫描范围10°~90°,使用场发射扫描电镜对材料进行形貌观察。
1.3 电化学性能测试
采用扣式模拟电池对材料进行电化学性能测试。按照正极活性材料∶导电剂∶粘接剂=90∶5∶5(质量比)的比例制成正极,以金属锂片为负极,Celgard2400聚丙烯微孔膜为隔膜,电解液为1 mol/L LiPF6/(EC+DMC+DEC)(体积比为1∶1∶1)溶液,在氩气手套箱组装成CR2032扣式电池,使用Land电池测试系统对半电池进行充放电测试,使用Princeton2273电化学工作站对电池进行循环伏安扫描。
2 结果与讨论
图1为制备的富锂层状正极材料Li2MnO3·2LiNi0.5Mn0.5O2的SEM图,可见材料由亚微米一次粒子团聚组成不规则颗粒,一次粒子尺寸较小,粒径分布均匀,粒径范围在0.2~1µm之间。

图1 Li2MnO3·2LiNi0.5Mn0.5O2的SEM图
图2是富锂材料Li2MnO·32LiNi0.5Mn0.5O2的XRD谱图。除了20°~25°的超晶格衍射峰外,其它衍射峰均与α-NaFeO2衍射峰对应,表明该材料具有典型的层状六方α-NaFeO2结构,空间群为R-3m。XRD谱中的(006)/(012)和(108)/(110)峰有明显的分裂,表明该材料具有明显的层状结构[13]。文献报导可以根据(003)与(104)峰的强度的比值来衡量阳离子混排程度,当<1.2时表明出现阳离子混排[14],该合成材料(003)与(104)峰强度的比值=1.4,说明该材料阳离子的有序度较高。

图2 Li2MnO3·2LiNi0.5Mn0.5O2的XRD谱图
通过循环伏安扫描与充放电测试对富锂材料电化学性能进行了研究,图3是富锂材料Li2MnO3·2 LiNi0.5Mn0.5O2电极的循环伏安(CV)曲线,首次CV曲线在4.0 V左右出现的主要氧化峰,对应充电脱锂过程中Ni2+氧化为Ni4+,在4.6 V出现的氧化峰对应富锂材料Li+、O2-的脱出[11],这是不可逆过程,接下来的充放电循环4.6 V峰不再出现。图3中前三次循环在3.7 V出现的还原峰对应富锂材料嵌锂过程Ni4+还原为Ni2+,3.5 V以下的不明显的还原峰对应Mn4+还原为Mn2+[15]。图3中5 V的氧化峰对应于电解液的氧化分解,1.5 V的还原峰的对应富锂材料的过嵌锂,可能有Li2MnO2相出现。

图3 Li2MnO3·2LiNi0.5Mn0.5O2电极的CV曲线
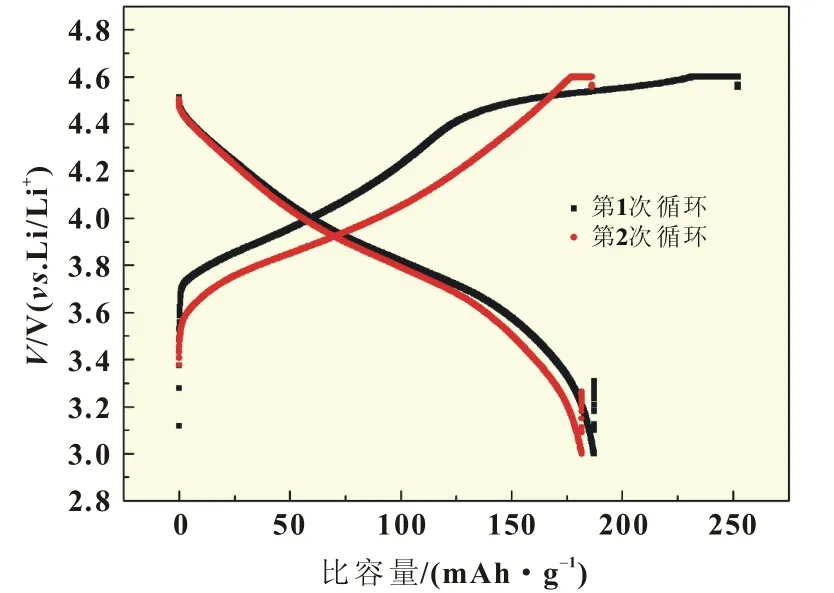
图4 Li2MnO3·2LiNi0.5Mn0.5O2的充放电曲线
富锂材料表现出相对高的比容量及良好的循环性能。图4是富锂材料Li2MnO3·2 LiNi0.5Mn0.5O2前两次充电放电曲线,充放电倍率为/10。首次充电曲线表现为两段充电过程,4.5 V以下充电曲线对应充电脱锂过程中Ni2+氧化为Ni4+,4.5 V以上充电对应富锂材料Li+、O2-的脱出[11],这和CV测试结果基本一致。富锂材料Li+、O2-的脱出过程是不可逆的,对应的4.5 V左右充电平台,该平台在随后的充放电过程中消失。充放电曲线显示,富锂材料的首次充电比容量为252.1 mAh/g,首次放电比容量为187.2 mAh/g,首次充放电库仑效率为74.3%。第二次充电比容量186.2 mAh/g,放电比容量为181.7mAh/g,库仑效率为97.6%。富锂材料首次充电至4.5 V以下电压时,充电过程富锂材料Li1.2Ni0.3Mn0.6O2.1脱锂,Ni2+氧化为Ni4+,富锂材料转变为Li0.6Ni0.3Mn0.6O2.1,理论充电比容量为174 mAh/g,这里及下文提到的比容量均按Li1.2Ni0.3Mn0.6O2.1初始质量计算得到。继续对富锂材料充电至4.5 V以上高电压,富锂材料有Li+、O2-的脱出,如富锂材料最后转变为Ni0.3Mn0.6O1.8,理论充电比容量为348 mAh/g。在放电过程中,Ni0.3Mn0.6O1.8嵌锂,Ni4+,Mn4+被还原,若放电完成后 Ni0.3Mn0.6O1.8转变为Li0.6Ni0.3Mn0.6O1.8,理论放电比容量为261 mAh/g,这时理论充放电库仑效率为75%。可知,富锂材料首次库仑效率低是因为充电至高电压富锂材料有Li+、O2-的脱出,且这个过程是不可逆的。第二次及以后的充电过程没有O2-的脱出,Li+脱嵌是可逆的,库仑效率提高接近100%。
随后的充放电比容量保持较为稳定,容量衰减较慢,图5是富锂材料Li2MnO3·2LiNi0.5Mn0.5O2的充放电循环曲线,经过30次循环,放电比容量仍有156.8 mAh/g,容量保持率为83.7%,富锂材料具有较好的循环性能。
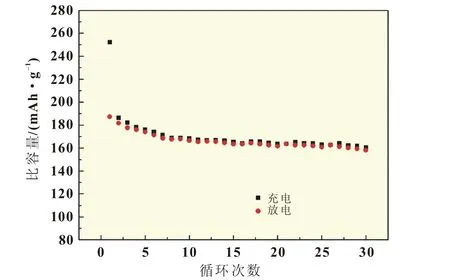
图5 Li2MnO3·2LiNi0.5Mn0.5O2的循环曲线
富锂材料大电流充电性能较差,图6是富锂材料半电池的倍率性能曲线,在0.1放电倍率条件下,放电比容量为187.1 mAh/g,以1倍率放电时,放电比容量降至111.8mAh/g,容量保持率仅为59.7%,要实现富锂材料在电动汽车领域的应用,富锂材料的倍率性能还需提高。
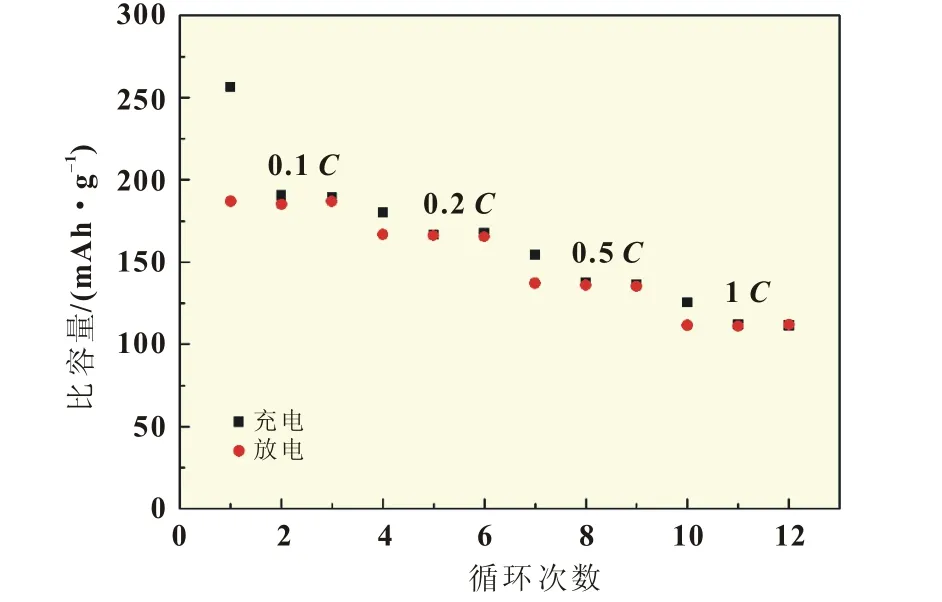
图6 Li2MnO3·2LiNi0.5Mn0.5O2的倍率性能曲线
3 结论
采用共沉淀法制备了富锂正极材料Li2MnO3·2LiNi0.5-Mn0.5O2,其具有较好的层状结构,并表现出较好的电化学性能。富锂正极材料具有相对高的比容量及好的循环性能,首次放电比容量为187.2 mAh/g,首次充放电库仑效率为74.3%,第二次充放电库仑效率升至97.6%。经过30次循环,放电比容量仍有156.8 mAh/g,容量保持率为83.7%。富锂材料大电流充电性能较差,要实现富锂材料在电动汽车领域的应用,富锂材料的倍率性能还需提高。
[1]SCROSATI B.Recent advances in lithium ion battery materials[J]. Electrochimica Acta,2000,45:2461-2466.
[2]LEE Y S,SUN Y K,NAHM K S.Synthesis of spinel LiMn2O4cathode material prepared by an adipic acid-assisted sol-gel method for lithium secondary batteries[J].Solid State Ioincs,1998,109:285-294.
[3]HU Y S,GUO Y G,DOMINKO R,et al.Improved electrode performance of porous LiFePO4using RuO2as an oxidic nanoscale interconnect[J].Advanced Materials,2007,19:1963-1966.
[4]JOHNSON C S,LI N,LEFIEF C,et al.Synthesis,characterization and electrochemistryof lithium batteryelectrodes:Li2MnO3·(1-)-LiMn0.333Ni0.333Co0.333O2(0≤≤0.7)[J].Chemistry of Materials,2008,20:6095-6106.
[5]KANG S H,THACKERAY M M.Stabilization ofLi2MnO3·(1-)-LiMO2electrode surfaces(M=Mn,Ni,Co)with mildly acidic,fluorinated solutions[J].Journal of the Electrochemical Society,2008,155:A269-A275.
[6]HUANG X K,ZHANG Q S,CHANG H T,et al.Hydrothermal synthesis of nanosized LiMnO2-Li2MnO3compounds and their electrochemical performances[J].Journal of The Electrochemical Society,2009,156:A162-A168.
[7]LIU J L,CHEN L,HOU M Y,et al.General synthesis ofLi2MO3·n-(1-)LiMn1/3Ni1/3Co1/3O2nanomaterials by a molten-salt method: Towards a high capacity and high power cathode for rechargeable lithium batteries[J].Journal of Materials Chemistry,2012,22:25380-25387.
[8]AMALRAJ F,KOVACHEVA D,TALIANKER M,et al.Synthesis of integrated cathode materialsLi2MnO3·(1-)LiMn1/3Ni1/3Co1/3O2(=0.3,0.5,0.7)and studies of their electrochemical behavior[J]. Journal of The Electrochemical Society,2010,157:A1121-A1130.
[9]YU L Y,QIU W H,HUANG J Y,et al.Synthesis and electrochemical characteristics ofLi2MnO3·(1-)Li(Nil/3Co1/3Mnl/3)O2compounds[J].International Journal of Minerals,Metallurgy and Materials,2009,16:458-462.
[10]HE Z J,WANG Z X,GUO H J,et al.Synthesis and electrochemical performance ofLi2MnO3·(1-)LiMn0.5Ni0.4Co0.1O2for lithium ion battery[J].Powder Technology,2013,235:158-162.
[11]ARMSTRONG A R,HOLZAPFEL M,NOVAK P,et al.Demonstrating oxygen loss and associated structural reorganization in the lithium battery cathode Li[Ni0.2Li0.2Mn0.6]O2[J].Journal of the American Chemical Society,2006,128:8694-8698.
[l2]KANG S H,KEMPGENS P,GREENBAUM S,et al.Interpreting the structural and electrochemical complexity of 0.5Li2MnO3· 0.5LiMO2electrodes for lithium batteries(M=Mn0.5-Ni0.5-Co2, 0≤≤0.5)[J].JournalofMaterialsChemistry,2007,17:2069-2077.
[13]OHZUKU T,UEDA A,NAGAYAMA M.Electrochemistry and structural chemistry of LiNiO2(R3m)for 4 volt secondary lithium cells[J].Journal of The Electrochemical Society,1993,140:1862-1870.
[14]SHAJU K M,RAO G V,CHOWDARI B V.Performance of layered Li(Ni1/3Co1/3Mn1/3)O2as cathode for Li-ion batteries[J].Electrochimica Acta,2002,48:145-151.
[15]LU Z,DAHN J R.Structure and electrochemistry of layered Li[Cr-Li(1/3-/3)Mn(2/3-2/3)]O2[J].Journal of the Electrochemical Society,2002,149:A1454-A1459.
Fabrication and characterization of lithium-rich layered cathode material Li2MnO3·2 LiNi0.5Mn0.5O2with high capacity
JIANG Dong-dong,ZHAO Fang-hui,YANG Qi-ming,WEI Da-hong,YIN Jin-chao
The lithium-rich layered cathode material Li2MnO3·2 LiNi0.5Mn0.5O2was fabricated by co-precipitation method. The structure and electrochemical properties of the material were examined using scanning electron microscopy(SEM),X-ray diffraction(XRD),cyclic voltammetry and galvanostatic charging and discharging test.The results show that the material has high capacity and good cycle performance.The first discharge special capacity is 187.2 mAh/g;the first and second cycle coulombic efficiency are respectively 74.3%and 97.6%.After 30 cycles,the discharge special capacity still remains 156.8 mAh/g,which is 83.7%of that of the first cycle.
lithium-rich material;lithium ion battery;co-precipitation
TM 912.9
A
1002-087 X(2015)04-0668-03

2014-09-03
深圳市战略性新兴产业发展专项资金(JCYJ2012-0619140959431,ZDSY20120619141659791)
姜冬冬(1985—),男,江西省人,工程师,主要研究方向为先进储能材料与器件。
